- 1003.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
绝密★启封并使用完毕前
试题类型:
2016年普通高等学校招生全国统一考试
理科综合能力测试(化学)(北京卷)
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分.
2.答题前,考生务必将自己的姓名、准考证号填写在本试题相应的位置.
3.全部答案在答题卡上完成,答在本试题上无效.
4.考试结束后,将本试题和答题卡一并交回.
第一部分(选择题共120分)
本部分共20 小题,每小题6分,共120分。在每小题列出的四个选项中,选出最符合题目要求的一项。
6.我国科技创新成果斐然,下列成果中获得诺贝尔奖的是
A.徐光宪建立稀土串级萃取理论
B.屠呦呦发现抗疟新药青蒿素
C.闵恩泽研发重油裂解催化剂
D.侯德榜联合制碱法
7.下列中草药煎制步骤中,属于过滤操作的是
A.冷水浸泡
B.加热煎制
C.箅渣取液
D.灌装保存
8.下列食品添加剂中,其试用目的与反应速率有关的是
A.抗氧化剂 B.调味剂 C.着色剂 D.增稠剂
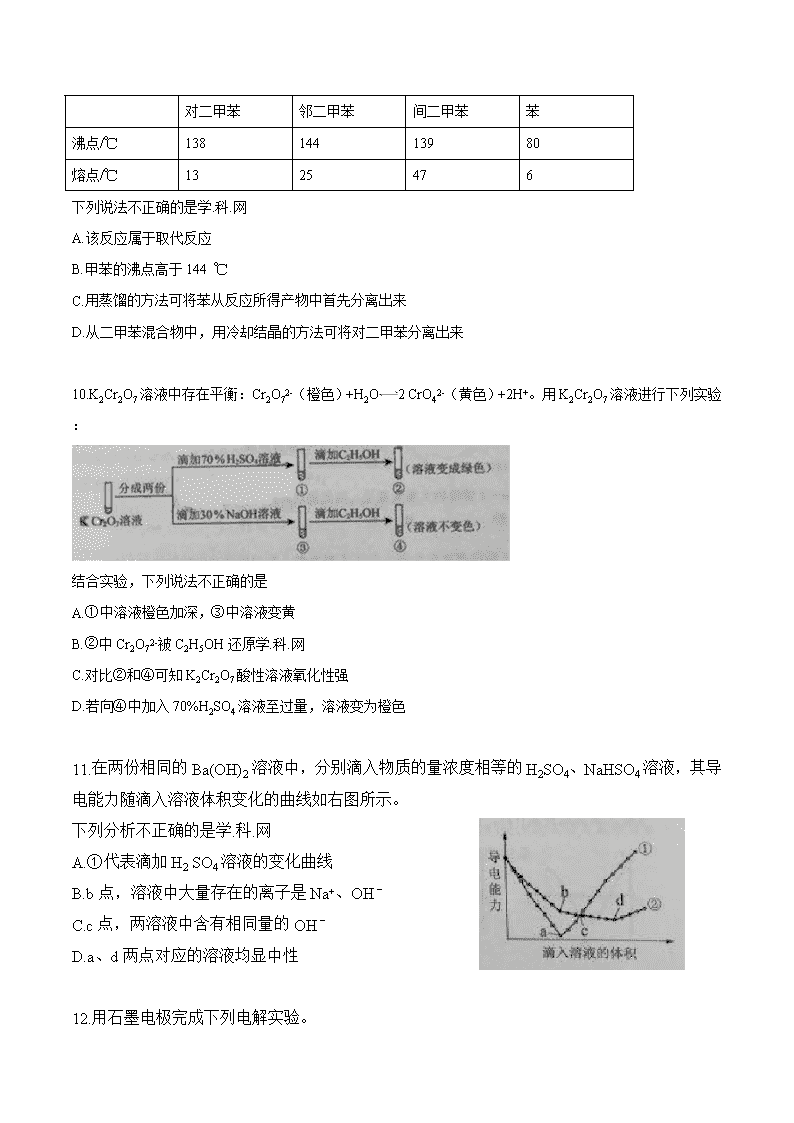
9.在一定条件下,甲苯可生成二甲苯混合物和苯。有关物质的沸点、熔点如下:
对二甲苯
邻二甲苯
间二甲苯
苯
沸点/℃
138
144
139
80
熔点/℃
13
25
47
6
下列说法不正确的是学.科.网
A.该反应属于取代反应
B.甲苯的沸点高于144 ℃
C.用蒸馏的方法可将苯从反应所得产物中首先分离出来
D.从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来
10.K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2 CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
结合实验,下列说法不正确的是
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原学.科.网
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
11.在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如右图所示。
下列分析不正确的是学.科.网
A.①代表滴加H2 SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
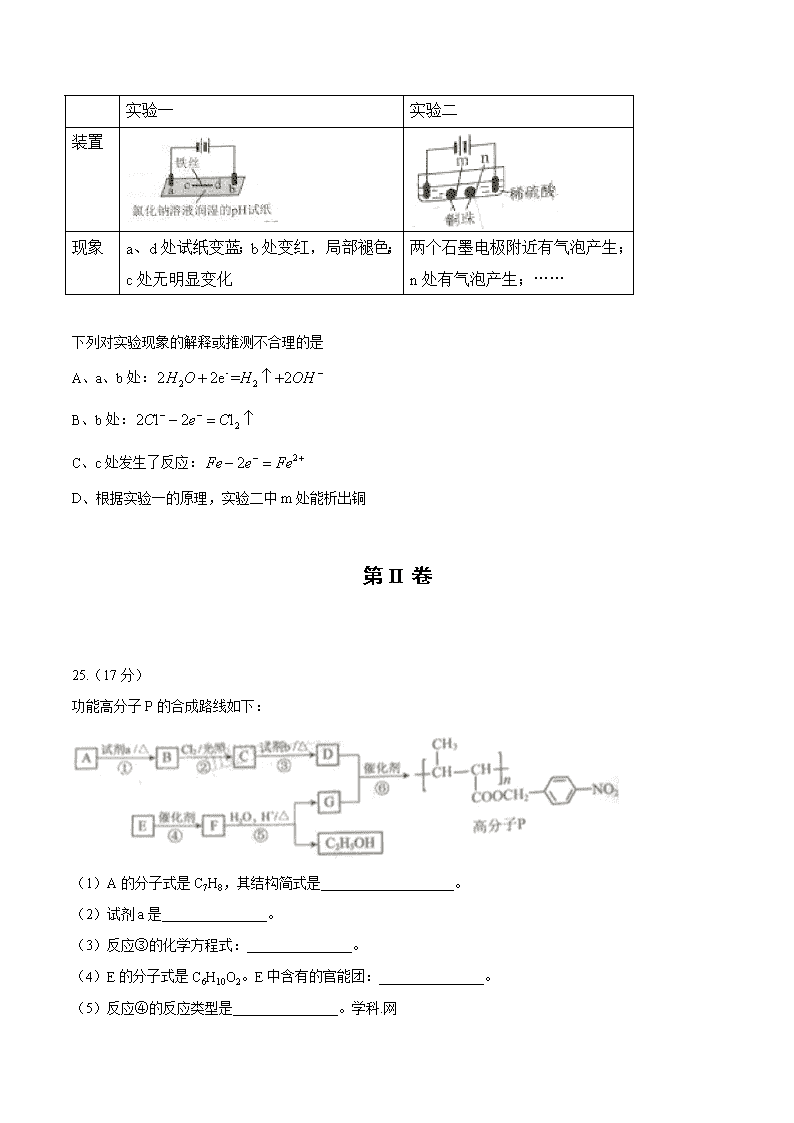
12.用石墨电极完成下列电解实验。
实验一
实验二
装置
现象
a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化
两个石墨电极附近有气泡产生;n处有气泡产生;……
下列对实验现象的解释或推测不合理的是
A、a、b处:
B、b处:
C、c处发生了反应:
D、根据实验一的原理,实验二中m处能析出铜
第II卷
25.(17分)
功能高分子P的合成路线如下:
(1)A的分子式是C7H8,其结构简式是___________________。
(2)试剂a是_______________。
(3)反应③的化学方程式:_______________。
(4)E的分子式是C6H10O2。E中含有的官能团:_______________。
(5)反应④的反应类型是_______________。学科.网
(6)反应⑤的化学方程式:_______________。
(5)已知:2CH3CHO。
以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。
26.(13分)
用零价铁(Fe)去除水体中的硝酸盐(NO3—)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3—的反应原理如右图所示。
①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
初始pH
pH=2.5
pH=4.5
NO3—的去除率
接近100%
<50%
24小时pH
接近中性
接近中性
铁的最终物质形态
pH=4.5时,NO3—的去除率低。其原因是________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:学科&网
Ⅰ. Fe2+直接还原NO3—;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如右图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。
pH =4.5(其他条件相同)
(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
初始pH
pH=2.5
pH=4.5
NO3—的去除率
约10%
约3%
1小时pH
接近中性
接近中性
与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:__________。
27.(12分)
以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42−2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a. 向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.______________。
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)NaHPbO2
(aq),其溶解度曲线如图所示。
①过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是_____(选填序号)。
A.减少PbO的损失,提高产品的产率
B.重复利用NaOH,提高原料的利用率
C.增加浓度,提高脱硫效率
② 过程Ⅲ的目的是提纯。结合上述溶解度曲线,简述过程Ⅲ的操作:_________。
28.(16分)
以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验
试剂
现象
滴管
试管
2 mL
0.2 mol·L−1 Na2SO3溶液
饱和Ag2SO4溶液
Ⅰ.产生白色沉淀
0.2 mol·L−1 CuSO4
Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀
0.1 mol·L−1 Al2(SO4)3溶液
Ⅲ.开始无明显变化,继续滴加产生白色沉淀
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:____________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42−,含有Cu+、Cu2+和SO32−。
已知:Cu+Cu +Cu2+,Cu2+CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。
②通过下列实验证实,沉淀中含有Cu2+和SO32−。
a.白色沉淀A是BaSO4,试剂1是____________。
b.证实沉淀中含有Cu+和SO32−的理由是___________。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42−,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。学.科网
①推测沉淀中含有亚硫酸根和________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.呗Al(OH)3所吸附;ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。学.科网
a.将对比实验方案补充完整。
步骤二:_____________(按上图形式呈现)。
(4)根据实验,亚硫酸盐的性质有___________。盐溶液间反应的多样性与__________有关。
2016年普通高等学校招生全国统一考试(北京卷)
理科综合化学部分
6.B 7.C 8.A 9.B 10.D 11.C 12.B
25.(17分)
(1)
(2)浓硫酸和浓硝酸
(3)
(4)碳碳双键、酯基
(5)加聚反应
(6)
(7)
26.(13分)
(1)①铁 ②NO3-+8e-+10H+=NH4++3H2O,
(2)FeO(OH)不导电,阻碍电子转移
(3)①本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率。
②Fe2++2FeO(OH)=Fe3O4+2H+, Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4
,利于电子的转移。
(4)初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足。
27.(12分)
(1)Pb + PbO2 + 2H2SO4== 2PbSO4+ 2H2O。
(2)①2Fe3++Pb+SO42—==PbSO4+2Fe2+;②取a中红色溶液少量,加入过量Pb,充分反应后,红色褪去。
(3)①A、B;②将粗PbO溶解在一定量35%NaOH溶液中,加热至110℃,充分溶解后,趁热过滤,冷却结晶,过滤得到PbO固体。
28.(16分)
(1)2Ag++SO32—Ag2SO4↓。
(2)①有红色固体生成;②a. HCl和BaCl2溶液。
b.在I-的作用下,Cu2+转化为白色沉淀CuI,SO32-转化为SO42-。
(3)①Al3+、OH-。
②a、,b、V1明显大于V2。
(4)亚硫酸盐的溶解性、氧化还原性、在水溶液中的酸碱性;两种盐溶液中阴阳离子的性质和反应条件。