- 855.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
陌生电极反应方程式的书写
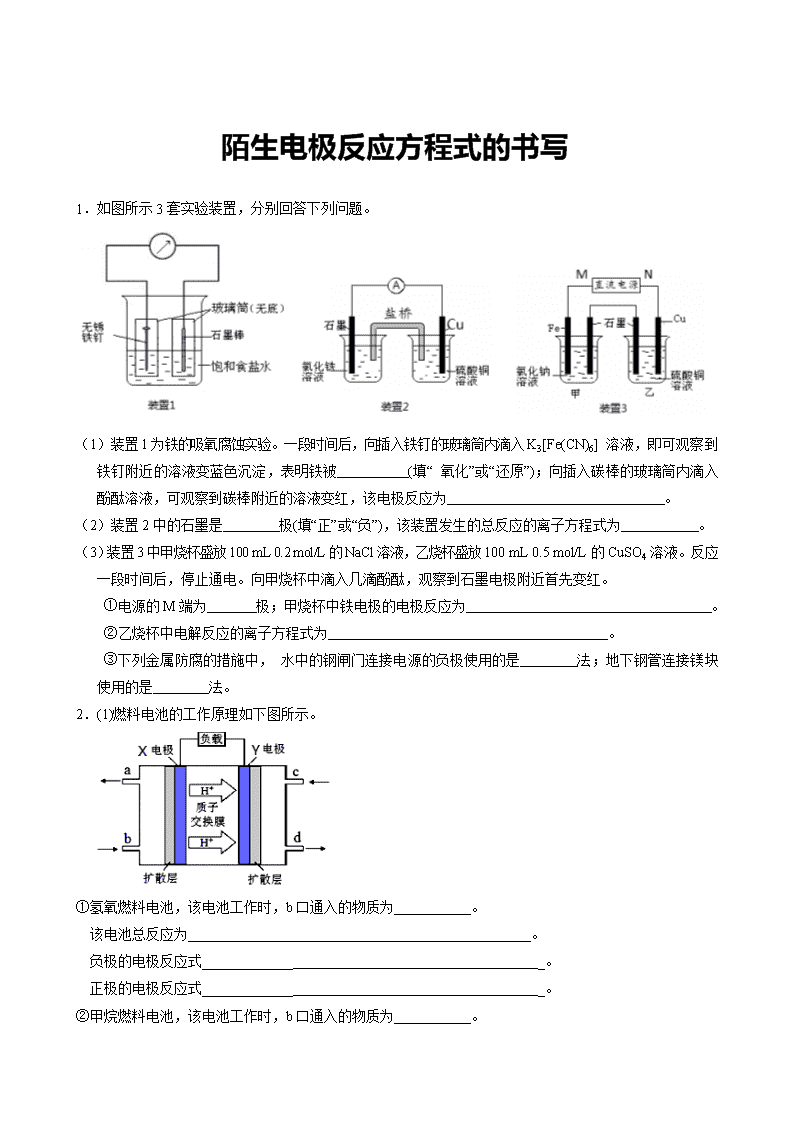
1.如图所示3套实验装置,分别回答下列问题。
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6] 溶液,即可观察到铁钉附近的溶液变蓝色沉淀,表明铁被 (填“ 氧化”或“还原”);向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。
(2)装置2中的石墨是 极(填“正”或“负”),该装置发生的总反应的离子方程式为 。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为 极;甲烧杯中铁电极的电极反应为 。
②乙烧杯中电解反应的离子方程式为 。
③下列金属防腐的措施中, 水中的钢闸门连接电源的负极使用的是 法;地下钢管连接镁块使用的是 法。
2.(1)燃料电池的工作原理如下图所示。
①氢氧燃料电池,该电池工作时,b口通入的物质为___________。
该电池总反应为_____________ _。
负极的电极反应式_____________ _。
正极的电极反应式_____________ _。
②甲烷燃料电池,该电池工作时,b口通入的物质为___________。
该电池总反应为_____________ _。
负极的电极反应式_____________ _。
正极的电极反应式_____________ _。
③甲醇燃料电池,该电池工作时,b口通入的物质为___________。
该电池总反应为_____________ _。
负极的电极反应式_____________ _。
正极的电极反应式_____________ _。
④乙醇燃料电池,该电池工作时,b口通入的物质为___________。
该电池总反应为_____________ _。
负极的电极反应式_____________ _。
正极的电极反应式_____________ _。
⑤甲醇/过氧化氢燃料电池,该电池工作时,b口通入的物质为___________。
该电池总反应为_____________ _。
负极的电极反应式_____________ _。
正极的电极反应式_____________ _。
(2)利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:
①若A为CO,B为H2,C为CH3OH,则通入CO的一极电极反应式 。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为 。
③若A为NO2,B为O2,C为HNO3,则负极的电极反应式为 。
③若A为NO,B为O2,C为HNO3,则负极的电极反应式为 。
(3)工业上可采用电化学的方法获得N2H4,装置如右图所示,则通入氧气的 一极为 (填“正极”、“负极”),NH3反应的电极反应式为 。肼(N2H4)可以在纯氧中燃烧生成氮气和水,为了充分利用其能量, 有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式 。
(4)①熔融碳酸盐CO燃料电池工作原理如图所示,A、B极的电极反应分别是 、
。
第2(4)①题 第2(4)②题
②碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650 ℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1∶1)直接做燃料,其工作原理如图所示。
电池负极反应式为 。
③NO2、O2和熔融NaNO3可制作燃料电池,其原理见右图,石墨Ⅰ为电池的 极;该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,其电极反应式为 。氧气在石墨Ⅱ电极上发生的电极反应式为 。
第2(4)③题 第2(5)①题
(5)①以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,右图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。回答下列问题:
A极为电池 极,电极反应式为 。B电极发生的电极式为 。
②如图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-(O2+4e-=2O2-)。
d电极的名称为___________,d电极上的电极反应式为:
___ _________________。
③依据反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—移向_ ___极(填“正”或“负”);电池的负极反应式为 。
3.(1)右图表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式 。生产中可分离出的物质A的化学式为 。
第3(1)图 第3(2)图
(2)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种葡萄糖微生物燃料电池中,电解质溶液为酸性,示意图如下:
①该电池外电路电子的流动方向为 (填写“从A到B”或“从B到A”)。
②葡萄糖发生的电极反应式为 。
(3)由Mg可制成“镁-次氯酸盐”燃料电池,其装置示意图如右图,则Mg是该电池的 极,该电池反应的离子方程式为 ___________ ____ ___ _______。
第3(3)图 第3(4)图
(4)直接硼氢化物燃料电池的原理如图,负极的电极反应式为 。电池总反应的离子方程式为 。
4.用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:
Ni(OH)2+M NiO(OH)+MH
电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
5.电化学气敏传感器法是测定汽某些气体含量常用的方法之一。
①CO传感器的工作原理如下图所示,则工作电极的反应式为 。
②氯气含量检测仪中,原电池工作原理示意图如图:则Cl2在Pt电极放电的电极反应为____________。
③连续自动监测氮氧化物(NOx)的仪器——动态库仑仪已获得实际应用。它的工作原理如下图所示。NiO电极上NO发生的电极反应式为 。
6.科学家用氮化镓材料与铜组装如右图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。
写出铜电极表面的电极反应式 ,为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“盐酸”或“硫酸”).
7.(2016·浙江)催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3 H2(g) CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CO2(g)+ H2(g) CO(g)+H2O(g)ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
T(K)
催化剂
CO2转化率(%)
甲醇选择性(%)
543
Cat.1
12.3
42.3
543
Cat.2
10.9
72.7
553
Cat.1
15.3
39.1
553
Cat.2
12.0
71.6
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l) H2O(g) ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在 极,该电极反应式是 。
8.(2016·天津)氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH−FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
①电解一段时间后,c(OH−)降低的区域在______ _(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_____ __。
③c( Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)
低于最高值的原因:____________ _。
9.(2015·山东)利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为__________溶液(填化学式),阳极电极反应式为__________ ,电解过程中Li+向_____电极迁移(填“A”或“B”)。
第4题图 第5题图
10.(2015·北京)(4)利用下图所示装置从海水中提取CO2,有利于减少环境温室气体含量。
①结合方程式简述提取CO2的原理: 。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是
。
11.(2014·江苏)硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)将烧碱吸收H2S后的溶液加入到如题20图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e-S (n—1)S+ S2- Sn2-
①写出电解时阴极的电极反应式: 。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成 。
12.(2014·全国理综II)铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(3)PbO2可由PbO与次氯酸钠溶液反应制得反应的离子方程式为 ;PbO2也可以通过石墨为电极Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式为_ _ 。阴极上观察到的现象是_ _ ;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为
_,这样做的主要缺点是_ 。
13.(2014·全国理综I卷)次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性。回答下列问题:
(4)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
①写出阳极的电极反应____________________________________。
②分析产品室可得到H3PO2的原因___________________________________。
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有 杂质,该杂质产生的原因是 。
14.(2014·重庆卷)氢能是最重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(4)一定条件下,题11图所示装置可实现有机物的电化学储氢(忽略其它有机物)。
①导线中电子转移方向为 。(用A、D表示)②生成目标产物的电极反应式为 。
15.(1)[2013·重庆理综,11(2)]电化学降解NO的原理如图所示。
①电源正极为_______(填“A”或“B”),阴极反应式为______________________________。
(2)[2013·福建理综,23(2)②]利用H2S废气制取氢气的方法有多种。其中电化学法如图所示。反应池中反应物的流向采用气、液逆流方式,其目的是____ ____;反应池中发生反应的化学方程式为______________ ____。反应后的溶液进入电解池,电解总反应的离子方程式为________ ____。
(3)[2013·山东理综,28(3)(4)]①下图为电解精炼银的示意图,________(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为________。
②为处理银器表面的黑斑(Ag2S),将银器浸于铝质容器里的食盐水中并与铝接触,使Ag2S转化为Ag,食盐水的作用是________________。
(4)[2012·新课标全国卷,36(3)]粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板应是图中电极________(填图中的字母);在电极d上发生的电极反应式为__________;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为_______________________________________________。
(5)(2012·海南,16)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
回答下列问题:
①甲烷燃料电池正极、负极的电极反应分别为__________________、__________________________。
②闭合K开关后,a、b电极上均有气体产生,其中b电极上得到的是__________,电解氯化钠溶液的总反应方程式为__________________________________。
(6)(2012·重庆)尿素[CO(NH2)2]是首个由无机物人工合成的有机物。人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如图。
①电源的负极为 (填“A”或“B”)。
②阳极室中发生的反应依次为 、 。
③电解结束后,阴极室溶液的pH与电解前相比将 ;若两极共收集到气体13.44L(标准状况),则除去的尿素为 g(忽略气体的溶解)。
16.(2014·山东卷)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
17.(2011·广东)由熔盐电解法获得的粗铝含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下:
(注:NaCl熔点为801 ℃;AlCl3在181 ℃升华)
(4)镀铝电解池中,金属铝为________极。熔融盐电镀液中铝元素和氯元素主要以AlCl和Al2Cl形式存在,铝电极的主要电极反应式为____________________________。
18.(2015·新课标II)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效低毒的消毒剂,回答下列问題:
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
①电解时发生反应的化学方程式为 。
19.(2015·广东)32.(16分)七铝十二钙(12CaO·7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为 。
20.(2014·北京)NH3经一系列反应可以得到HNO3,如下图所示。
(4)IV中,电解NO制备 NH4NO3,其工作原理如右图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____________,说明理由:_______________ _。