- 586.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2013年全国高考模拟题分类汇总
专题三:水溶液中的电离平衡 难溶电解质的溶解平衡
5.(天津)归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
① pH =1的强酸溶液,加水稀释后,溶液中所有离子的浓度均降低。
② pH=2的盐酸和pH=1的醋酸,c(H+)之比为2∶1。
③在Na2CO3和NaHCO3溶液中均存在下列关系
c(Na+)+c(H+)=c(OH-)+c(HCO3
)+2c(CO32-)
④ 反应2A (s) + B (g)=2C (g) + D (g) 不能自发进行,则该反应△H一定大于0
⑤ 已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为:Ka·Kh=Kw
⑥ 反应A(g)2B(g);△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能
为Eb kJ·mol-1,则△H =(Ea -Eb)kJ·mol-1。其归纳正确的是
A.①②③⑥ B.③④⑤⑥ C.②④⑤⑥ D.①③④⑤
6. (天津)一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时。已知下表数据
物质
Fe(OH)2
Cu(OH)2
Fe(OH)3
Ksp/25℃
8.0×10-16
2.2×10-20
4.0×10-38
完全沉淀时的PH值
≥9.6
≥6.4
3~4
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是
A. 向该溶液中加少量铁粉不能观察到红色固体析出
B. 该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4
C. 向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
D. 向该溶液中加入适量氯水,并调节pH值到3~4后过滤,得到纯净的CuSO4溶液
28、(衡水中学))工业上常用还原沉淀法处理含铬废水(Cr2O72—和CrO42—),其流程为:
已知:
(1)步骤①中存在平衡:2Cr O42—(黄色)+2H+Cr2O72—(橙色)+H2O
(2)步骤③生成的Cr(OH)3 在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)Cr3+(aq)+3OH 一(aq)
(3)常温下,Cr(OH)3 的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1 时可视作该离子不存在下列有关说法中,正确的是( )
A.步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42—离子浓度增大
B.步骤①中当2v(CrO42 一)=v(Cr2O72—)时,说明反应2CrO42—(黄色)+2H+Cr2O72—(橙色)+H2O 达到平衡状态
C.步骤②中,若要还原1 mol Cr2O72一离子,需要12 mol(NH4)2Fe(SO4)2·6H2O。
D.步骤③中,当将溶液的pH 调节至6 时,则可认为废水中的铬已除尽
13、(衡水中学)从下列事实所得出的结论或给出的解释正确的是
实验事实
结论或解释
A
将40 g NaOH溶于1 L蒸馏水中
该溶液的物质的量浓度为1mol﹒L-1
B
0.1 mol/L CH3COOH溶液在稀释过程中
将变小
C
酸H2X为弱酸
常温下,盐NaHX溶液pH一定大于7
D
在溶液的稀释过程中
离子浓度:有的可能增大,有的可能减小,有的可能不变
23、(衡水中学)下列各溶液中,有关成分的物质的量浓度关系正确的是 ( )
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
D.pH相等的(NH4)2SO4、 (NH4)2Fe (SO4)2、NH4Cl溶液:
c(NH4Cl)<c[(NH4)2Fe (SO4)2]< c[(NH4)2SO4]
11、(衡水中学)将pH=3的盐酸a L 分别与下列三种溶液混合后,混合液均呈中性;
①的氨水 ②的氨水cL
③的的溶液
其中a、b、c、d的关系正确的是
A. B. C. D.
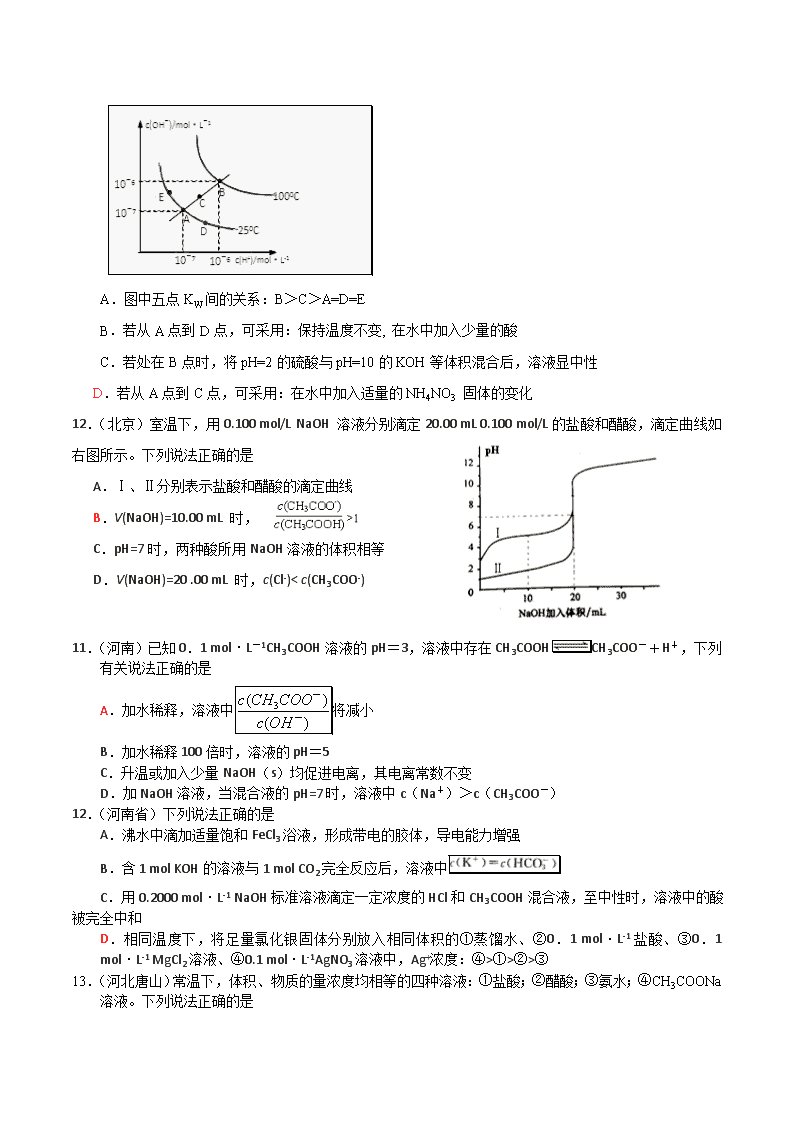
18、(衡水中学)水的电离平衡曲线如图所示,下列说法不正确的是 ( )
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用:保持温度不变, 在水中加入少量的酸
C.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
D.若从A点到C点,可采用:在水中加入适量的NH4NO3 固体的变化
12.(北京)室温下,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如右图所示。下列说法正确的是
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.V(NaOH)=10.00 mL 时,
C.pH=7时,两种酸所用NaOH溶液的体积相等
D.V(NaOH)=20 .00 mL 时,c(Cl-)< c(CH3COO-)
11.(河南)已知0.1 mol·L-1CH3COOH溶液的pH=3,溶液中存在CH3COOHCH3COO-+H+,下列有关说法正确的是
A.加水稀释,溶液中将减小
B.加水稀释100倍时,溶液的pH=5
C.升温或加入少量NaOH(s)均促进电离,其电离常数不变
D.加NaOH溶液,当混合液的pH=7时,溶液中c(Na+)>c(CH3COO-)
12.(河南省)下列说法正确的是
A.沸水中滴加适量饱和FeCl3浴液,形成带电的胶体,导电能力增强
B.含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中
C.用0.2000 mol·L-1 NaOH标准溶液滴定一定浓度的HCl和CH3COOH混合液,至中性时,溶液中的酸
被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1 MgCl2溶液、④0.1 mol·L-1AgNO3溶液中,Ag+浓度:④>①>②>③
13.(河北唐山)常温下,体积、物质的量浓度均相等的四种溶液:①盐酸;②醋酸;③氨水;④CH3COONa溶液。下列说法正确的是
A.将①与②分别稀释相同倍数后溶液的pH:①>②
B.③与④中已电离的水分子的数目相等
C.若②与③混合后溶液呈中性,则在常温下Ka(CH3COOH)=Kb(NH3·H2O)
D.②与④混合所得溶液显酸性,则:c(CH3COO-)+c(OH-)C>A=D=E
B.若从A点到C点,可采用温度不变在水中加入适量NH4 Cl的方法
C.E点对应的水溶液中,可能有NH4+、Ba2+、Cl-、I-大量同时存在
D.若处在B点时,将pH =2的硫酸溶液与pH = 10的KOH溶液等体积混合,所得溶液呈中性
8.(北京怀柔)下列说法正确的是
A.镁与极稀硝酸反应生成硝酸铵的离子方程式为:
4Mg+6H++NO3- =4Mg2++NH4++3H2O
B.25℃时,将20 mL 0.1mol·L-1H2SO4溶液和30 mL 0.15mol·L-1NaOH溶液混合,若混合后溶液体积不变,则混合溶液的pH为11
C.将10 mL 0.1 mol·L-1KAI(SO4)2溶液和10 mL0.2 mol·L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2
D.浓度均为0.1 mol·L-1的醋酸和CH3COONa溶液等体积混合,溶液中有下列关系:
c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
12.(北京海淀)下列说法不正确的是
A.将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸
B.相同pH的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A)
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:
c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
12、(北京丰台)已知:(CH3COOH) 2(g) 2CH3COOH(g)经试验测得在不同压强下体系的平均相对分子质量(M)随温度T的变化曲线如图所示,下列说法正确的是
A、该过程的△H<0
B、平衡常数: K(a)=K(b)c(CH3COO-)>c(H+)>c(OH-)
B. W 点所表示的溶液中: c(Na+)+c(H+)= c(CH3COOH)+c(OH-)
C. pH = 3. 5 的溶液中: c(CH3COOH) + c(CH3COO-) = c(Na+)
D. 向W 点所表示的1. 0 L 溶液中通入0. 05 mol HCl 气体(溶液体积变化可忽略):
c(H+)= c(CH3COOH)+c(OH-)
6.(四川绵阳)25°C时,的醋酸、醋酸钠混合溶液中,与pH的关系如图所示。下列有关该溶液的叙述不正确的是
A. pH=4的溶液中:
B. W点所表示的溶液中:
C. 将W点所表示的1.0L溶液稀释到10L,用pH计测量,溶液的pH应为5.75
D. pH=5.5的溶液中:
12.(北师特)将AgCl分别加入盛有:①5 mL水;② 6 mL 0.5 mol/L NaCl溶液;
③10 mL 0.2 mol/L CaCl2溶液;④50 mL 0.1 mol/L 盐酸的烧杯中,均有固体剩余,各溶液中c(Ag+)从大到小的顺序排列正确的是
A.④③②① B.②③④① C.①④③② D.①③②④
12.(北京)常温下,向体积为1 0 mL、物质的量浓度均为0.1 mol/L的盐酸和醋酸的混合溶液中滴入0.1 mol/L NaOH溶液。下列说法错误的是
A.加入NaOH溶液后,溶液一定满足: c(H+)+c(Na+)=c(OH—)+c(C1—)+c(CH3COO)
B.加入10 mLNaOH溶液时,溶液满足(溶液体积变化忽略不计):
c(CH3COO—)+c(CH3COOH)=0.05 mol/L
C.加入15 mLNaOH溶液时,呈酸性,溶液满足:
c(Na+)>c(C1—)>c(CH3COO—)>c(CH3COOH)>c(H+)>c(OH—)
D.加入足量NaOH溶液时,溶液中发生的中和反应的热化学方程式表示为:
H+(aq)+OH—(aq)===H2O(1) △H= 一57.3 kJ·mol—1
11.(北京)下列有关电解质溶液中粒子的物质的量浓度关系正确的是 ( )
A.在0.1mol·L—1NaHCO3溶液中:c(Na+)>c(HCO3—)>c(CO32—)>c(H2CO3)
B.在0.1mol·L—1Na2CO3溶液中:c(OH—)—c(H+)=c(HCO4—)+2c(H2CO3)
C.向0.2mol·L—1NaHCO3溶液中加入等体积0.1mol·L—1NaOH溶液:
c(CO32—)>c(HCO3—)>c(OH—)>c(H+)
D.常温下,pH=7的CH3COONa和CH3COOH混合溶液: c(Na+)+c(CH3COO—)=c(H+)+c(OH—)
11.(长安一中)下列说法正确的是
A.常温下,将pH =11的氨水稀释到原体积的10倍后,溶液的pH=10
B.为确定某酸H2A是强酸还是弱酸.可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.l mol/L),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1 moI/L硝酸银溶液中,Ag+浓度:①>④=②>③
13.(长安区)下列溶液中的微粒浓度关系一定正确的是
A.pH =6的溶液中一定有c(H+)>c(OH—)
B.已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有
c(Mg2+)=c(CO2—3),且c(Mg2+)·c(CO2—3)=6.82×10-6
C.常温下pH=11的NaOH与pH =3的CH3COOH等体积混合后:c(Na+)> c(CH3COO—)
D.0.2mol/L氨水与0.1mol/LHCI溶液等体积混合:2c(H+)- 2c(OH—)= c(NH3·H2O)-c(NH+4)
12、(青海西宁)下列溶液中微粒的物质的量关系正确的是( )
A. 将等物质的量的KHC2O4和H2C2O4溶于水配成溶液:2c(K+)=c(HC2O4-)+c(H2C2O4)
B. pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小:①=②>③
C. 0.1mol/LCH3COONa溶液与0.15mol/LHCl等体积混合:c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-)
D. 0.1mol/L的KHA溶液,其pH=10,c(K+)>c(A2-)>c(HA-) >c(OH-)
9. (银川一中五次)下列溶液中,微粒浓度关系正确的是
A. 含有、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)> >>
B. pH=6的醋酸与醋酸钠的混合溶液中,>
C. 0.1 mol/L 的Na2S溶液中,
D. pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中,一定是
12.(银川一中)下列叙述正确的是
A.将一定体积醋酸溶液加水到原来体积的m倍,则pH增大m
B.在NaHCO3溶液中,c(Na+)=c(HCO3-)+c(H2CO3)
C.25℃,pH=8的NaOH溶液和pH=8的氨水中,由水电离出的c(OH-)不相等
D.25℃,pH=13的Ba(OH)2溶液和pH=1的盐酸中均存在:c(H+)·c(OH-)=1×10-14
12.(宁夏育才)下列液体均处于25℃,有关叙述正确的是
A.某物质的溶液pH < 7,则该物质一定是酸或强酸弱碱盐
B.pH = 4.5的番茄汁中c(H+)是pH = 6.5的牛奶中c(H+)的100倍
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D.pH = 5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) > c(CH3COO-)
11、(银川二中)下列叙述正确的是
A.醋酸溶液的pH=a,将此溶液加水稀释后,溶液中各微粒浓度均减小
B.将浓度均为0.01 mol·L-1的CH3COOH和CH3COONa溶液等体积混合后,溶液中:
c(CH3COOH)+c(CH3COO-)=0.01mol·L-1
C.将等体积,pH值均为3的醋酸和盐酸,分别加水稀释至amL和bmL,稀释后溶液的pH值均为5,则b>a=100
D.一定温度下,向0.1mol·L-1的醋酸溶液中加少量烧碱,溶液中c(H+)/c(CH3COOH)的比值增大
12.(甘肃)足量的二氧化碳通入到1mol/L NaOH溶液中,下列说法错误的是
A.溶液中Na+离子个数为NA(NA表示阿伏加德罗常数)
B.溶液中的CO2—3离子浓度先增大后减小
C.微热反应后的溶液,溶液的pH会升高
D.当恰好生成Na2CO3时,溶液中离子浓度大小存在以下关系:
7. (攀枝花)25℃时,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后,混合液pH大于7,则反应后的混合液:2c(OH一)+c(A一)=2c(H+)+c(HA)
B.pH均为9的三种溶液:CH3COOH、Na2CO3、NaOH,其物质的量浓度的大小顺序是NaOH 溶液>CH3COOH溶液>Na2CO3溶液
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+c(HR一)=c(Na+)
D.0.2mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合:c(H+)=c(OH—)+c(HCO3—)+2c(H2CO3)
6.(攀枝花)下列叙述正确的是
A.25℃时,若0.1 mol/L氨水溶液中=1×10-8,则该溶液pH=9
B.25℃时,将0.1 mol/L 醋酸溶液加水稀释,保持温度不变,稀释过程中的比值减小
C.0.1 mol/L 的Na2CO3溶液中:c(OH- ) - c(H+ )=c(HCO3-) + 2c(H2CO3)
D. 浓度均为0.1 mol/L 的氨水溶液和NH4Cl溶液等体积混合后,若溶液呈碱性,则所得溶液中:c(NH4+ )> c(NH3·H2O) > c(Cl-) > c(OH-) > c(H+ )
4.(凉山)下列关系正确的是
A.将等物质的量的H2CO3和KHCO3溶于水配成的溶液中:2c(K+)= c(H2CO3)+c(HCO—3)
B.向CH3COONa溶液里加入适量的NaOH固体后得到的混合溶液中:
C.向0.10 mol·L-1 NH4HSO4溶液中滴加适量的NaOH溶液至溶液呈中性,该中性溶液中:
D.向NaCN溶液中滴加适量的稀盐酸使溶液呈中性,该中性溶液中:
5. (内江)下列叙述正确的是
A. 已知,向盛有M3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫 红色,说明W3在CCl4中的溶解度比在水中的大
B. 室温下向10mL pH =3的醋酸溶液中加水稀释后,溶液中减小
C. 室温时的NaF溶液与0.1 mol . L^的CH3COOK溶液相比,一定有成立
D. 在250C时,将amol• L-1的氨水与0.01 mol• L-1的盐酸等体积混合,充分反应后溶液中,则250C时NH3 • H2O的电离常数
4.(重庆)下列有关说法中,不正确的是( )
A.在0.1mol/L的Na2SO3溶液中加入少量NaOH固体,c(SO32-)与c(Na+)均增大
B.常温下,CH3COONa溶液的pH=8,则c(Na+) -c(CH3COO-)=9.9×10-7mol/L
C.常温下,0.1mol/L的某酸溶液中,若c(OH-)/c(H+) =1×10-8,则溶液中由水电离出的c(H+) =1×10-11mol/L
D.a mol/L的HCN溶液与b mol/L的NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小
于b
9、(重庆文理)下列说法正确的是
A.在pH=1的溶液中,能大量共存的离子或分子有:K+、MnO4-、CH3CHO、SO42-
B.向30mL 1.0 mol·L-1的Na2SO3溶液中通入896 mL Cl2(已折算成标准状况),其离子方程式为: SO32-+Cl2+ H2O =SO42-+2Cl-+2H+
C.1.0 mol·L-1的KNO3溶液中可能大量共存的离子有:H+、Fe2+、Cl-、SO42-
D.由水电离出的c(H+)=1×10-14 mol·L-1的溶液中能大量共存的离子有:
Ca2+、K+、Cl-、HCO3-
10、(重庆文理)25℃时,有下列四种溶液:①0.1mol/L 的CH3COOH溶液 ②pH=13的NaOH溶液 ③ 0.05mol/L的 H2SO4 ④0.1mol/L 的Na2CO3溶液 则下列有关说法中正确的是
A、溶液④显碱性,用离子方程式解释其原因可表示成:CO32- + 2H2O H2CO3 + 2OH-
B、在上述四种溶液中,pH由大到小的顺序为:②④③①
C、将该温度下amL的溶液②与bmL的溶液③混合,所得混合溶液的pH=7,则a : b =1 :2
D、若将溶液④和Al2(SO4)3溶液混合,可观察到有白色絮状沉淀和无色气体生成。
5.(重庆育才)已知:25℃时,KW=1.0×10—14;100℃时,KW=1×10—12 ,下列说法正确的是( )
A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7
B.25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl等体积混合,所得溶液的pH=7
C.25℃时,0.2 mol/L NaOH溶液与0.2 mol/L CH3COOH恰好中和,所得溶液的pH=7
D.25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7
7、(重庆育才)下列溶液中有关物质的量浓度关系正确的是( )
A.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液: c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.NaHCO3溶液中:c (H+)+ c (H2CO3)=c(OH—)
D.25℃时,pH=4.75、浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液:
c(CH3COO—) + c(OH—) >c(CH3COOH) + c(H+)
5.(重庆一中)常温下,浓度均为0.1 mol/L的4种溶液pH如下表:
溶质
Na2CO3
NaHCO3
NaClO
NaHSO3
pH
11.6
9.7
10.3
4.0
下列说法正确的是
A.0.1 mol/L Na2CO3溶液加水,稀释后溶液中所有离子的浓度均减少
B.NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO)
C.NaHSO3溶液中:c(Na+)>c(HSO3-) > c(H2SO3)>c(SO32-)
D.常温下,相同浓度的H2SO3、H2CO3、HClO三种溶液,pH最小的是H2SO3
11.(东北)下列溶液中微粒的物质的量浓度关系一定正确的是( )
A.0.1mol/LNH4Cl溶液与0.05mol/LNaOH溶液等体积混合后所得的碱性溶液中:
c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
B.pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+)
C.等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-)
D.某二元弱酸的酸式盐NaHA溶液:c(Na+)+ c(H+)=c(OH-)+c(HA-)+c(A2-)
11.(哈一)常温下,有下列四种溶液:
①
②
③
④
0.1mol/L NaOH溶液
pH = 11 NaOH溶液
0.1mol/L CH3COOH溶液
pH = 3 CH3COOH溶液
下列说法正确的是 ( )
A.由水电离出的c(H+):①>③
B.③稀释到原来的100倍后,pH与④相同
C.②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为:c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.①与③混合,若溶液pH = 7,则V(NaOH)>V(CH3COOH)
12.(辽宁)将体积为1mL,浓度为0.5mol/L的乙酸和体积为2mL,浓度为0.25mol/L的NaOH溶液混和,所得溶液中离子浓度由大到小的顺序是 ( )
A.c(Na+)>c(CH3COO-)>c (OH-)>c(H+) B.c(Na+)=c(CH3COO-),c(CH3COO-)>c (OH-)>c(H+)
C.c(Na+)> c (OH-) > c(CH3COO-) >c(H+) D.c(Na+)> c (OH-) > c(H+)> c(CH3COO-)
9.(湖南长沙)下列说法正确的是
A.可用盐析法分离NaCl溶液和淀粉胶体
B. 0.1mol·L-1NaHCO3溶液中:c(Na+ )= c(HCO3-)+ 2c(CO32-)+ c(H2CO3)
C.常温下中和等体积、pH相同的CH3COOH和HCl溶液,消耗NaOH的量一样多
D.25℃时Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,故新生成的AgCl可转化为AgI
12.(湖北)常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 moI/L NaOH
溶液。有关微粒的物质的量变化如右图(其中I代表H2A,
Ⅱ代表HA—,Ⅲ代表A2—),根据图示判断,下列说法正确
的是
A.当V[NaOH(aq)] =20 mL时,溶液中离子浓度大小关系:
c(Na+)>c(HA—)>c(H+)>c(A2—)>c(OH—)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C.H2A第一步电离的方程式为:H2A= HA— +H+
D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减少
11.(云南)常温下a mol/L HC1稀溶液和b mol/L NH3·H2O稀溶液等体积混合,下列判断一定正确的是
A.若a=b,则c(OH—)=c(H+) B.若a=b,则c(Cl—)=c(NH+4)
C.若a>b,则c(OH+) c(OH-) > c(A-) > c(H+)
D.乙反应后溶液中:c(Na+) < c(HA) + c(A-)
11.(黑龙江)下列溶液中微粒的物质的量浓度关系一定正确的是( )
A.0.1mol/LNH4Cl溶液与0.05mol/LNaOH溶液等体积混合后所得的碱性溶液中:
c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
B.pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+)
C.等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-)
D.某二元弱酸的酸式盐NaHA溶液:c(Na+)+ c(H+)=c(OH-)+c(HA-)+c(A2-)
12.(辽宁)将体积为1mL,浓度为0.5mol/L的乙酸和体积为2mL,浓度为0.25mol/L的NaOH溶液混和,所得溶液中离子浓度由大到小的顺序是 ( )
A.c(Na+)>c(CH3COO-)>c (OH-)>c(H+) B.c(Na+)=c(CH3COO-),c(CH3COO-)>c (OH-)>c(H+)
C.c(Na+)> c (OH-) > c(CH3COO-) >c(H+) D.c(Na+)> c (OH-) > c(H+)> c(CH3COO-)
23.(中山)下列液体均处于25℃,有关叙述正确的是
A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐
B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) <c(CH3COO-)
23.(珠海)常温下,pH=12的NaOH溶液和pH=2的醋酸混合后恰好完全反应(不考虑溶液体积的变化)。 下列说法正确的是
A.原醋酸物质的量浓度大于0.01mol·L-1
B.两种反应物中水电离出的c(H+)都是1ⅹ10-12 mol·L-1
C.反应后的溶液中:c(CH3COO-)+c(CH3COOH)=0.01mol·L-1
D.反应后的溶液中:c(CH3COO-)=c(Na+)>c(H+)=c( OH-)
13.(南宁)下列说法正确的是
A.H+只能存在于pH<7的酸性溶液中
B.氯化铵溶液中只存在水解平衡,没有电离平衡
C.0.1 mol/L硫化钠溶液中粒子浓度的关系:c(Na+)=c(S2-)+c(HS-)+c(H2S)
D.0.2 mol/L NaA溶液和0.1 mol/L盐酸溶液等体积混合后所得溶液呈碱性,则有如下
关系:c(Na+)>c(A-)>(Cl-)
11、(海口)下列溶液中有关粒子的物质的量浓度关系正确的是
A.25℃时,pH=4的HCl溶液与pH=4的醋酸溶液中:c(Cl-)=c(CH3COO-)
B.氯水中:2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO)
C.pH=8的0.1mol/L的NaHB溶液中:c(HB-)>c(H+)>c(B2-)>c(H2B)
D.1 mol·L-1的Na2S溶液中: c(OH-)=c(HS-)+2c(H2S)+ c(H+)
10、(海南嘉积)草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性。向100mL0.2mol/L的草酸溶液中加入
1.68 g KOH固体,若溶液体积不变,则对所得溶液中各粒子浓度之间的关系描述错误
的是 ( )
A.c(C2O42-)+c(HC2O4-)+c(OH-)=c(K+)+c(H+)
B.c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.2mol/L
C.c(C2O42-)<c(HC2O4-)<c(H2C2O4)
D.c(C2O42-)+c(HC2O4-)+c(H2C2O4)<c(K+)
1.(重庆南开)下列说法错误的是:
A.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2
B.硅酸盐NaAISiO4.nH2O可改写成氧化物形式为:Na2O.AI2O3.2SiO2.2nH2O
C.AI65Cu23Fe12是一种拟晶,具有合金的优良物理性能,其硬度比金属Al、Cu、Fe都大
D.过量铁与浓硫酸加热反应可以得到氢气
4.(重庆南开)下列各示意图与对应的表述正确的是:
A.图①表示一定条件下某化学度验的速率随时间变化莳趋势图,该反应一定男放热反应
B.图②中曲线表示将氢氧化钠溶液滴加到醋酸溶液浓度的变化趋势图
C.图③表示等体积、等物质的量浓度的盐酸和醋酸,分别加足量镁粉,产生H2的物质的量的变化
D.图④为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法
6.(重庆南开)下列说法正确的是:
A.常温下醋酸分子不可能存在于pH>7的碱性溶液中
B.在0.lmol/L Na2SO3的溶液中加入少量NaOH固体,c(Na+)增大,c(SO32-)减小
C. 0.lmoI.L-lNH4CI溶液与0.05moI.L-l NaOH溶液等体积混合溶液中离子浓度:
c (Cl-) > c (NH4+) > c (Na+) > c (OH-)
D.a mol/L HCN溶液与6 mol/L NaOH溶液等体积混合,所得溶液中c (Na+)>c (CN-),则a一
定小于6
13.(河南洛阳)已知25℃时有关弱酸的电离平衡常数:
弱酸化学式
CH3COOH
HCN
H2CO3
电离平衡常数(25℃)
1.8×l0-5
4.9×l0-10
K1 = 4.3×l0-7 K2 = 5.6×l0-11
现维持25℃,下列有关说法正确的是
A.NaHCO3溶液中:c(OH-)-c(H+)= c(H2CO3)-c(CO32-)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合,所得溶液中c(Na+)>
c(CN-),则a一定小于b
C.等物质的量浓度的各溶液pH关系为:pH(NaHCO3)>pH(NaCN)>pH(CH3COONa)
D.NaHCO3和Na2CO3混合液中,一定有c(Na+)+ c(H+)= c(OH–)+ c(HCO3–)
+c(CO32–)
11.(银川一中)下列有关说法正确的是
A.0.1mol/L NH4C1溶液加蒸馏水稀释,溶液的pH不断减小
B.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
C. 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
D.0.1mol/L的NaHA溶液,其pH=4: c(HA-) > c(H+)> c(H2A) > c(A2-)
11.(辽宁五校)25℃时,有关弱酸的电离平衡常数如下,下列有关说法正确的是
弱酸化学式
CH3COOH
HCN
H2CO3
电离平衡常数(25℃)
1.8×10-5
4.9×10-10
K1=4.3×10-7 K2=5.6×10-11
A.等物质的量浓度的各溶液pH关系为pH(CH3COONa)>pH(Na2CO3)>pH(NaCN)
B.a mol·L-1HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.0.1 mol·L-1CH3COOH溶液中逐滴加入水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
3.(海南)研究物质性质的基本方法有对比法和实验法。以下实验设计中不合理或不严密的是( )
A.测定相同温度下盐酸和醋酸溶液的pH,就可证明盐酸是强酸、醋酸是弱酸
B.镁和钠分别与冷水反应,判断镁和钠的金属性强弱
C.铁分别与氯气和硫反应,判断氯气与硫的氧化性强弱
D.测定相同条件下Na2CO3溶液和Na2SO4溶液的pH,判断碳与硫的非金属性强弱
5.(重庆一中)常温下,浓度均为0.1 mol/L的4种溶液pH如下表:
溶质
Na2CO3
NaHCO3
NaClO
NaHSO3
pH
11.6
9.7
10.3
4.0
下列说法正确的是
A.0.1 mol/L Na2CO3溶液加水,稀释后溶液中所有离子的浓度均减少
B.NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO)
C.NaHSO3溶液中:c(Na+)>c(HSO3-) > c(H2SO3)>c(SO32-)
D.常温下,相同浓度的H2SO3、H2CO3、HClO三种溶液,pH最小的是H2SO3
26、(衡水)
Ⅰ XeO3是一种不稳定的物质,具有强氧化性。在某一反应体系中有反应物和生成物的微粒共6种,即Mn2+、MnO4—、Xe、XeO3、H+、H2O
(1)该反应的离子方程式为:_____________________________________。
(2)将适量的XeO3投入30mL 0.1 mol/L Mn2+的水溶液中,刚好完全反应。此时转移电子数目为_________。将反应后的溶液稀释至90mL,所得溶液的pH=________。
Ⅱ[来源:Z已知NaOH与Cl2反应的氧化产物与温度有关(发生的反应均为放热反应),在VL4mol/L的NaOH中通入一定量的氯气,生成物中含有Cl、ClO、ClO3-三种含氯元素的离子,其中C1O、ClO3-的物质的量(n)与反应时间(t)的曲线如图所示。
(3)若t2时刻恰好反应完全,则V= L
X
(4)工业上常用ClO-氧化处理含CN-(其中C为+2价)的废水,生成的CNO-(其中C为+4价)元素,反应的离子方程式如下:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,上述化学方程式可能的配平系数有多组,方程式中e : f的值为 (填选项标号)
A.1 B.1/2 C.2 D.不能确定
(5)氰(CN)2 的化学性质与卤素(X2)很相似,化学上称之为拟卤素。(CN)2 和水反应可生成HCN和HCNO;(CN)2 的氧化性比Br2弱,比I2强。下列有关反应方程式不正确的是 (填选项标号)。
A.(CN)2 和NaOH溶液反应:(CN)2 + 2OH-= CN-+ CNO-+ H2O
B.MnO2和HCN反应:MnO2 + 4HCN Mn(CN)2 + (CN)2 ↑ + 2H2O
C.向KCN溶液中加入碘水:I2 + 2KCN =" 2KI" + (CN)2
D.在NaBr和KCN混合溶液中通入少量Cl2:Cl2 + 2Br-= 2Cl-+ Br2
Ⅲx 200mL某溶液中含有的离子及其物质的量如下:
离子
H+
K+
NO3-
SO42-
物质的量(mol)
0.5
0.1
0.6
0.15
(6)该溶液中还含有的离子一定是下列中的 (填序号),该离子的浓度为
A.Al3+ B.Cl- C ClO- D. Fe2+
9、(湖南)已知温度T时,水的离子积常数为KW,该温度下将V1mLa mol•L-1的一元酸HA与V2mL
b mol•L-1的一元碱BOH充分混合,下列判断一定正确的是
A.若V1a=V2b,稀释此混合溶液时,溶液中各离子浓度一定都发生变化
B.若pH(HA)+ pH(BOH)=14,则V1=V2时,酸碱恰好完全中和
C.此混合液中:2c(H+)+c(B+)≤c(OH-)+c(A-)
D.若混合溶液中c(OH-)=mol•L-1,则此溶液一定呈中性
9.(湖南)下列说法正确的是
A.可用盐析法分离NaCl溶液和淀粉胶体
B. 0.1mol·L-1NaHCO3溶液中:c(Na+ )= c(HCO3-)+ 2c(CO32-)+ c(H2CO3)
C.常温下中和等体积、pH相同的CH3COOH和HCl溶液,消耗NaOH的量一样多
D.25℃时Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,故新生成的AgCl可转化为AgI
11.(湖南)在不同温度下,水溶液中c(H+)与c(OH-)有如下图所示关系。下列关于离子共存说法中正确的是
A.a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO
B.b点对应的溶液中大量存在:NH、Ba2+、OH-、I-
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、HCO
D.d点对应的溶液中大量存在:Na+、K+、SO、Cl-
8.(湖南)下列有关实验或操作的叙述正确的是
A.酸碱中和滴定前,用蒸馏水洗涤滴定管和锥形瓶后,均需用待装溶液润洗
B.常温下,将0.1 mol·L-1某一元碱(ROH)溶液和pH=l的HCl溶液等体积混合,则混合后溶液的pH≤7
C.常温下,测定某待测试液的pH时,使用湿润的pH试纸测得pH一定会产生误差
D.用托盘天平称取1.06 g无水碳酸钠,小心转移至250 mL容量瓶中,加入蒸馏水至刻度线,配制得到0.04 mol·L-1 Na2CO3溶液
12、(湖南师大)25 ℃时纯水的电离度为 a1,pH=2的醋酸溶液中水的电离度为a2,pH=12的氢氧化钠溶液中水的电离度为a3。若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离度为a4。下列关系式中正确的是
A.a2 = a3<a4<a1 B.a3 = a2<a1<a4
C.a2<a3<a1<a4 D. a1<a2<a3<a4
14、(湖南师大)草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)=0时,c(H+)=1×10-2 mol/L
B. V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L
C. V(NaOH)<10 mL时,可能存在c(Na+)=
D.V(NaOH)>10 mL时,>>)
11.(昆明)关于醋酸钠溶液,下列说法正确的是
A.加水稀释时c(CH3CO一),c(Na+)的值减小
B.向其中再加入少量醋酸钠晶体时,溶液中所有离子浓度都增大
C.离子浓度大小比较:c(CH3COO一)>c(Na+)>c(OH-)>c(H+)
D.向其中加入盐酸至恰好呈中性时,c(Na+)= c(CH3COO一)
27、(衡水
)欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。
(1)在催化剂作用下,CO2和H2可以制取甲醇。用工业废气中的可制取甲醇,其反应为: 常温常压下已知下列反应的能量变化如图示:
写出由二氧化碳和氢气制备甲醇的热化学方程式: 。
(2)工业上在恒容密闭容器中用下列反应合成甲醇:△H=akJ/mol
下表所列数据是反应在不同温度下的化学平衡常数(K)。
温度
250℃
300℃
350℃
K
2.041
0.270
0.012
①判断反应达到平衡状态的依据是
A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的平均相对分子质量不变
C. 混合气体的密度不变 D.CH3OH、CO、H2的浓度都不再发生变化
②借助上表数据判断,要同时提高CO的转化率和反应的速率,可采取的措施是
A.降温 B.充入H2 C.分离出甲醇 D.加入催化剂
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得cmol/L,则以CH3OH表示的反应速率v 。
(3)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为________。理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为________(燃料电池的理论效率:指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
(4)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生反应:BaSO4(s)+CO32-(aq) BaCO3(s)+SO42-(aq)。
已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.1×10-10,则 BaCO3的溶度积Ksp= 。
27.(长安一中)2012年2月28日工信部决定在山西省、上海市、陕西省试点甲醇汽车,已知甲醇的生产方法之一是在煤气化的基础上液化。
(1)煤气化的化学方程式是___ 。
(2)已知H 2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ;
(3)在容积为l L的密闭容器中,由CO和H2合成甲酵,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
下列说法正确的是____(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为
②该反应在Ti时的平衡常数比T2时的大
③该反应为吸热反应
④处于A点的反应体系从T1变到T2,达到平衡时减小
(4)在T1温度时,将1 mol CO和2mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO转化率为a,则容器内的压强与起始压强之比 ;
(5)在直接以甲醇为燃料电池中,电解质溶液为碱性,负极的反应式为 ;假设原电解质为NaOH,且电池工作一段时间后溶质只有Na2CO3,此时溶液中各离子浓度大小关系为:
(6)已知Na2CO3是锅炉清洗剂之一,用离子方程式表示Na2CO3清除水垢的原理 。己知Ksp(CaSO4)=9.1×10-6,KSP(CaCO3)=2.8×10-9,试计算沉淀转化反应的平衡常数值 。
26.(山西长治)四种强电解质A、B、C、D的溶液,分别含有下列阴阳离子的各一种,且不重复。已知A溶液为黄色,含0.01mol的A溶液与含0.01mol的B溶液反应生成白色沉淀,再逐滴加入D溶液,白色沉淀最后转变为黄色沉淀。将C溶液滴在pH试纸的中部,显蓝色。
阳离子
K+、Fe3+、Ag+、Ca2+
阴离子
Cl-、I-、CO32-、NO-3
试按要求回答下列相关问题:
(1)D的电子式为:__________________。
(2)C溶液中的离子浓度由大到小的顺序为:________________。
(3)白色沉淀转变为黄色沉淀的离子方程式为:___________________________。
(4)25℃时,在100mL0.1mol/L的A溶液中,通入NH3,当溶液的pH=3时,A的金属离子全部沉淀。计算该沉淀的Ksp=____。(离子的浓度为1.0×10-5mol/L时认为沉淀完全)
(5)加热固体B可分解为金属单质与两种气体,且一种为红棕色。则1molB分解,转移的电子数为_______________。
(6)控制适合的反应条件,A溶液与D溶液反应可设计成如下图所示的装置。则该装置为______________________(填“原电池”或“电解池”),乙烧杯中石墨电极上的电极反应式为:_________________________________。
29、(重庆文理)已知向FeCl3浓溶液中加入Na2CO3浓溶液,可以观察到产生红褐色沉淀和无色气体,写出该反应的离子方程式 。
从形式上看,Na2SO3和Na2CO3相似,那么Na2SO3和FeCl3之间的反应情况又如何呢?某化学研究性学习小组提出了两种可能:一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3SO32-+6H2O=3Fe(OH)3(胶体)+3H2SO3; 为了弄清楚发生的是那一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ:实验用品 Na2SO3浓溶液、BaCl2稀溶液、稀盐酸、试管若干、胶头滴管若干。从选择的药品分析,实验者设计这个实验的目的是 。
实验Ⅱ:取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液的颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液的颜色加深,最终变为红褐色。这种红褐色物质是 。向红褐色物质中逐滴加入稀盐酸至过量,可以观察的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为: 。另一份加入BaCl2稀溶液,有少量白色沉淀生成,反应的离子方程式为: 。
实验Ⅲ:换用稀FeCl3和Na2SO3溶液重复实验Ⅱ,产生的现象完全相同。
由上述试验得出的结论是 。
27.(东北)
已知:乙二酸 俗称草酸(结构简式为HOOC—COOH,可简写为H2C2O4)。
25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;
碳酸(H2CO3)的电离平衡常数为K1=4.5×10-7,K2= 4.7×10-11。
草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)写出水溶液中草酸的电离方程式 ;
(2)相同条件下物质的量浓度都为0.1 mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH (填“大”、“小”或“相等”);
(3)常温下将0.4 mol/L的KOH溶液20 mL与0.2 mol/L的草酸溶液20 mL混合,则混合后溶液中阴离子浓度的大小顺序为__________________________;
(4)实验室常用酸性高锰钾溶液滴定草酸来测定草酸溶液的浓度。高锰酸钾溶液常用 (填“稀硫酸”、 “稀硝酸”、 “稀盐酸”)酸化,已知酸性高锰酸钾和草酸反应的现象是有气泡产生,紫色消失,其反应的离子方程式为 ;
(5)草酸钙结石是五种肾结石里最为常见的一种。患草酸钙结石的病人多饮白开水有利于结石的消融。请用化学用语和简要的文字说明其原因 ;
(6)25℃时向20 mL碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol/L的草酸钾溶液
20 mL,能否产生沉淀 (填“能”或“否”);
26.(昆明)(1)目前人们已研发出多种饮用水的新型消毒剂:下列物质不能作自来水消毒剂的是____(填序号)。
A.硫酸铜 B.二氧化氯 C.臭氧 D.硫酸亚铁
(2)高铁酸盐(如Na2FeO4)是新一代水处理剂。其制备方法有:次氯酸盐氧化法(湿法)和高温过氧化物法(干法)等。湿法是在碱性溶液中用次氯酸盐氧化三价铁盐,写出该法的离子方程式:________。
(3)甲醇燃料电池是一种高效燃料电池,电解质溶液为KOH溶液.写出负极发生的电极反应式: ;用甲醇燃料电池作电源,以碳棒为电极电解1L饱和NaCl溶液.当两电极一共产生22.4L气体(标准状况)时停止电解。若忽略溶液体积变化.则电解后溶液在25℃时的pH= ;燃料电池正极消耗空气的体积是
(标准状况,空气中O2的体积分数以20%计算)。
(4)ag铁粉与一定质量的硝酸溶液充分反应后,铁粉完全溶解,生成的气体与标准状况下b L氧气混合后.恰好能被水完全吸收.a和b的关系可能是 (填序号)。
A.b=0. 2a B.b=0. 28a C.b=0. 3a D.b=0.5a
(5)若25℃时Ksp:Fe [(OH)3]=8×10-28,此温度下欲使某pH=1的FeC13溶液(含少量盐酸)中Fe3+沉淀完全.则需要调节该溶液的pH至少为 (已知:lg2=0.3. lg5=0.7)。
32.(珠海)制备过氧化氢的传统方法是在过氧化钡中加入稀硫酸。
以重晶石(BaSO4)为原料制备过氧化氢的流程如下:
回答下列问题:
(1)图中气体①由两种气体组成,其中一种有刺激性气味,则另一种气体是 (填编号)
①CO ②CO2
(2)BaS不能存在于水中,BaS溶于水后,S元素主要以HS-的形式存在,用化学方程式表示其原因: 。
(3)已知:Ba(OH)2(aq)+CO2(g) BaCO3(s)+H2O(l) ΔH =-162kJ•mol-1
2H2S(g)+ Ba(OH)2(aq) Ba(HS)2(aq)+2H2O(l) ΔH=-191kJ•mol-1
Ba(HS)2(aq)+CO2(g) +H2O(l) BaCO3(s) +2H2S(g) ΔH= kJ•mol-1
需将溶液A加热的原因是 。
(4)操作③为 。气体②进一步加工能成为上述流程中的一种原料,该原料是 。
(5)通入的CO2若含有O2会有BaSO4生成,所以通常增大溶液的pH以提高CO32-浓度,把BaSO4 转化为BaCO3。若测得SO42-的浓度为1.0×10-4mol•L-1,则CO32-的浓度需大于多少才不致于生成BaSO4沉淀?(写出计算过程,结果保留两位有效数字)[已知Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9]