- 8.97 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第2节 原电池 化学电源
一、原电池的工作原理
1.概念
原电池是将______转变为____的装置。
2.工作原理
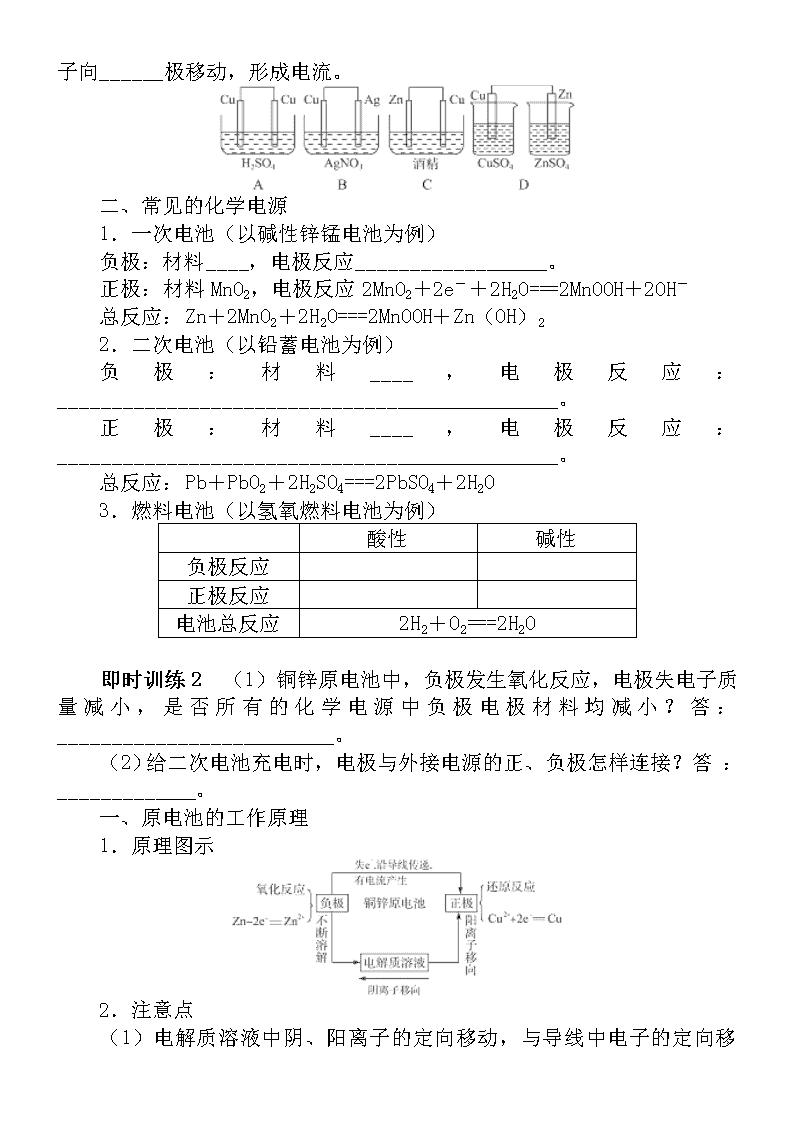
如图以铜锌原电池为例:
(1)在ZnSO4溶液中,锌片逐渐____,即Zn被____,锌原子____电子,形成________进入溶液,从锌片上释放出电子,经过导线流向____;溶液中的________从铜片上得电子,还原成为____并沉积在铜片上。
(2)电子流向:从____极流向____极。
(3)电流方向:从____极(____)流向____极(____)。
3.电极材料及反应式(以铜锌原电池为例)
电极名称
负极
正极
电极材料
电极名称
负极
正极
电极反应
反应类型
____反应
____反应
电池总反应
4.原电池的构成判断要三看
(1)一看反应:看是否有能自发进行的氧化还原反应发生(一般是活泼性强的金属与电解质溶液反应)。
(2)二看两电极:一般是活泼性不同的两电极。
(3)三看是否形成闭合回路,形成闭合回路需三个条件:①电解质溶液;②两电极直接或间接接触;③两电极插入电解质溶液。
即时训练1
下列装置可以形成原电池的是____,并写出形成原电池的电极材料及电极反应:正极:___________、______________;负极:_______、____________;电解质溶液中的阴离子向_______极移动,阳离子向______极移动,形成电流。
二、常见的化学电源
1.一次电池(以碱性锌锰电池为例)
负极:材料____,电极反应__________________。
正极:材料MnO2,电极反应2MnO2+2e-+2H2O===2MnOOH+2OH-
总反应:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2
2.二次电池(以铅蓄电池为例)
负极:材料____,电极反应:_______________________________________________。
正极:材料____,电极反应:_______________________________________________。
总反应:Pb+PbO2+2H2SO4===2PbSO4+2H2O
3.燃料电池(以氢氧燃料电池为例)
酸性
碱性
负极反应
正极反应
电池总反应
2H2+O2===2H2O
即时训练2 (1)铜锌原电池中,负极发生氧化反应,电极失电子质量减小,是否所有的化学电源中负极电极材料均减小?答:__________________________。
(2)给二次电池充电时,电极与外接电源的正、负极怎样连接?答:_____________。
一、原电池的工作原理
1.原理图示
2.注意点
(1)电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同组成了一个完整的闭合回路。
(2)无论在原电池还是在电解池中,电子均不能通过电解质溶液。
(3)原电池的负极失去电子的总数等于正极得到电子的总数。
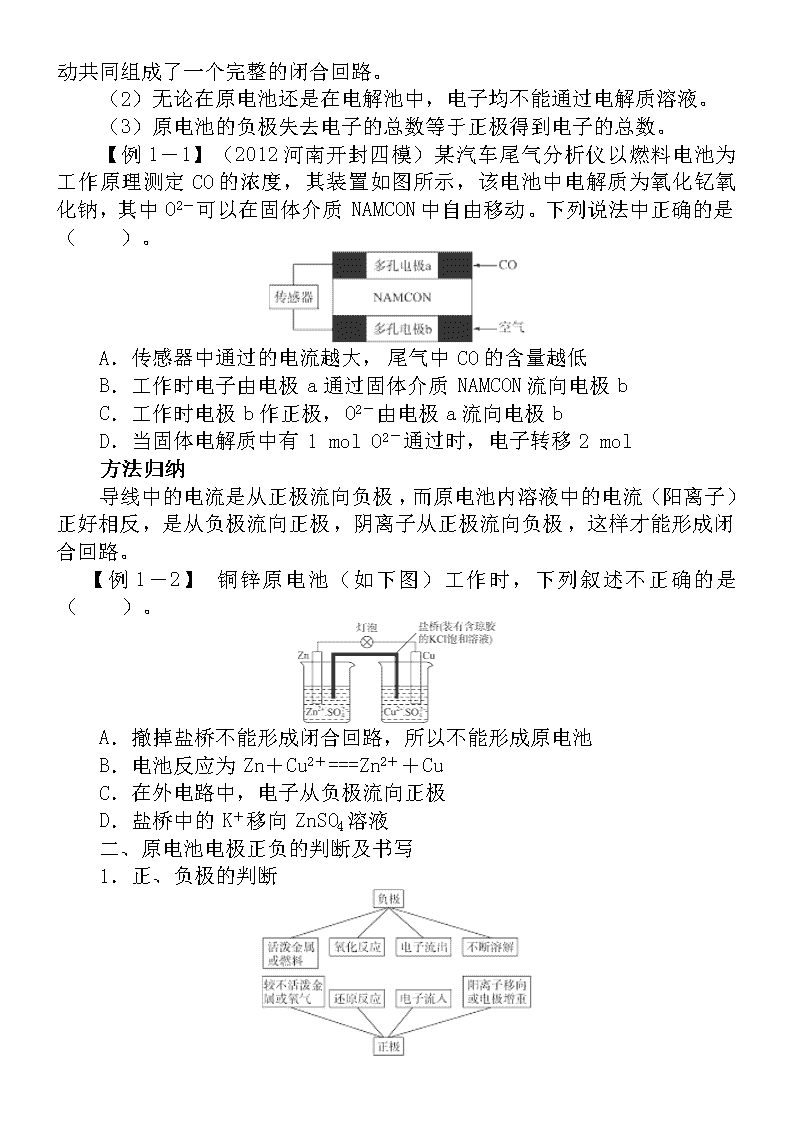
【例1-1】(2012河南开封四模)某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇氧化钠,其中O2-可以在固体介质NAMCON中自由移动。下列说法中正确的是( )。
A.传感器中通过的电流越大,尾气中CO的含量越低
B.工作时电子由电极a通过固体介质NAMCON流向电极b
C.工作时电极b作正极,O2-由电极a流向电极b
D.当固体电解质中有1 mol O2-通过时,电子转移2 mol
方法归纳
导线中的电流是从正极流向负极,而原电池内溶液中的电流(阳离子)正好相反,是从负极流向正极,阴离子从正极流向负极,这样才能形成闭合回路。
【例1-2】 铜锌原电池(如下图)工作时,下列叙述不正确的是( )。
A.撤掉盐桥不能形成闭合回路,所以不能形成原电池
B.电池反应为Zn+Cu2+===Zn2++Cu
C.在外电路中,电子从负极流向正极
D.盐桥中的K+移向ZnSO4溶液
二、原电池电极正负的判断及书写
1.正、负极的判断
2.电极反应的书写步骤
3.电极反应的书写举例
(1)如果题目给定的是图示装置,没给总方程式,先分析正、负极,再根据正、负极反应规律去书写电极反应。
例如:
写电极反应分三步:
①分别找出氧化剂(H+)和还原剂(Zn)(燃料电池如氢氧燃料电池,一般而言,燃料作还原剂,O2作氧化剂)。氧化剂在正极得电子,还原剂在负极失电子。
②结合介质判断氧化产物(Zn2+)和还原产物(H2)。
③写出电极反应(注意两极得失电子数相等)。
负极:Zn-2e-===Zn2+;
正极:2H++2e-===H2↑。
(2)给出总反应,首先分析此反应中电子的得失,即氧化反应或还原反应,化合价升高、失电子、发生氧化反应,为原电池的负极;化合价降低、得电子、发生还原反应,为原电池的正极。
以铅蓄电池放电时的反应为例,总反应为Pb+PbO2+2H2SO42PbSO4+2H2O,电极反应的书写步骤如下:
负极:Pb-2e-===PbSO4Pb+SO-2e-===PbSO4;
正极:PbO2+2e-===PbSO4PbO2+SO+2e-===PbSO4 PbO2+SO+4H++2e-===PbSO4+2H2O(也可以用总反应减去负极反应得到正极反应)。
(3)书写电极反应应充分注意介质影响,水溶液中不能出现O2-。如图所示,电池反应为2H2+O2===2H2O,两电极为石墨电极,写出在下列三种介质中的电极反应:
a.电解质是稀硫酸溶液(酸性溶液电极反应中一定无OH-)。
负极:2H2-4e-===4H+;
正极:O2+4H++4e-===2H2O。
b.电解质是稀KOH溶液(碱性溶液电极反应中一定无H+)。
负极:2H2+4OH--4e-===4H2O;
正极:O2+2H2O+4e-===4OH-。
c.电解质是NaCl溶液(中性溶液反应物中无H+和OH-)。
负极:2H2-4e-===4H+;
正极:O2+2H2O+4e-===4OH-。
【例2-1】 现欲以下图所示装置用电化学原理将CO2、SO2转化为重要化工原料。
①若A为CO2,B为H2,C为CH3OH,则通入CO2的一极为______极,电极反应为________________________,电池反应为__________________________________。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应为____________________。
方法归纳
书写电极反应时,正负极的判断是关键,看两极与电解质溶液得、失电子而快速推断出正、负极,同时还应充分注意介质与电极生成物的反应:(1)负极生成的金属离子在碱性溶液中能与OH-反应生成难溶性碱,如在碱性条件下,钢铁腐蚀中负极生成的Fe2+与溶液中的OH-结合生成Fe(OH)2;(2)在碱性条件下电极析出的CO2能与OH-反应生成CO等。
【例2-2】 (2012湖北武汉联考)下图是甲烷燃料电池原理示意图,请回答下列问题:
(1)电池的正极是______(填“a”或“b”)电极,负极上的电极反应是_________。
(2)电池工作一段时间后电解质溶液的pH______(填“增大”“减小”或“不变”)。
三、原电池在化工、农业生产及科研中的应用
1.加快氧化还原反应速率
一个自发的氧化还原反应,设计成原电池时反应速率增大,例如Zn与稀硫酸反应时加入少量的CuSO4溶液能使产生氢气的速率加快。
2.比较金属活泼性强弱
金属分别作原电池的两极时,一般作负极的金属比正极的活泼。
3.用于金属的防护
使被保护的金属制品作原电池的正极而得到保护。例如,保护铁质输水管或钢铁桥梁,可用导线将其和一块锌块相连,使Zn作原电池的负极。
4.设计制作化学电源
(1)首先将氧化还原反应分成两个半反应。
(2)根据原电池的反应特点,结合两个半反应找出正负极材料和电解质溶液。
【例3】 已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、NaOH溶液、盐酸,按要求回答下列问题。
(1)电工经常说的一句口头禅:“铜接铝,瞎糊弄”,所以电工操作上规定不能把铜导线与铝导线连接在一起使用,说明原因:___________________________________________ ______________________________________________________________________________。
(2)通常说的燃料电池都以铂为电极,将燃烧反应的化学能转化为电能,在燃料电池中,可燃物在____极反应,________在另一极反应。
(3)请运用原电池原理设计实验,验证Cu2+、Fe3+氧化性的强弱。请写出电极反应,负极________________,正极__________________。
1.(高考集萃)(1)(2012课标全国理综)与MnO2Zn电池类似,K2FeO4Zn也可以组成碱性电池,K2FeO4
在电池中作为正极材料,其电极反应为_____________,该电池总反应的离子方程式为_________________________________________________________________。
(2)(2012海南化学)肼(N2H4)空气燃料电池是一种碱性电池,该电池放电时,负极的反应为____________。
(3)(2012山东理综)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应为_____________________________________。
(4)(2012天津理综)熔融状态下,Na和FeCl2能组成可充电电池(装置示意图如右),反应原理为:
2Na+FeCl2Fe+2NaCl
放电时,电池的正极反应为________________;充电时,______(写物质名称)电极接电源的负极;该电池的电解质为____________。
2.(2012北京理综,12)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )。
A.该过程是将太阳能转化为化学能的过程
B.催化剂a表面发生氧化反应,有O2产生
C.催化剂a附近酸性减弱,催化剂b附近酸性增强
D.催化剂b表面的反应是CO2 +2H++2e-===HCOOH
3.(2012福建理综,9)将下图所示实验装置的K闭合,下列判断正确的是( )。
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c(SO)增大
D.片刻后可观察到滤纸b点变红色
4.(2012大纲全国理综,11)①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池;①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由大到小的顺序是( )。
A.①③②④ B.①③④②
C.③④②① D.③①②④
5.铁镍蓄电池又称爱迪生电池,放电时的总反应为:
Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2
下列有关该电池的说法中不正确的是( )。
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O
参考答案
基础梳理整合
一、1.化学能 电能
2.(1)溶解 氧化 失 Zn2+ Cu Cu2+ Cu (2)负 正 (3)正 Cu 负 Zn
3.锌 铜 Zn-2e-===Zn2+ Cu2++2e-===Cu 氧化 还原 Cu2++Zn===Zn2++Cu
即时训练1
B Ag 2Ag++2e-===2Ag Cu Cu-2e-===Cu2+ 负 正
二、1.Zn Zn-2e-+2OH-===Zn(OH)2
2.Pb Pb-2e-+SO===PbSO4 PbO2 PbO2+2e-+4H++SO===PbSO4+2H2O
3.2H2-4e-===4H+ 2H2-4e-+4OH-===4H2O O2+4e-+4H+===2H2O O2+4e-+2H2O===4OH-
即时训练2
(1)不是,如氢氧燃料电池正负极质量不变
(2)正极接正极、负极接负极
核心归纳突破
【例1-1】 D 解析:电流越大说明反应速率越快,反应物CO浓度越大,A选项错误;电解质导电的原因是因为电解质中含有自由移动的离子,所以电子不能在电解质中通过,B选项错误;a为负极、b为正极,阴离子应该由正极流向负极,C选项错误。
【例1-2】 D 解析:左烧杯中Zn失电子形成Zn2+,使溶液中的Zn2+浓度增大,右烧杯中Cu2+得电子,溶液中的Cu2+浓度减小,所以盐桥中的负电荷向左移动,正电荷K+向右移动,以维持两烧杯的电中性;也可以从电流方向解答,外电路电流从正极流向负极,可认为原电池内溶液中的电流从负极流向正极,形成闭合回路,正电荷的流向就是电流的方向,所以K+向右移动。
【例2-1】 答案:(1)①正 CO2+6e-+6H+===CH3OH+H2O CO2+3H2===CH3OH+H2O
②SO2-2e-+2H2O===4H++SO
解析:(1)此装置为原电池,电解质溶液显酸性。①H2中H化合价升高为负极,电极反应为H2-2e-===2H+,CO2一极为正极,产物为CH3OH,碳的化合价由+4价降低为-2价,电极反应为CO2+6e-+6H+===CH3OH+H2O。②负极SO2中硫化合价升高2,生成H2SO4。
【例2-2】 答案:(1)b CH4+10OH--8e-===CO+7H2O (2)减小
解析:氧气作正极,得电子在碱性条件下生成OH-,其电极反应为O2+4e-+2H2O===4OH-,燃料CH4失电子,在碱性条件下生成CO,可得CH4-8e-―→CO,依据电荷守恒前面加10个OH-,CH4+10OH--8e-―→CO,最后用水配平,CH4+10OH--8e-===CO+7H2O,由负极电极反应和正极反应可知电池反应为CH4+2OH-+2O2===CO+3H2O;由总反应可知整个电解质溶液的pH减小。
【例3】 答案:(1)铜铝接触在潮湿的环境中形成原电池,加快了铝的腐蚀,易造成电路断路
(2)负 助燃物 (3)Cu-2e-===Cu2+ 2Fe3++2e-===2Fe2+
解析:(2)可燃物被氧化失电子,在电源负极发生反应。
演练巩固提升
1.答案:(1)FeO+3e-+4H2O===Fe(OH)3+5OH- 3Zn+2FeO+8H2O===3Zn(OH)2+2Fe(OH)3+4OH-
(2)N2H4-4e-+4OH-===N2↑+4H2O
(3)4H++O2+4e-===2H2O
(4)Fe2++2e-===Fe 钠 βAl2O3
解析:(1)正极发生得电子的还原反应,碱性条件下1个FeO得到3个电子生成Fe(OH)3,即FeO+3e-―→Fe(OH)3,依据电荷守恒后面加5个OH-,即FeO+3e-―→Fe(OH)3+5OH-
,依据氢原子守恒得FeO+3e-+4H2O―→Fe(OH)3+5OH-,最后用氧原子检查是否正确;负极反应为Zn-2e-+2OH-===Zn(OH)2,根据得失电子守恒两电极反应变为2FeO+6e-+8H2O===2Fe(OH)3+10OH-、3Zn-6e-+6OH-===3Zn(OH)2,相加即得电池反应;(2)负极燃料(N2H4)失电子生成N2,碱性条件下用OH-配平;(3)氧气在正极得电子,在酸性条件下生成H2O,最后用H+配平即可;(4)放电时正极发生还原反应,应该是Fe2+得电子,电极反应式为Fe2++2e-===Fe,充电时Na+得电子,为电解池的阴极,接电源的负极,该电池中βAl2O3为导电介质。
2.C 解析:首先标化合价,看价变化,O2―→HOOH,CO2中C的化合价降低,得电子,由图示装置中电子转移的方向可知催化剂a表面发生失电子的反应,催化剂b表面发生得电子的反应,所以在催化剂b表面发生的电极反应为CO2+2H++2e-===HCOOH;在a表面H2O失电子生成O2,电极反应为2H2O-4e-===4H++O2↑,由电极反应可知a极附近酸性增强,b极附近酸性减弱,C错误。
3.A 解析:将装置中K闭合,该装置构成原电池,其中Zn电极上发生氧化反应,为负极,Cu电极上发生还原反应,为正极,故A正确;电子沿Zn→a,在a上溶液中的H+得到电子,在b上溶液中的OH-失去电子,电子不能直接由a→b,故B错误;该装置工作过程中,甲乙两烧杯中的SO的浓度都不改变,只是盐桥中的Cl-和K+分别向甲、乙两烧杯中移动,故C错误;b接电源正极为阳极,在此极溶液中的OH-失去电子,c(OH-)减小,c(H+)增大,b处滤纸不能变红色,故D错误。
4.B 解析:由原电池原理判断金属活动性,外电路电流从②流向①,②为正极,金属活动性①>②;①③相连,③为正极,金属活动性①>③;②④相连,②上有气泡(H2)逸出,②为正极,金属活动性④>②;③④相连,③质量减少,则金属活动性③>④,即金属活动性顺序为①>③>④>②,B正确。
5.C 解析:因为放电时的反应中有氢氧化物生成,故电解质溶液呈碱性,因为铁的化合价升高,镍的化合价降低,故铁是负极,氧化镍是正极,故A和B均正确;充电时的阴极反应为Fe(OH)2+2e-===Fe+2OH-,此时阴极附近的pH增大,C错误;根据所给的放电时的电池反应可推知D正确。