- 977.09 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
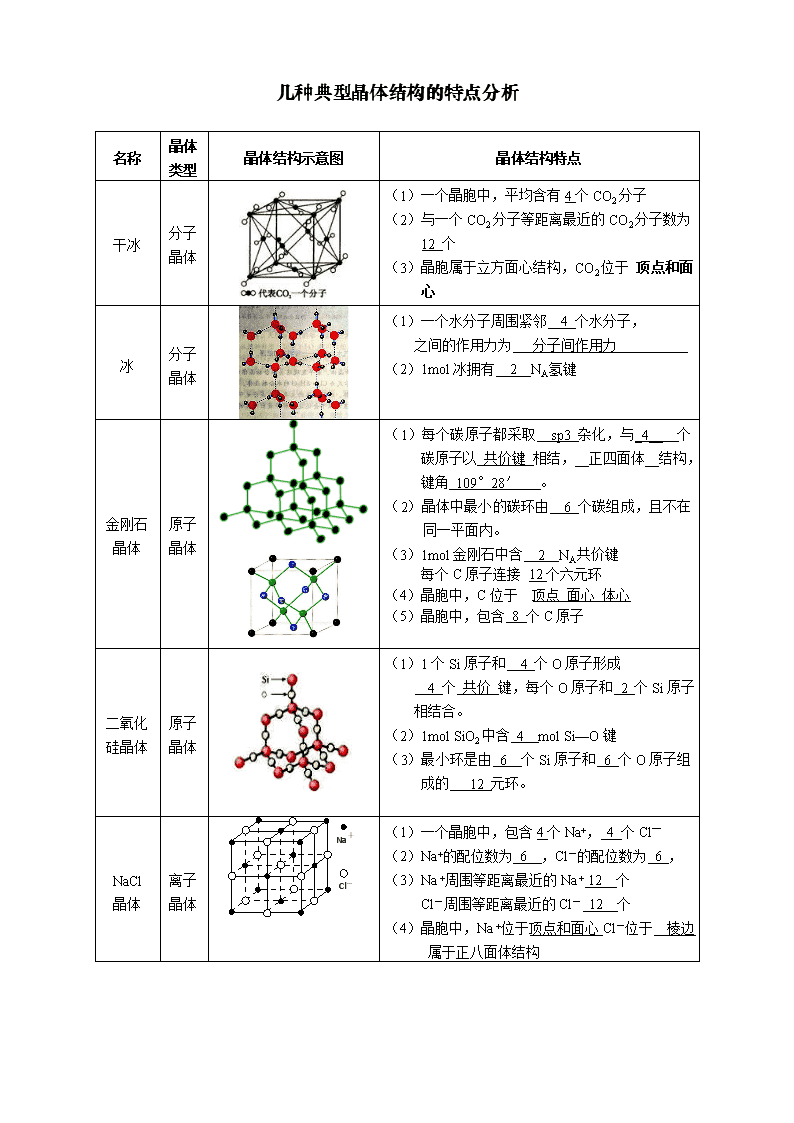
几种典型晶体结构的特点分析
名称
晶体类型
晶体结构示意图
晶体结构特点
干冰
分子晶体
(1)一个晶胞中,平均含有4个CO2分子
(2)与一个CO2分子等距离最近的CO2分子数为 12 个
(3)晶胞属于立方面心结构,CO2位于 顶点和面心
冰
分子晶体
(1)一个水分子周围紧邻 4 个水分子,
之间的作用力为 分子间作用力
(2)1mol冰拥有 2 NA氢键
金刚石
晶体
原子晶体
(1)每个碳原子都采取 sp3 杂化,与_4__ 个碳原子以 共价键 相结,__正四面体__结构,键角 109°28′ 。
(2)晶体中最小的碳环由 6 个碳组成,且不在同一平面内。
(3)1mol金刚石中含 2 NA共价键
每个C原子连接 12个六元环
(4)晶胞中,C位于 顶点 面心 体心
(5)晶胞中,包含 8 个C原子
二氧化硅晶体
原子晶体
(1)1个Si原子和 4 个O原子形成
4 个 共价 键,每个O原子和 2 个Si原子相结合。
(2)1mol SiO2中含 4 mol Si—O键
(3)最小环是由 6 个Si原子和 6 个O原子组成的 12 元环。
NaCl
晶体
离子晶体
Na+
Cl-
(1)一个晶胞中,包含4个Na+, 4 个Cl—
(2)Na+的配位数为 6 ,Cl-的配位数为 6 ,
(3)Na +周围等距离最近的Na + 12 个
Cl-周围等距离最近的Cl- 12 个
(4)晶胞中,Na +位于顶点和面心Cl-位于 棱边
属于正八面体结构
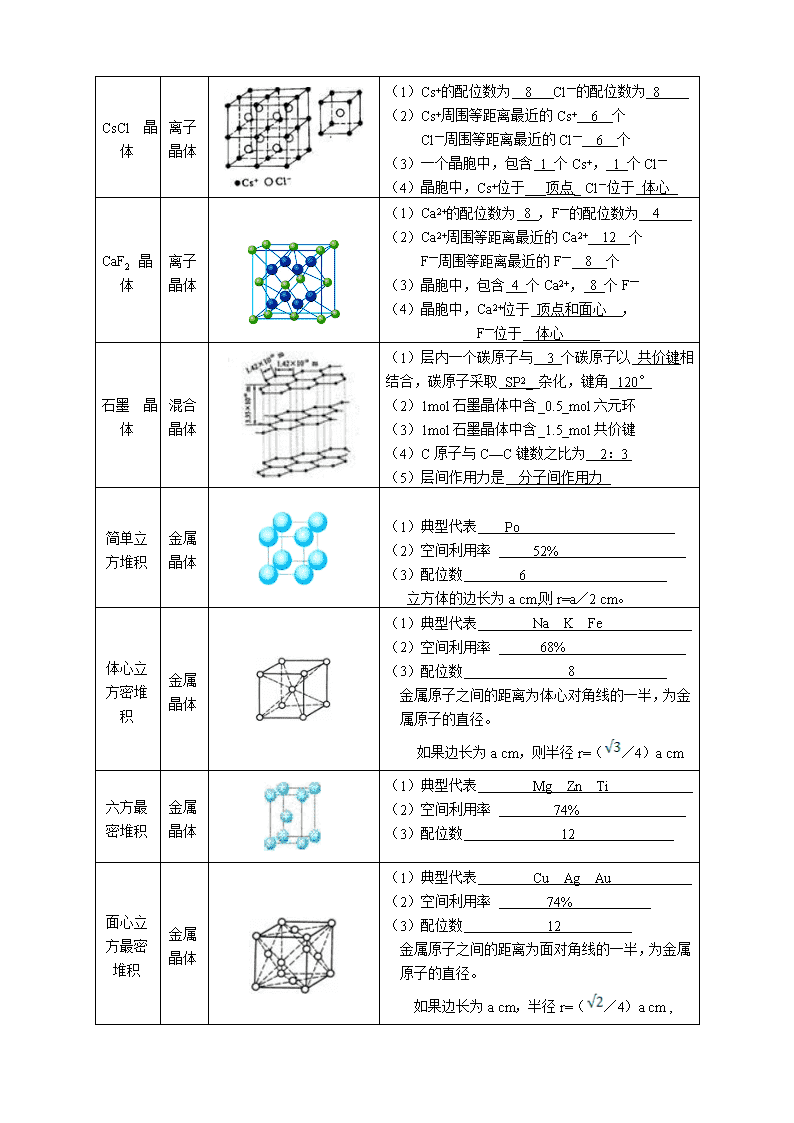
CsCl 晶体
离子晶体
(1)Cs+的配位数为 8 Cl—的配位数为 8
(2)Cs+周围等距离最近的Cs+ 6 个
Cl—周围等距离最近的Cl— 6 个
(3)一个晶胞中,包含 1 个Cs+, 1 个Cl—
(4)晶胞中,Cs+位于___顶点_ Cl-位于 体心
CaF2 晶体
离子晶体
(1)Ca2+的配位数为 8 ,F—的配位数为 4
(2)Ca2+周围等距离最近的Ca2+ 12 个
F—周围等距离最近的F— 8 个
(3)晶胞中,包含 4 个Ca2+, 8 个F—
(4)晶胞中,Ca2+位于 顶点和面心__,
F—位于__体心_____
石墨 晶体
混合晶体
(1)层内一个碳原子与 3 个碳原子以 共价键相结合,碳原子采取 SP2_ 杂化,键角 120°
(2)1mol石墨晶体中含_0.5_mol六元环
(3)1mol石墨晶体中含_1.5_mol共价键
(4)C原子与C—C键数之比为 2:3
(5)层间作用力是 分子间作用力
简单立方堆积
金属晶体
(1)典型代表 Po
(2)空间利用率 52%
(3)配位数 6
立方体的边长为a cm,则r=a/2 cm。
体心立方密堆积
金属晶体
(1)典型代表 Na K Fe
(2)空间利用率 68%
(3)配位数 8
金属原子之间的距离为体心对角线的一半,为金属原子的直径。
如果边长为a cm,则半径r=(/4)a cm
六方最密堆积
金属晶体
(1)典型代表 Mg Zn Ti
(2)空间利用率 74%
(3)配位数 12
面心立方最密堆积
金属晶体
(1)典型代表 Cu Ag Au
(2)空间利用率 74%
(3)配位数 12
金属原子之间的距离为面对角线的一半,为金属原子的直径。
如果边长为a cm,半径r=(/4)a cm ,
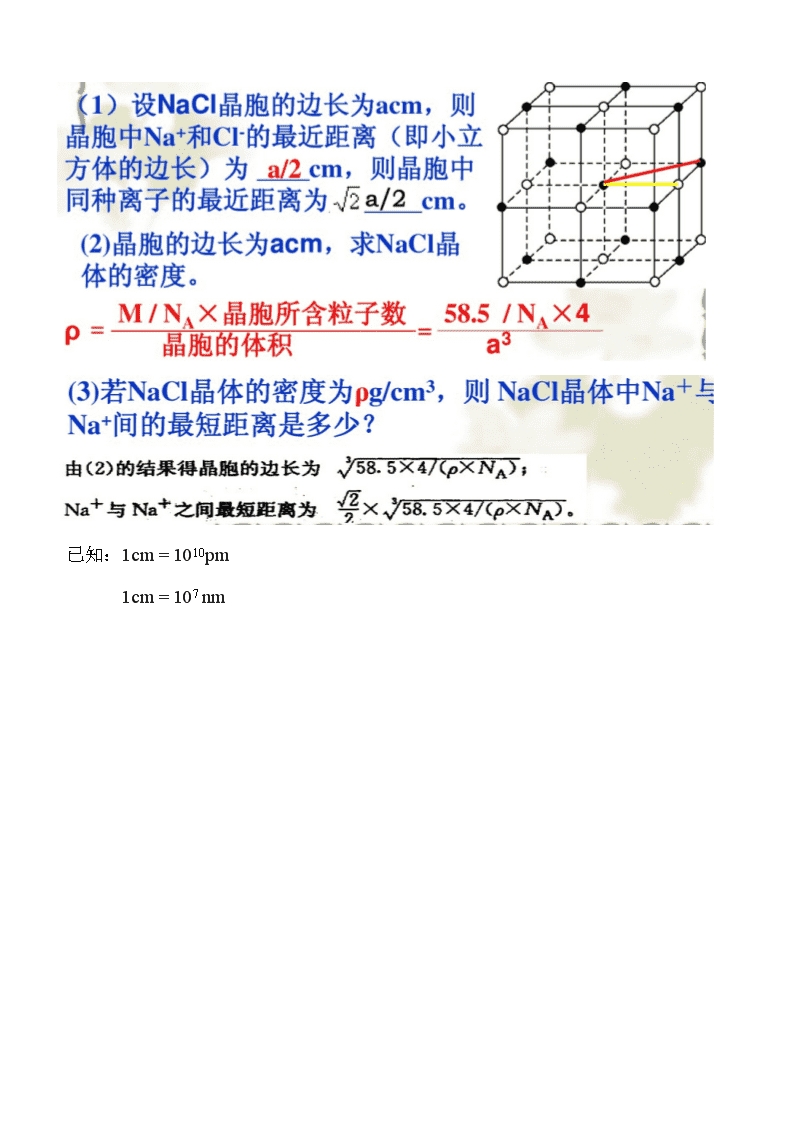
已知:1cm = 1010pm
1cm = 107 nm
相关文档
- 高考功能关系在电磁场中的综合应用2021-05-139页
- 2014高考英语一轮语法复习 专题精2021-05-132页
- 高考化学一轮复习元素及其化合物测2021-05-138页
- 2015高考数学(文)(数列的综合应用)一轮2021-05-139页
- 2014-2017高考真题选修45不等式选2021-05-137页
- 2017年高考全国2卷理综生物2021-05-134页
- 2019高考复习必备新课标人教版高中2021-05-1312页
- 全国高考理综试题及答案安徽2021-05-138页
- 高考英语试题分类汇编之短文改错篇2021-05-137页
- 高考英语完形填空书面表达二轮突破2021-05-135页