- 333.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2013年高考化学试题浙江卷
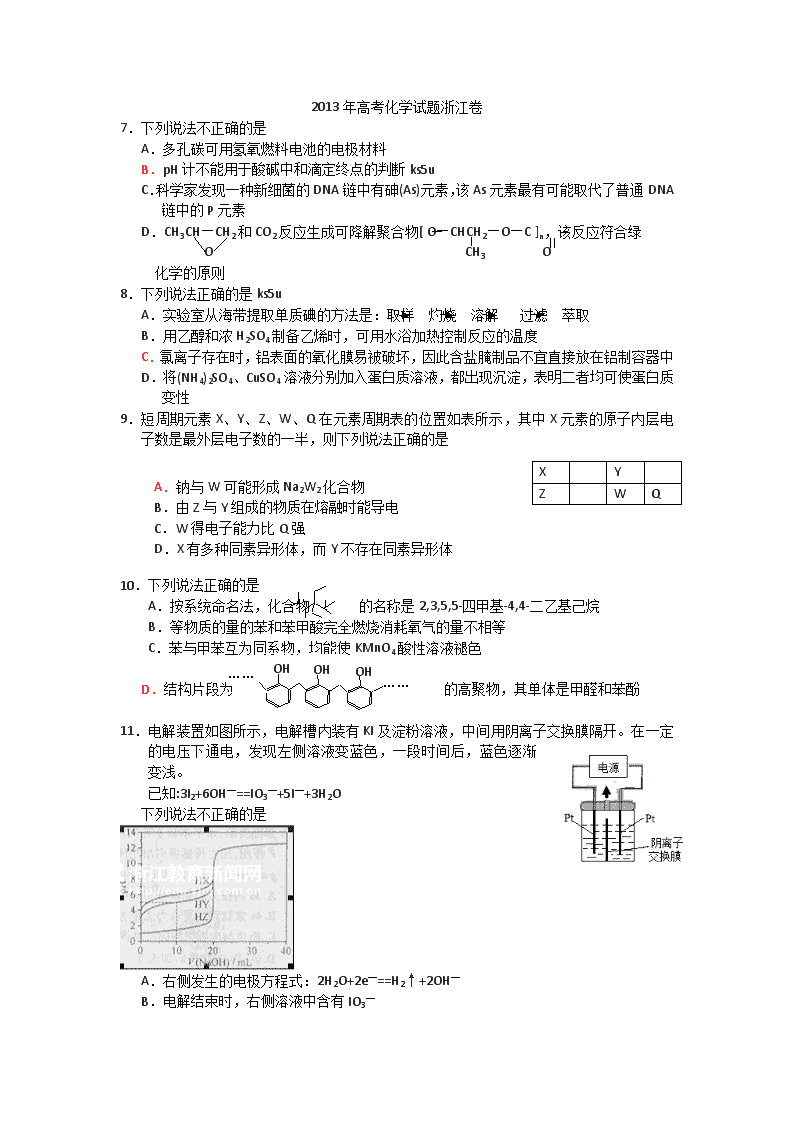
7.下列说法不正确的是
A.多孔碳可用氢氧燃料电池的电极材料
B.pH计不能用于酸碱中和滴定终点的判断ks5u
C.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素
D.CH3CH—CH2和CO2反应生成可降解聚合物[ O—CHCH2—O—C ]n,该反应符合绿
O CH3 O
化学的原则
8.下列说法正确的是ks5u
A.实验室从海带提取单质碘的方法是:取样 灼烧 溶解 过滤 萃取
B.用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度
C.氯离子存在时,铝表面的氧化膜易被破坏,因此含盐腌制品不宜直接放在铝制容器中
D.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性
9.短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法正确的是
X
Y
Z
W
Q
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的物质在熔融时能导电
C.W得电子能力比Q强
D.X有多种同素异形体,而Y不存在同素异形体
10.下列说法正确的是
A.按系统命名法,化合物 的名称是2,3,5,5-四甲基-4,4-二乙基己烷
B.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
OH
OH
OH
……
……
C.苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色
D.结构片段为 的高聚物,其单体是甲醛和苯酚
11.电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
已知:3I2+6OH—==IO3—+5I—+3H2O
下列说法不正确的是
A.右侧发生的电极方程式:2H2O+2e—==H2↑+2OH—
B.电解结束时,右侧溶液中含有IO3—
C.电解槽内发生反应的总化学方程式KI+3H2O======KIO3+3H2↑
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
12.25℃时,用浓度为0.1000 mol/L的NaOH溶液滴定20.00 mL浓度均为0.1000 mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10—5
Ka(HY)·c(HY) c(Y—)
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X—)>c(Y—)>c(OH—)>c(H+)
D.HY与HZ混合,达到平衡时:c(H+)= + c(Z—) +c(OH—)
银氨溶液
水浴加热
试液
NaOH (aq)
Na2CO3(aq)
滤液
沉淀物
焰色反应
观察到黄色火焰(现象1)
无银镜产生(现象2)
气体
溶液
H+
无沉淀(现象3)
白色沉淀(现象4)
血红色(现象5)
KSCN(aq)
H2O2
NH3·H2O(aq)
Na2CO3 (aq)
滤液
沉淀物
调节
pH=4
13.现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:
已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是
A.根据现象1可推出该试液中含有Na+
B.根据现象2可推出该试液中并不含有葡萄糖酸根
C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D.根据现象5可推出该试液中一定含有Fe2+
26、氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)甲的化学式是_________;乙的电子式是__________。
(2)甲与水反应的化学方程式是__________________________________-。
(3)气体丙与金属镁反应的产物是_______(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式_________。
有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之_________________________。
(已知Cu2O+2H+==Cu+Cu2++H2O)
(5)甲与乙之间_______(填“可能”或“不可能)发生反应产生H2,判断理由是________。
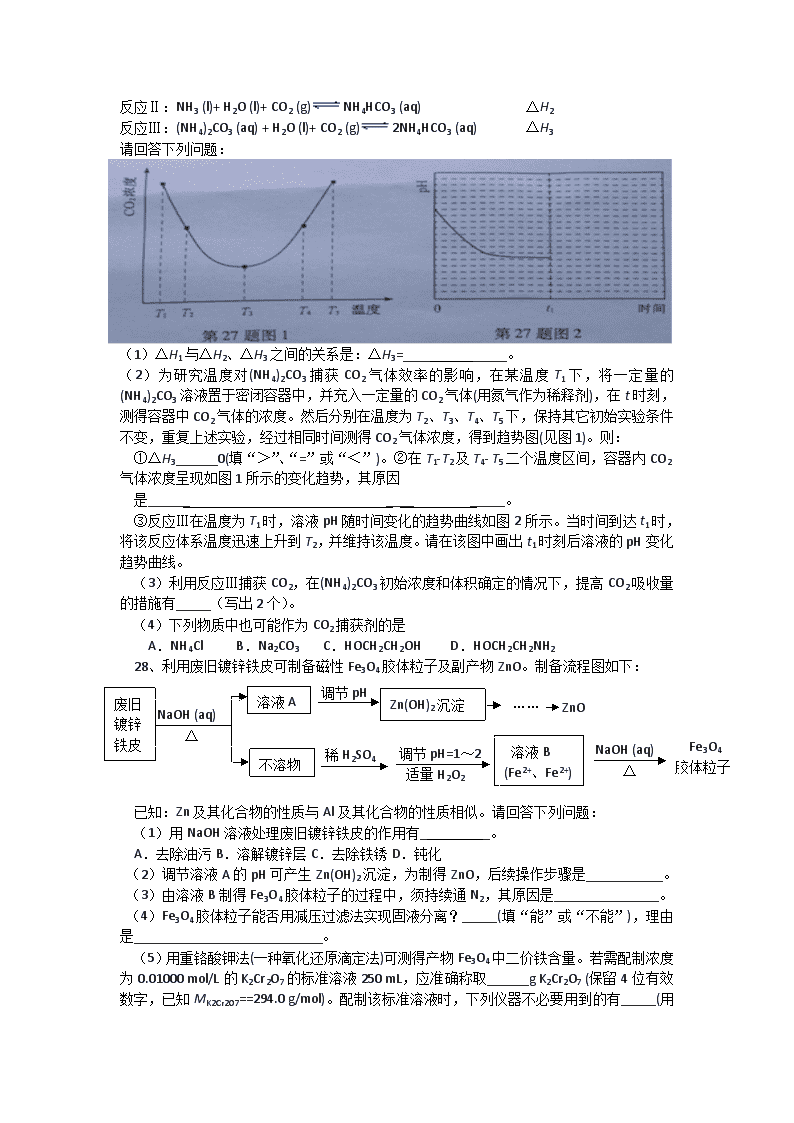
27、捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3 (l)+ H2O (l)+ CO2 (g)(NH4)2CO3 (aq) △H1
反应Ⅱ:NH3 (l)+ H2O (l)+ CO2 (g)NH4HCO3 (aq) △H2
反应Ⅲ:(NH4)2CO3 (aq) + H2O (l)+ CO2 (g)2NH4HCO3 (aq) △H3
请回答下列问题:
(1)△H1与△H2、△H3之间的关系是:△H3=_____ ______。
(2)为研究温度对(NH4)2CO3捕获CO2气体效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1)。则:
①△H3______0(填“>”、“=”或“<”)。②在T1-T2及T4- T5二个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,其原因
是______ ____ _____。
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示。当时间到达t1时,将该反应体系温度迅速上升到T2,并维持该温度。请在该图中画出t1时刻后溶液的pH变化趋势曲线。
(3)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有_____(写出2个)。
(4)下列物质中也可能作为CO2捕获剂的是
A.NH4Cl B.Na2CO3 C.HOCH2CH2OH D.HOCH2CH2NH2
28、利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:
Fe3O4
胶体粒子
废旧
镀锌
铁皮
NaOH (aq)
△
溶液A
稀H2SO4
溶液B
(Fe2+、Fe2+)
调节pH
…… ZnO
不溶物
Zn(OH)2沉淀
调节pH=1~2
适量H2O2
NaOH (aq)
△
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有__ _。
A.去除油污B.溶解镀锌层C.去除铁锈D.钝化
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是___________。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通N2,其原因是_______________。
(4)Fe3O4胶体粒子能否用减压过滤法实现固液分离?_____(填“能”或“不能”),理由是___________________________。
(5)用重铬酸钾法(一种氧化还原滴定法)可测得产物Fe3O4中二价铁含量。若需配制浓度为0.01000 mol/L的K2Cr2O7的标准溶液250 mL,应准确称取______g K2Cr2O7 (保留4位有效数字,已知MK2Cr2O7==294.0 g
/mol)。配制该标准溶液时,下列仪器不必要用到的有_____(用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
(6)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将_______(填“偏大”、“偏小”或“不变”)。
29.某课题组以苯为主要原料,采取以下路线合成利胆药——柳胺酚。
B
OH
OH
C—NH—
O
A
C
E
D
Cl2
FeCl3
试剂
NaOH/H2O
HCl
Fe
HCl
F
C7H6O3
回答下列问题:
NO2
NH2
Fe
HCl
柳胺酚
已知:
(1)对于柳胺酚,下列说法正确的是ks5u
A.1 mol柳胺酚最多可以和2 molNaOH反应 B.不发生硝化反应
C.可发生水解反应 D.可与溴发生取代反应
(2)写出A B反应所需的试剂______________。
(3)写出B C的化学方程式__________________________________。
(4)写出化合物F的结构简式_____________________________。
(5)写出同时符合下列条件的F的同分异构体的结构简式____________(写出3种)。
①属酚类化合物,且苯环上有三种不同化学环境的氢原子; ②能发生银镜反应
(6)以苯和乙烯为原料可合成聚苯乙烯,请设计合成路线(无机试剂及溶剂任选)。
CH3CH2OH
浓H2SO4
O2
催化剂
注:合成路线的书写格式参照如下示例流程图:
CH3COOCH2CH3
CH3COOH
CH3CHO
OH
C—OH
O
2013年浙江高考化学试卷参考答案
7、B【解析】A选项:氢氧燃料电池要求电极必须多孔具有很强的吸附能力,并具一定的催化作用,同时增大气固的接触面积,提高反应速率。C选项:As和P同主族。甲基环氧乙烷与二氧化碳在一定条件下反应生成聚碳酸酯,原子利用率达到100%,生成的聚碳酸酯易降解生成无毒无害物质,所以此反应符合绿色化学原则。B选项:pH计可用于酸碱中和滴定终点的判断。
8、C【解析】A选项:实验室从海带提取单质碘缺少了氧化过程,萃取后还要分液。B选项:用乙醇和浓H2SO4制备乙烯时必须使温度迅速提高至约170℃
,不可能是水浴加热(水浴加热温度最高只能达到100℃)。D选项:蛋白质溶液中加入饱和(NH4)2SO4溶液发生盐析(盐析是可逆过程,不破坏蛋白质的生理活性,加水后又溶解),蛋白质溶液中加入CuSO4等重金属盐溶液变性析出(变性是不可逆过程,蛋白质失去了生理活性,加水不再溶解)。C选项:通常认为是Cl—替换氧化铝中的O2—而形成可溶性的氯化物,所以铝表面的氧化膜易被Cl—破坏。
9、A【解析】由“X元素的原子内层电子数是最外层电子数的一半”可推出X为C,因此Y为O,Z为Si,W为S,Q为Cl。A选项:Na和S可形成类似于Na2O 2 的Na2S2。Z与Y组成的物质是SiO2,SiO2是原子晶体,熔融时不能导电。C选项:S得电子能力比Cl弱。D选项:C、O元素都能形成多种同素异形体。
10、D【解析】A选项:题给化合物正确的名称为2,2,4,5-四甲基-3,3-二乙基己烷。B选项:苯甲酸的分子式为C7H6O2,可将分子式变形为C6H6·CO2,因此等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等。C选项:苯不能使酸性高锰酸钾溶液褪色。
11、D
【解析】电解的电极反应为:阳极 2I——2e—== I2 左侧溶液变蓝色
3I2+6OH—==IO3—+5I—+3H2O 一段时间后,蓝色变浅
阴离子交换膜 向右侧移动
阴极 2H2O+2e—==H2↑+2OH— 右侧放出氢气
如果用阳离子交换膜代替阴离子交换膜:
电极反应为:阳极 2I——2e—== I2 多余K+
通过阳离子交换膜迁移至阴极
阴极 2H2O+2e—==H2↑+2OH— 保证两边溶液呈电中性
12、B【解析】浓度均为0.1000 mol/L的三种酸HX、HY、HZ,根据滴定曲线0点三种酸的pH可得到HZ是强酸,HY和HX是弱酸,但酸性:HY>HX。因此,同温同浓度时,三种酸的导电性:HZ>HY>HX。B选项:当NaOH溶液滴加到10 mL时,溶液中c(HY)≈c(Y—),即Ka(HY)≈c(H+)=10—pH=10—5。C选项:用NaOH溶液滴定至HX恰好完全反应时,HY早被完全中和,所得溶液是NaY和NaX混合溶液,但因酸性:HY>HX,即X—的水解程度大于Y—,溶液中c(Y—)>c(X—)。D选项:HY与HZ混合,溶液的电荷守恒式为:c(H+)= c(Y—)+ c(Z—) +c(OH—),又根据HY的电离平衡常数:
Ka(HY)·c(HY)
c(H+)
c(Y—)
c(H+)·c(Y—)
c(HY)
Ka(HY)= 即有:c(Y—)=
Ka(HY)·c(HY)
c(H+)
c(Y—)
所以达平衡后:c(H+)= + c(Z—) +c(OH—)
13、C【解析】A选项:因加入了NaOH (aq)和Na2CO3(aq),在滤液中引入了Na+,不能根据滤液焰色反应的黄色火焰判断试液是否含Na+。B选项:试液是葡萄糖酸盐溶液,其中一定含葡萄糖酸根,葡萄糖能发生银镜反应,葡萄糖酸根不能发生银镜反应。D选项:溶液加入H2O2
后再滴加KSCN(aq)显血红色,不能证明葡萄糖酸盐试液中是否含Fe2+。正确的方法是:在溶液中滴加KSCN(aq)不显血红色,再滴入滴加H2O2显血红色,证明溶液中只含Fe2+。若此前各步均没有遇到氧化剂,则可说明葡萄糖酸盐试液中只含Fe2+。C选项:根据“控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀”信息,在过滤除去Fe(OH)3的滤液中分别加入NH3·H2O(aq)和Na2CO3(aq),加入NH3·H2O(aq)不产生沉淀说明滤液中不含Mg2+,加入Na2CO3 (aq)产生白色沉淀,说明滤液中含Ca2+。
催化剂
△
△
26、【解析】“单质气体丙在标准状态下的密度为1.25 g/L”——丙为N2,化合物乙分解得到H2和N2,化合物乙为NH4H,NH4H有NH4+和H—构成的离子化合物。6.00 g化合物甲分解得到短周期元素的金属单质和0.3 molH2,而短周期元素的金属单质的质量为5.4 g;化合物甲与水反应生成的白色沉淀可溶于NaOH溶液,说明该沉淀可能是Al(OH)3,进而可判定化合物甲为AlH3。涉及的反应为:
a.甲、乙受热分解:2AlH3 =======2Al+3H2↑ 2NH4H=========N2↑+5H2↑
b.甲与水反应: 2AlH3+6H2O==2Al(OH)3+6H2↑
△
c. 2NH4H+5CuO======5Cu+ N2↑+5H2O
d. 化合物甲与乙可能发生的反应:2AlH3+ 2NH4H ======2Al+N2↑+8H2↑
化合物甲和乙的组成中都含—1价H,—1价H还原性很强,可发生氧化还原反应产生H2;
且2Al+3化合价降低6,2NH4H 中8H+1化合价降低8,化合价共降低14;2AlH3中6H—1和2NH4H中2H—化合价升高8,2NH4H中2N—3化合价升高6,化合价共升高14。
NH4H电子式:
第(4)题的实验设计是1992年全国高考题的再现:Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu。现有浓硫酸、浓硝酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,而没有其它试剂。简述如何用最简便的实验方法来检验CuO经氢气还原所得到的红色产物中是否含有碱性氧化物Cu2O。
实验方案设计的关键是Cu2O溶解而Cu不溶解:①Cu2O为碱性氧化物;②不能选用具有强氧化性的试剂,否则Cu被氧化为Cu2+。
实验方案设计的表述:简述操作步骤,复述实验现象,根据现象作出判断。
【答案】取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,证明产物Cu中含有Cu2O;若溶液不变蓝色,证明产物Cu中不含Cu2O。
27.【解析】(1)将反应Ⅰ倒过来书写:
(NH4)2CO3 (aq) 2NH3 (l)+ H2O (l)+ CO2 (g) —△H1
将反应Ⅱ×2:
+) 2NH3 (l)+ 2H2O (l)+ 2CO2 (g)2NH4HCO3 (aq) 2△H2
得:(NH4)2CO3 (aq) + H2O (l)+ CO2 (g)2NH4HCO3 (aq) △H3 =2△H2—△H1
(2)由图1可知:在温度为T3时反应达平衡,此后温度升高,c(CO2)增大,平衡逆向移动,说明反应Ⅲ是放热反应(△H3<0)。在T3前反应未建立平衡,无论在什么温度下(NH4)2CO3 (aq)总是捕获CO2,故c(CO2)减小。
反应Ⅲ在温度为T1时建立平衡后(由图2可知:溶液pH不随时间变化而变化),迅速上升到T2并维持温度不变,平衡逆向移动,溶液pH增大,在T2时又建立新的平衡。
(3)根据平衡移动原理,降低温度或增大c(CO2)
(4)具有碱性的物质均能捕获CO2,反应如下:
Na2CO3 +CO2 +H2O===2NaHCO3
HOCH2CH2NH2 +CO2 +H2O== HOCH2CH2NH3+ HCO3—
【答案】(1)2△H2—△H1 (2)①< ②T1-T2
区间,化学反应未达到平衡,温度越高,反应速率越快,所以CO2被捕获的量随温度的升而提高。T4- T5区间,化学反应已到达平衡,由于正反应是放热反应,温度升高,平衡向逆反应方向移动,所以不利于CO2的捕获。
③
(3)降低温度;增加CO2浓度(或压强) (4)BD
28.【解析】本题以“废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO”为载体,考查实验基本操作和技能。涉及标准溶液的配制及滴定的误差分析。试题主要取材于《实验化学》模块中《镀锌铁皮镀层厚度的测定》。试题难度不大。
【答案】(1)AB (2)抽滤、洗涤、灼烧
(3)防止Fe2+被氧化 (4)不能 胶体粒子太小,抽滤是透过滤纸
(5)0.7350 (0.01000 mol/L×0.250 L×294.0 g/mol) ③⑦
(6)偏大
29.【解析】根据合成路线,由柳胺酚的分子结构可逆推出F为邻羟基苯甲酸
NaO
NO2
HO
NO2
HO
NH2
E为 ,D为 ,C为 ,B为
Cl
Cl
NO2
,A为 。
柳胺酚分子中含酚羟基——具有酸性、酰胺键(类似于肽键)——发生水解反应。1 mol柳胺酚最多可以和3 mol NaOH反应,苯环上可以发生硝化反应,苯环上酚羟基邻对位的氢可以发生溴代反应,1mol柳胺酚与Br2反应最多可以消耗4 molBr2。
【答案】(1)CD
(2)浓硝酸和浓硫酸
O2N
ONaa
O2N
Cl
H2O
△
(3)
+ 2NaOH + NaCl+H2O
—CHO
HO
OH
(4)见解析
—CHO
HO—
OH
—CHO
HO—
OH
—CHO
HO OH
(5)
催化剂
加成脱氢
—CH=CH2
催化剂
[ CH—CH2] n
(6)
CH2=CH2