- 935.07 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2004---2013年天津市10年高考化学实验试题汇编
选择题部分
(2004)9.仅用一种试剂鉴别如下物质:苯、、溶液、溶液、溶液,下列 试剂中不能选用的是 ( )
A. 溴水 B. 溶液 C. 酸性溶液 D. 溶液
(2005)10.下列除杂质的方法不可行的是 ( )
A.用过量氨水除去Al3+溶液中的少量Fe3+ B.将混合气体通过灼热的铜网除去N2中的少量O2
C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水 D.用盐酸除去AgCl中少量的Ag2CO3
(2005)13.下列实验操作或事故处理中,正确的做法是 ( )
A.银镜反应实验后附有银的试管,可用稀H2SO4清洗
B.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
C.不慎将浓H2SO4沾在皮肤上,立即用NaOH溶液冲洗
D.在250mL烧杯中,加入216mL水和24gNaOH固体,配制10% NaOH溶液
(2007)8.为达到预期的实验目的,下列操作正确的是
A.欲配制质量分数为10%的ZnSO4溶液,将l0 g ZnSO4·7H2O溶解在90 g水中
B.欲制备F(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C.为鉴别KCl、AICl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
D.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用
(2008)13.下列实验方法合理的是
A.可用水鉴别己烷、四氯化碳、乙醇三种无色液体
B.油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油充分分离
C.可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液
D.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等
(2009)9.下列实验设计和结论相符的是
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
(2010)9.下列鉴别方法可行的是
A.用氨水鉴别Al3+、Mg2+和Ag+ B.用Ba(NO3)2溶液鉴别Cl-、SO和CO
C.用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷
D.用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO
(2010)11.下列实验设计及其对应的离子方程式均正确的是
A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
B.Na2O2与H2O反应制备O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
(2011)9. 向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
操作
现象
结论
A
滴加BaCl2溶液
生成白色沉淀
原溶液中有SO42-
B
滴加氯水和CCl4,振荡、静置
下层溶液显紫色
原溶液中有I-
C
用洁净铂丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液中有Na+,无K+
D
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无NH4+
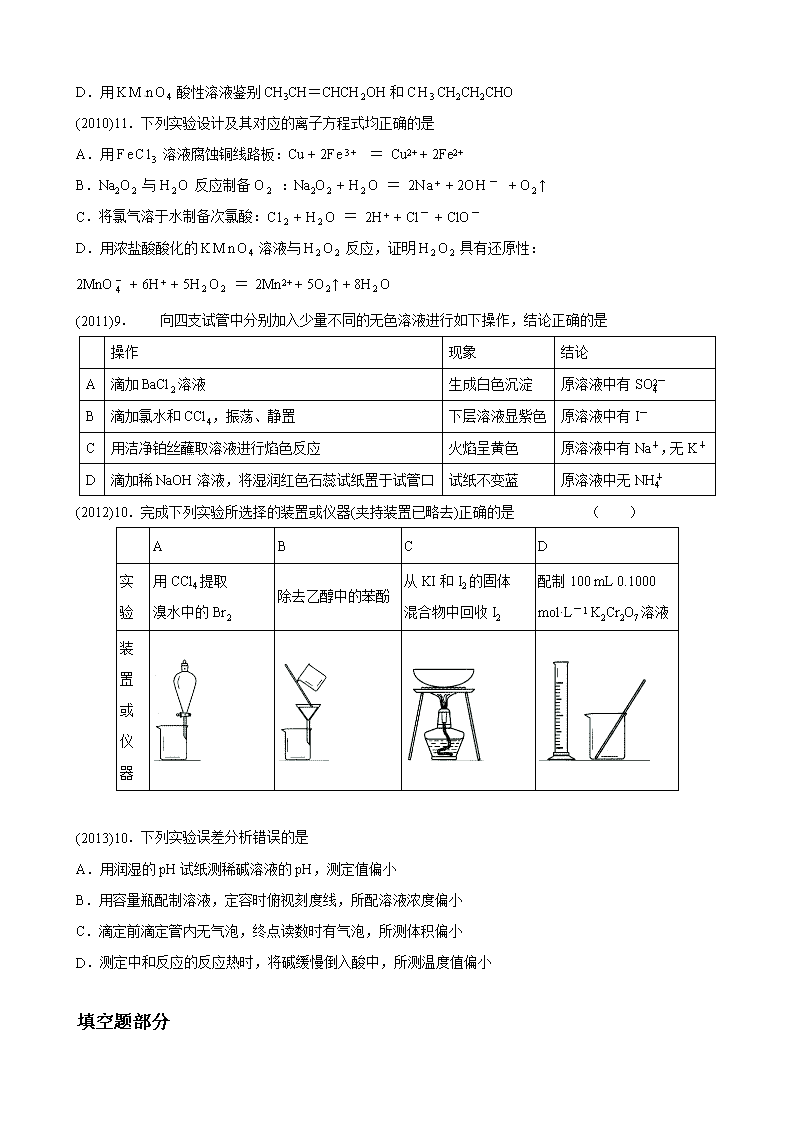
(2012)10.完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是 ( )
A
B
C
D
实
验
用CCl4提取
溴水中的Br2
除去乙醇中的苯酚
从KI和I2的固体
混合物中回收I2
配制100 mL 0.1000
mol·L-1 K2Cr2O7溶液
装
置
或
仪
器
(2013)10.下列实验误差分析错误的是
A.用润湿的pH试纸测稀碱溶液的pH,测定值偏小
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
填空题部分
(2004)28.(19分)I. 合成氨工业对化学的国防工业具有重要意义。写出氨的两种重要用途
。
II. 实验室制备氨气,下列方法中适宜选用的是 。
① 固态氯化铵加热分解 ② 固体氢氧化钠中滴加浓氨水
③ 氯化铵溶液与氢氧化钠溶液共热 ④ 固态氯化铵与氢氧化钙混合加热
III. 为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)。
[实验操作]
① 检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气发生。在F出口处收集氢气并检验其纯度。
② 关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③ 用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
(1)检验氢气纯度的目的是 。
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是 ,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是 ,C瓶内气体的成份是 。
(3)在步骤③中,先加热铁触媒的原因是 。反应管E中发生反应的化学方程式 。
(2005)28.(19分)根据侯德榜制减法原理并参考下表的数据,实验室制备纯碱Na2CO2的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得Na2CO3固体。
四种盐在不同温度下的溶解度(g/100g水)表
温度
盐 溶解度
0℃
10℃
20℃
30℃
40℃
50℃
60℃
100℃
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
37.3
39.8
NH4HCO3
11.9
15.8
21.0
27.0
-①
-
-
-
NaHCO3
6.9
8.1
9.6
11.1
12.7
14.5
16.4
-
NH 4Cl
29.4
33.3
37.2
41.4
45.8
50.4
55.3
77.3
①>35°NH4HCO3会有分解 请回答:
(1)反应温度控制在30—35℃,是因为若高于35℃则 ,若低于30℃,则 ;为控制此温度范围,采取的加热方法为
(2)加料完毕后,继续保温30分钟,目的是 。静置后只析出NaHCO3晶体的原因是 。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)。
(3)过滤所得的母液中含有 (以化学式表示),需加入 ,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO+H+=HCO3-反应的终点),所用HCl溶液体积为V1mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所HCl溶液总体积为V2mL。写出纯碱样品中NaHCO3质量分数的计算式:
NaHCO3(%)= 。
(2006)28.(19分)晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:300℃
①高温下用碳还原二氧化硅制得粗硅;②粗硅与干燥HCl气体反应制得SiHCl3: Si +3HCl SiHCl3+H2;③SiHCl3与过量H2在1000~1100℃反应制得纯硅。已知SiHCl3,能与H2O强烈反应,在空气中易自燃。请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)粗硅与HCl反映完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为 。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
①装置B中的试剂是 。 装置C中的烧瓶需要加热,其目的是 。
②反应一段时间后,装置D中观察到的现象是 ,
装置D不能采用普通玻璃管的原因是 ,装置D中发生反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是 。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
(2007)28.(19分)二氯化二硫(S2C12)在工业上用于橡胶的硫化。为在实验室合成S2C12,某化学研究性学习小组查阅了有关资料,得到如下信息:① 将干燥的氯气在110℃ ~ 140℃与硫反应,即可得S2C12粗品。
② 有关物质的部分性质如下表:
物质
熔点/℃
沸点/℃
化学性质
S
112.8
444.6
略
S2C12
-77
137
遇水生成HCl、SO2、S;
300℃以上完全分解;
S2C12 + C12 2SCl2
设计实验装置图如下:
⑴.上图中气体发生和尾气处理装置不够完善,请你提出改进意见____________________________________________________________________________。
利用改进后的正确装置进行实验,请回答下列问题:
⑵.B中反应的离子方程式:_________________________________________________;
E中反应的化学方程式:_________________________________________________。
⑶.C、D中的试剂分别是__________________________、_______________________。
⑷.仪器A、B的名称分别是____________、____________,F的作用是___________。
⑸.如果在加热E时温度过高,对实验结果的影响是_____________________________,
在F中可能出现的现象是________________________________________________。
⑹.S2C12粗品中可能混有的杂质是(填写两种)______________、________________,为了提高S2C12的纯度,关键的操作是控制好温度和______________________________。
(2008)28. ( 19分)Ⅰ(8分)化学实验室制取气体的方法之一是将浓硫酸滴入浓盐酸中。请从下图中挑选所需仪器,在方框内画出用该方法制备、收集干燥氯化氢气体的装置简图,并在图中标明所用试剂。(仪器可重复使用,固定装置不必画出)
试管
圆底烧瓶
集气瓶
烧杯
普通漏斗
量筒
分液漏斗
长颈漏斗
导管
橡胶塞
胶皮管
Ⅱ.(11分)实验室制备少量硫酸亚铁品体的实验步骤如下:取过量洁净的铁屑,加入20%%~30%的稀硫酸溶液,在50℃~80℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口.静置、冷却一段时间后收集产品.
(1)写出该实验制备硫酸亚铁的化学方程式:____________________________________。
(2)硫酸溶液过稀会导致______________________________________________________。
(3)采用水浴加热的原因是____________________________________________________。
(4)反应时铁屑过量的目的是(用离子方程式表示)______________________________。
(5)溶液趁热过滤的原因是____________________________________________________。
塞紧试管口的目的是______________________________________________________。
(6) 静置冷却一段时间后,在试管中观察到的现象是______________________________。
(2009)9.(18分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
(1)请列举海水淡化的两种方法: 、 。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 、或H2、 。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br,其目的为 。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,了如下装置简图:
请你参与分析讨论:
①图中仪器B的名称: 。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 。
③验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件: 。
④C中液体产生颜色为 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
(2010)28.(18分)纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,经过滤、水洗除去其中的Cl,再烘干、焙烧除去水分得到粉体TiO2 。
用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
⑴ TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________。
⑵ 检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
⑶ 下列可用于测定TiO2粒子大小的方法是_____________________(填字母代号)。
a.核磁共振法 b.红外光谱法 c.质谱法 d.透射电子显微镜法
⑷ 配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的_____(填字母代号)。
a b c d e
⑸ 滴定终点的现象是___________________________________________________。
⑹ 滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
⑺ 判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
① 若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果_________________________。
② 若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果_________。
(2011)28. (18分)某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CO的制备原理:HCOOHCO↑+H2O,并设计出原料气的制备装置(如下图)
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯。写出化学方程式: , 。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是 , ;
C和d中承装的试剂分别是 , 。若用以上装置制备H2, 气体发生装置中必需的玻璃仪器名称是 ;在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________________(填序号)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水
④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是______________。
a. 低温、高压、催化剂 b. 适当的温度、高压、催化剂
c. 常温、常压、催化剂 d. 适当的温度、常压、催化剂
(5)正丁醛经催化剂加氢得到含少量正丁醛的1—丁醇粗品,为纯化1—丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34℃,1—丁醇118℃,并设计出如下提纯路线:
试剂1为_________,操作1为________,操作2为_______,操作3为_______。
(2012)28.(18分)信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
请回答下列问题:
⑴ 第①步Cu与酸反应的离子方程式为____________________________________;
得到滤渣1的主要成分为___________________。
⑵ 第②步加H2O2的作用是_____________________,使用H2O2的优点是___________________________;调溶液pH的目的是使__________________生成沉淀。
⑶ 用第③步所得CuSO4·5H2O制备无水CuSO4的方法是________________________________________。
⑷ 由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
上述三种方案中,________方案不可行,原因是___________________________:
从原子利用率角度考虑,___________方案更合理。
⑸ 探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol LL-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2+ + H2Y2- = CuY2- + 2H+ 。写出计算CuSO4·5H2O质量分数的表达式ω= ____________ ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶 b.滴定终点时滴定管尖嘴中产生气泡 c.未除净可与EDTA反应的干扰离子
(2013)28.(18分)FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3
的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的H2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为 。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端要使沉积的FeCl3进入收集器,第④步操作是 。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) 。
(4)装置B中冷水浴的作用为 ;装置C的名称为 ;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂: 。
(5)在虚线框中画出尾气吸收装置E并注明试剂。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为 。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为 。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;② 。
参考答案
(2004)9. D (2005) 10.A (2005)13.B (2007)8C (2009) 9. B (2010)3C (2010)5A
(2011)9:B (2012)10ª (2013)4B
(2004)28.(19分)I. 制化肥、制硝酸 II. ②④
III. (1)排除空气,保证安全
(2)锌粒与酸脱离 尽量增大氢气的浓度以提高氮气的转化率 N2 H2
(3)铁触媒在较高温度时活性增大,加快氨合成的反应速率
(2005)28.(1)NH4HCO3分解 反应速率降低 水浴加热
(2)使反应充分进行 NaHCO3的溶解度最小 NaCl NH4Cl NH4HCO3
(3)NaHCO3 NaCl NH4Cl NH4HCO3 HCl
(4)
(2006) 高温
28.(19 分)
(1) SiO2+2C Si+2CO↑
(2)分馏(或蒸馏)
(3)①浓硫酸 使滴人烧瓶中的SiHCI3气化
②有固体物质生成 100—1100℃
在反应温度下,普通玻璃会软化
SiHCI3+H2 Si+3HCI
③排尽装置中的空气
④bd
(2007)28.(19分)⑴.用导管将A的上口和B相连(或将A换成恒压滴液漏斗) (1分)
在G和H之间增加干燥装置 (2分)
⑵.MnO2 + 4 H+ +2 C1- == Mn2+ + C12 ↑+ 2H2O
2 S + C12 S2C12 (各1分,共2分)
⑶.饱和食盐水(或水) 浓硫酸 (各1分,共2分)
⑷.分液漏斗 蒸馏烧瓶 导气、冷凝 (各1分,共4分)
⑸.产率降低 (2分)
有固体产生(或其他正确描述) (2分)
⑹.SCl2、C12、S(任写其中两种即可) (各1分,共2分)
控制浓盐酸的滴速不要过快 (2分)
(2008)28.(19分)
Ⅰ.(8分)
浓H2SO4
浓H2SO4
浓HCl
H2O
①
②
③
④
Ⅱ.(11分)
(2009)28.(共18分)
(1)蒸馏法、电渗析法、离子交换法及其他合理答案中的任意两种
(2)Cl2 NaOH NaClO
(3)富集溴元素
(4)Br2 + SO2 + 2H2O = 4H+ + SO42- + 2Br- 强酸对设备的严重腐蚀
(5)①冷凝管 ②Br2腐蚀橡胶 ③控制温度计b的温度,并收集59℃时的馏分 ④深红棕色 分液(或蒸馏)
(2010)9、(1) TiCl4+(2+x) H2O TiO2·xH2O+4HCl
(2)取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净。
(3)d
(4)抑制 NH4Fe(SO4)2水解 a c
(5)溶液变成红色
(6)
(7)偏高 偏低
(2011) 28、(1)Zn+2HCl=ZnCl2+H2↑;(CH3)2CHOHCH2=CHCH3↑+H2O;
(2)恒压 防倒吸 NaOH溶液 浓硫酸 分液漏斗 蒸馏烧瓶
(3)④⑤①②③(或④⑤①③②);
(4)b
(5)饱和NaHSO3溶液 过滤 萃取 蒸馏
(2012)28、 ⑴ Cu + 4H+ + 2NOCu2+ + 2NO2↑+ 2H2O 或3Cu + 8H+ + 2NO3Cu2+ + 2NO↑+ 4H2O
⑵ 将Fe2+氧化为Fe3+ 不引入杂质,对环境无污染 Fe3+、Al3+
⑶ 加热脱水
⑷ 甲 所得产品中含有较多Fe2(SO4)3杂质 乙
⑸ × 100% c
(2013)
相关文档
- 2014年全国高考文科数学试题及答案2021-05-1311页
- 陕西高考理科数学试题及答案详解2021-05-1314页
- 地理高考试题分类汇编专题17 海洋2021-05-133页
- 高考物理选修35复习讲义无答案2021-05-1334页
- 2013高考英语专题精练精析(7)2021-05-138页
- 2015高考数学(理)(算法与程序框图)一轮2021-05-1311页
- 高考生物第部分判断纠错第章动物和2021-05-139页
- 2018高考数学全国3卷文科试卷2021-05-137页
- 高考生物一轮复习课时分层作业三十2021-05-136页
- 五年高考真题精编——验证机械能守2021-05-138页