- 268.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第3章 金属及其化合物 3.4检测
时间:45分钟 满分:100分
一、选择题(每题6分,共66分)
1.[2017·山东潍坊高三联考]我国晋代《抱朴子》中描述了大量的化学反应,其中有:①“丹砂(HgS)烧之成水银,积变又还成丹砂”;②“以曾青涂铁,铁赤色如铜”。下列有关叙述正确的是 ( )
A.①中描述的化学反应是可逆反应
B.“曾青”是含有Cu2+的溶液,如硫酸铜溶液
C.“积变又还成丹砂”中的“还”可理解为“被还原”
D.水银能跟曾青发生置换反应生成单质铜
答案 B
解析 ①中描述的化学反应为HgSHg+S、Hg+S===HgS,两个反应的反应条件不同,不是可逆反应,A项错误;“铁赤色如铜”,说明铁置换出铜,故“曾青”应为可溶性铜盐的水溶液,B项正确;“积变又还成丹砂”,发生的反应是Hg+S===HgS,Hg发生了氧化反应,“还”是指恢复原来的状态,C项错误;Hg的活动性比Cu弱,因此水银不能与曾青发生置换反应生成单质铜,D项错误。
2.[2016·石家庄模拟]下列关于金属的冶炼方法叙述不正确的是( )
金属
存在形式
冶炼方法
A
金
游离态
金子比沙子密度大,利用水洗法直接分离
B
银
化合态
银的金属性弱,用加热Ag2O的方法冶炼
C
铁
化合态
铝的金属性比铁强,可用铝热法炼铁
D
钠
化合态
钠的金属性强,一般还原剂很难将其还原出来,所以用电解饱和NaCl溶液的方法冶炼
答案 D
解析 用电解熔融NaCl来制取金属钠,电解饱和NaCl溶液得到的是NaOH、H2和Cl2。
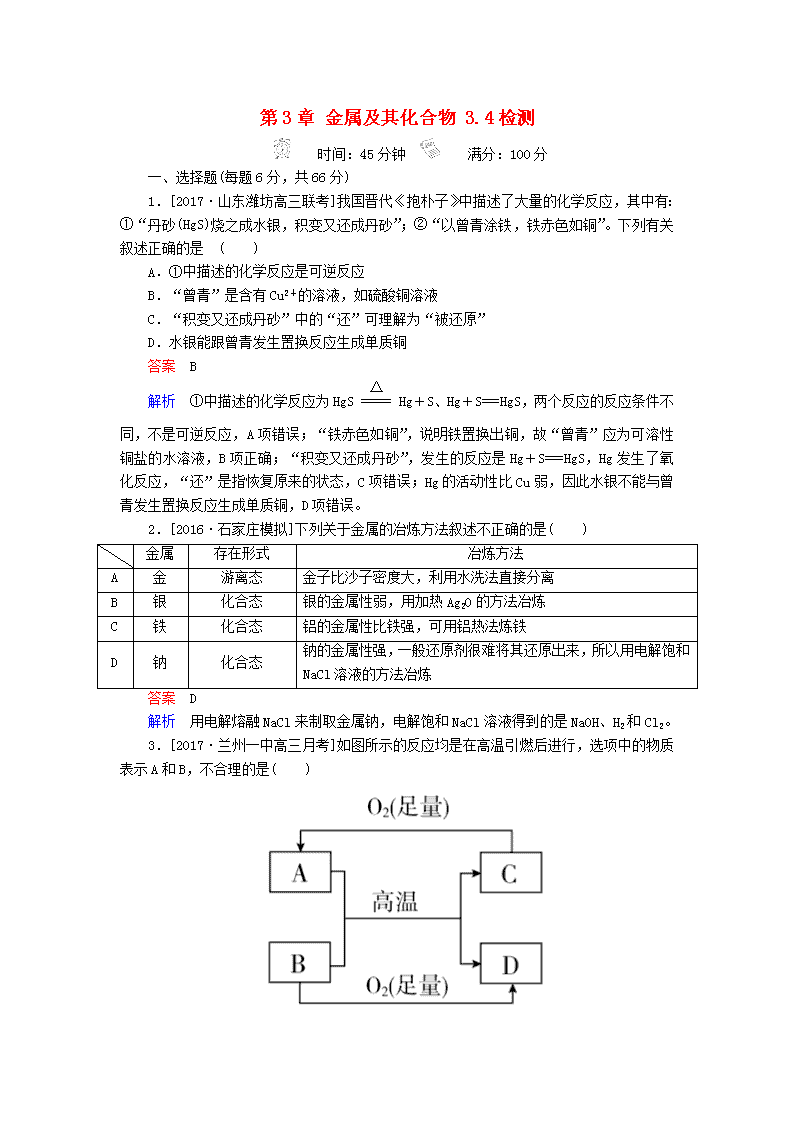
3.[2017·兰州一中高三月考]如图所示的反应均是在高温引燃后进行,选项中的物质表示A和B,不合理的是( )
A.MgO Al B.CO2 Mg
C.Fe3O4 Al D.CuO H2
答案 A
解析 Mg的活泼性强于Al,若A为MgO,B为Al,二者不能发生铝热反应,A项错误;CO2与Mg反应生成C(即C)和MgO(即D),Mg与O2反应生成MgO,C与足量O2反应生成CO2,B项正确;Fe3O4与Al能发生铝热反应,生成Fe(即C)和Al2O3(即D),C项正确;H2还原CuO生成Cu(即C)和H2O(即D),D项正确。
4.[2017·大连二十四中测试]人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”。在“五金”顺序中,把一种金属的位置向后移一位,正好符合某化学规律。这种金属和该化学规律是( )
A.铁、金属活动性顺序表
B.金、质量守恒定律
C.银、元素周期律
D.铜、金属密度顺序表
答案 A
解析 将铁移到锡后,金、银、铜、锡、铁的金属活动性逐渐增强,A项正确。
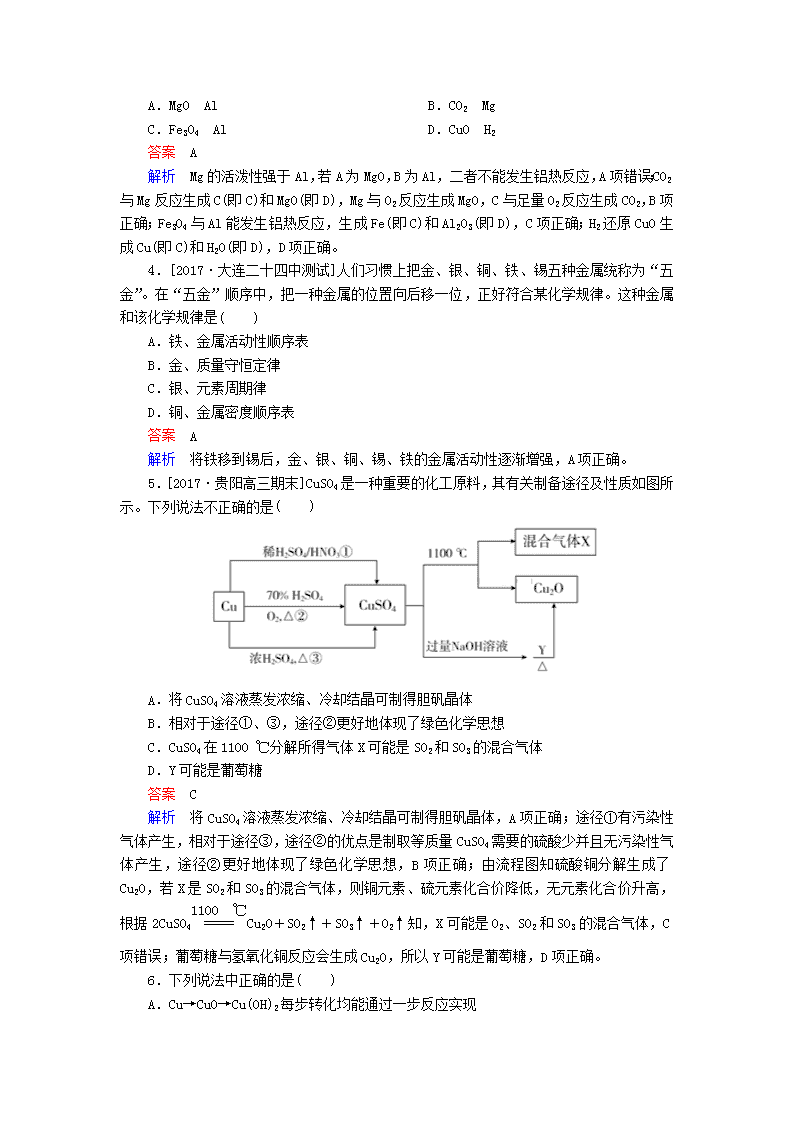
5.[2017·贵阳高三期末]CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )
A.将CuSO4溶液蒸发浓缩、冷却结晶可制得胆矾晶体
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.CuSO4在1100 ℃分解所得气体X可能是SO2和SO3的混合气体
D.Y可能是葡萄糖
答案 C
解析 将CuSO4溶液蒸发浓缩、冷却结晶可制得胆矾晶体,A项正确;途径①有污染性气体产生,相对于途径③,途径②的优点是制取等质量CuSO4需要的硫酸少并且无污染性气体产生,途径②更好地体现了绿色化学思想,B项正确;由流程图知硫酸铜分解生成了Cu2O,若X是SO2和SO3的混合气体,则铜元素、硫元素化合价降低,无元素化合价升高,根据2CuSO4Cu2O+SO2↑+SO3↑+O2↑知,X可能是O2、SO2和SO3的混合气体,C项错误;葡萄糖与氢氧化铜反应会生成Cu2O,所以Y可能是葡萄糖,D项正确。
6.下列说法中正确的是( )
A.Cu→CuO→Cu(OH)2每步转化均能通过一步反应实现
B.铝合金是一种混合物,它比纯铝的熔点高
C.金属铜放置在潮湿的空气中会被锈蚀,生成绿色的铜锈——碱式碳酸铜
D.金属铝、铁、铜都有一定的抗腐蚀性能,其抗腐蚀的原因都是表面形成氧化物薄膜,阻止反应的进一步进行
答案 C
解析 A选项,CuO→Cu(OH)2不能通过一步实现,错误;B选项,铝合金比纯铝的熔点低,错误;D选项,铁、铜表面不能形成致密的氧化膜,错误。
7.下列说法中正确的是( )
A.纯铁易被腐蚀,可以在纯铁中混入碳元素制成“生铁”,以提高其抗腐蚀能力
B.我们使用合金是因为它比纯金属具有更优良的化学性质
C.我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料
D.Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到
答案 C
解析 纯铁抗腐蚀能力很强,生铁在潮湿的空气中易形成微小原电池而腐蚀,A项错误;合金比其成分金属具有更加优良的物理机械性能,B项错误;Na、Al用电解法冶炼,Cu可以用热还原法冶炼得到,D项错误。
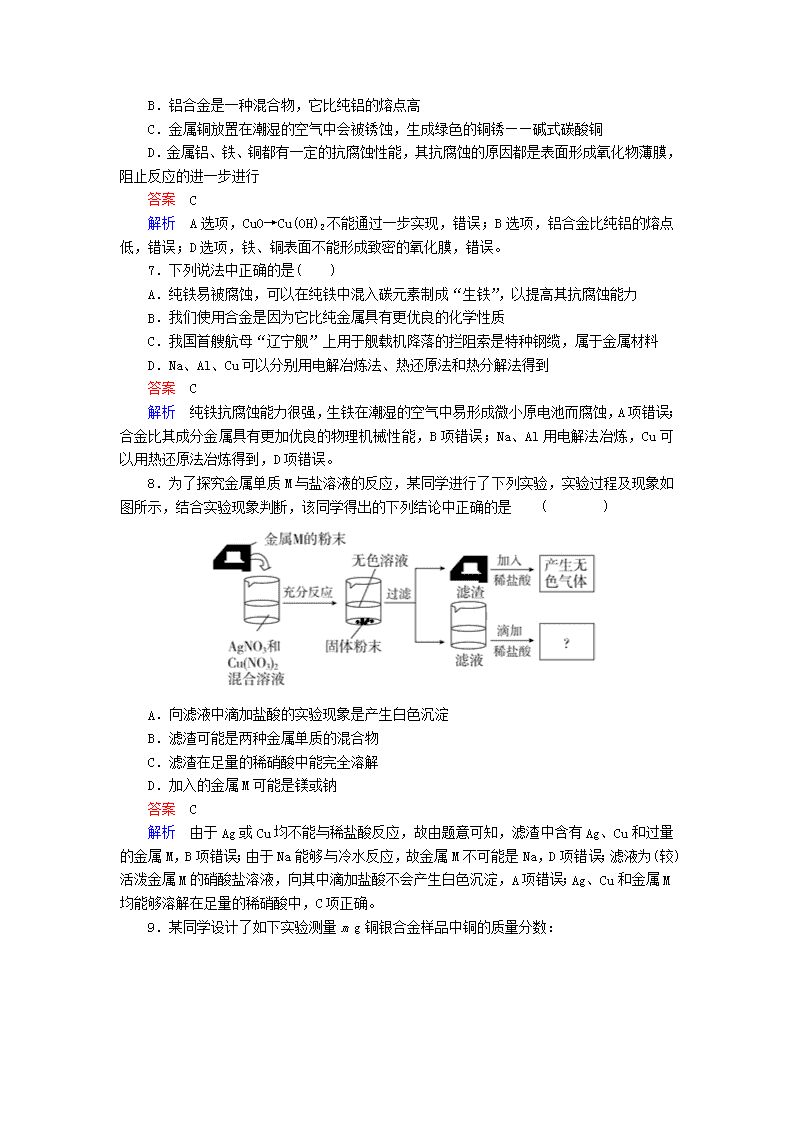
8.为了探究金属单质M与盐溶液的反应,某同学进行了下列实验,实验过程及现象如图所示,结合实验现象判断,该同学得出的下列结论中正确的是 ( )
A.向滤液中滴加盐酸的实验现象是产生白色沉淀
B.滤渣可能是两种金属单质的混合物
C.滤渣在足量的稀硝酸中能完全溶解
D.加入的金属M可能是镁或钠
答案 C
解析 由于Ag或Cu均不能与稀盐酸反应,故由题意可知,滤渣中含有Ag、Cu和过量的金属M,B项错误;由于Na能够与冷水反应,故金属M不可能是Na,D项错误;滤液为(较)活泼金属M的硝酸盐溶液,向其中滴加盐酸不会产生白色沉淀,A项错误;Ag、Cu和金属M均能够溶解在足量的稀硝酸中,C项正确。
9.某同学设计了如下实验测量m g铜银合金样品中铜的质量分数:
下列说法中不正确的是( )
A.合金的熔点比其成分金属低,通常比成分金属具有更优良的金属特性
B.铜银都能与稀硝酸反应,收集到的V L气体全为NO
C.操作Ⅰ是过滤,操作Ⅱ是洗涤
D.铜的质量分数为×100%
答案 D
解析 不论是浓硝酸还是稀硝酸与Cu、Ag反应生成的气体用排水法收集到的一定全部是NO,B项正确;W g固体应该是干燥纯净的AgCl,故Ⅰ为过滤,由于过滤后的氯化银附着一些离子,应洗涤附着的物质,防止影响氯化银的质量测定,故Ⅱ为洗涤,C项正确;氯化银的质量为W g,所以合金中银的质量为W g×= g,故合金中铜的质量分数为×100%=×100%,故D错误。
10.某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验:
9.4 g X6.4 g固体蓝色溶液1.92 g固体
下列有关说法正确的是 ( )
A.步骤Ⅰ中减少的3 g固体一定是混合物
B.步骤Ⅱ中质量减少的物质一定是Cu
C.根据步骤Ⅰ、Ⅱ可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2
D.根据步骤Ⅱ可以得出m(Fe2O3)∶m(Cu)=1∶1
答案 D
解析 步骤Ⅰ中,加入过量氢氧化钠溶液固体质量减少了3 g,溶解的物质可能是Al2O3和SiO2中的一种或两种,故A项和C项错误;步骤Ⅱ中加入过量盐酸,Fe2O3溶解后又和Cu发生反应,故减少的固体是Fe2O3和Cu,B项错误;步骤Ⅱ中发生的总反应为Fe2O3+Cu+6HCl===2FeCl2+CuCl2+3H2O,溶解的固体(6.4-1.92=4.48 g)中,Fe2O3和Cu的物质的量相等,又因为盐酸过量,Fe2O3完全溶解,剩余的固体为Cu,可计算出Fe2O3和Cu的质量相等,D项正确。
11.部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.92 g,经如下处理:
下列说法中正确的是( )
①滤液A中的阳离子为Fe2+、Fe3+、H+ ②样品中氧元素的物质的量为0.03 mol ③溶解样品的过程中消耗H2SO4的总的物质的量为0.04 mol ④V=224 mL
⑤V=336 mL
A.①③④ B.②③④
C.②③⑤ D.①③⑤
答案 B
解析 由滤液A中不含Cu2+可知,样品中加入足量稀硫酸发生的反应有Fe+H2SO4===FeSO4+H2↑,Fe2O3+3H2SO4===Fe2(SO4)3+3H2O,CuO+H2SO4===CuSO4+H2O,Fe+Cu2+===Fe2++Cu,Fe+2Fe3+===3Fe2+。溶液中阳离子只有Fe2+、H+,无Fe3+,①错误;因滤液A中不含Cu2+,故3.2 g滤渣只是Cu(物质的量是0.05 mol),滤液经处理最终得到的3.2 g固体是Fe2O3。由2Fe~Fe2O3可知,该5.92 g样品中,铁元素的总质量为2.24 g(物质的量是0.04 mol),故混合物中氧元素的质量为5.92 g-2.24 g-3.2 g=0.48 g,即样品中氧元素的物质的量是=0.03 mol,②正确;消耗的H2SO4以FeSO4的形式存在,故消耗的H2SO4的物质的量为0.04 mol,③正确;因5.92 g样品中含0.03 mol O、0.04 mol Fe、0.05 mol Cu,则样品可以看作Fe、FeO、Cu的形式,因氧元素的物质的量是0.03 mol,故FeO的物质的量为0.03 mol、Fe的物质的量为0.01 mol,与足量的稀硫酸反应可生成0.01 mol的H2,标准状况下H2的体积为224 mL,④正确、⑤错误。
二、非选择题(共34分)
12.(12分)工业上用黄铜矿冶炼铜及对炉渣综合利用的一种工艺流程如图所示:
(1)冶炼过程中得到Cu2O和Cu的混合物称为“泡铜”,其与金属Al在高温条件下混合反应可得粗铜,反应化学方程式为______________________。黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的原理:______________________________________________ __________________________________________________________________________________________________。
(2)传统炼铜的方法主要是火法炼铜,其主要反应为:
①2CuFeS2+4O2Cu2S+3SO2+2FeO
②2Cu2S+3O22Cu2O+2SO2
③2Cu2O+Cu2S6Cu+SO2↑
每生成1 mol Cu,共消耗________mol O2。反应③中的氧化剂是________。
(3)炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。根据流程回答下列问题:
①加入适量NaClO溶液的目的是________________(用离子方程式表示)。
②除去Al3+的离子方程式是________________________________________________________________________。
③选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂有:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水。
所选试剂是________,实验设计:________________________________________________________________________________________________________________________________________________。
答案 (1)3Cu2O+2AlAl2O3+6Cu 电解池中,粗铜作阳极,精铜作阴极,电解质为硫酸铜溶液。阳极上发生氧化反应,Cu失去电子,使Cu单质变为Cu2+进入溶液中,Cu-2e-===Cu2+;阴极上发生还原反应,Cu2+得到电子在阴极上析出Cu单质,Cu2++2e-===Cu,从而达到精制Cu的目的
(2)2.5 Cu2O和Cu2S
(3)①2Fe2++ClO-+2H+===2Fe3++Cl-+H2O
②Al3++4OH-===AlO+2H2O
③稀硫酸、KMnO4溶液 取少量高锰酸钾溶液于试管中,滴加经稀硫酸溶解的炉渣溶液,高锰酸钾溶液的紫色褪去,证明含有Fe2+
解析 (1)Al和Cu2O反应生成Cu,化学方程式为3Cu2O+2AlAl2O3+6Cu;粗铜作阳极,纯铜作阴极,电解硫酸铜溶液制取纯铜。
(2)由题中的化学方程式知,生成6 mol Cu,需要3 mol Cu2S,2 mol Cu2O,共需要O2 15 mol, 每生成1 mol Cu,共消耗O2 2.5 mol;由化合价变化知,氧化剂为Cu2O和Cu2S。
(3)由流程知,加入NaClO的目的是氧化Fe2+,离子方程式为2Fe2++ClO-+2H+===2Fe3++Cl-+H2O,加入足量NaOH溶液除去其中的Al3+;稀硫酸溶解矿石,然后用KMnO4
溶液检验其中的Fe2+。
13.[2016·江西重点中学联考](12分)氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业上采用如下工艺流程,从某酸性废液(主要含Cu2+、Fe3+、H+、Cl-)中制备氯化亚铜。
请回答下列问题:
(1)写出步骤①中发生的两个主要反应的离子方程式:____________________________________________。
(2)步骤②的操作名称是________。
(3)步骤④中所加物质X为________。
(4)步骤⑤的操作是___________________________________ _____________________________________。
(5)步骤⑥应调节溶液pH呈酸性,且用乙醇洗涤CuCl晶体,目的是____________________。
(6)在CuCl的生成过程中,可以循环利用的物质是________________,理论上________(填“是”或“否”)需要补充(不考虑调节等消耗);理由是_____________________ _____________________________________________。
答案 (1)Cu2++Fe===Cu+Fe2+、Fe+2Fe3+===3Fe2+或Fe+2H+===Fe2++H2↑
(2)过滤、洗涤(不答洗涤也可)
(3)CuO(或Cu(OH)2等)
(4)在HCl气流中蒸发结晶
(5)减少CuCl的损失
(6)硫酸(或H2SO4) 否 Cu与浓硫酸反应生成CuSO4和SO2的物质的量为1∶1,而生产CuCl的过程中消耗CuSO4和SO2的物质的量也为1∶1,所以理论上不需要补充H2SO4
解析 (3)加CuO等调pH,不会引入杂质。
(4)在HCl气流中蒸发会抑制Cu2+的水解。
(5)根据题中信息可知,CuCl不溶于稀H2SO4和乙醇,所以调成酸性,且用乙醇洗涤CuCl晶体。
(6)最终有H2SO4生成,浓H2SO4与Cu反应又生成SO2和CuSO4,所以H2SO4为可循环利用的物质,生成H2SO4与消耗H2SO4在理论上相同,所以无需补充。
14.[2017·郑州高中质检](10分)钴(Co)及其化合物在磁性材料、电池材料、超硬材料及催化剂等领域有广泛应用。已知钴属于铁系元素,其单质及化合物的性质与铁相似,其常见化合价有+2和+3。请回答下列问题:
(1)在空气中加热CoCO3可得到黑色Co3O4,写出该反应的化学方程式________________________________。
(2)Co3O4与浓盐酸反应能生成黄绿色气体,写出该反应的离子方程式________________________________。
(3)常温下,CoCl2溶液在碱性条件下可以得到粉红色Co(OH)2沉淀。已知当溶液中某离子的浓度≤10-5 mol·L-1时,就认为该离子不存在,Ksp[Co(OH)2]=1.0×10-15。若要使0.1 mol·L-1 CoCl2溶液中的Co2+完全沉淀,则溶液pH的控制范围为________。
(4)Co(OH)2具有较显著的两性,在浓的强碱溶液中可以形成[Co(OH)4]2-,写出Co(OH)2酸式电离的电离方程式________________________________。
(5)Co(OH)2在空气中加热时,样品质量随温度变化的曲线如下图所示。通过分析计算确定:
①1000 ℃时,固体的成分为________。
②取800 ℃时的产物(其中Co的化合价为+2、+3),用480 mL 5 mol·L-1盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。则该钴氧化物中n(Co2+)∶n(Co3+)=________。
答案 (1)6CoCO3+O22Co3O4+6CO2
(2)Co3O4+8H++2Cl-===3Co2++Cl2↑+4H2O
(3)≥9
(4)Co(OH)2+2H2O===[Co(OH)4]2-+2H+
(5)①CoO ②3∶2
解析 (1)在空气中加热CoCO3,空气中含有大量O2,不可能生成CO,则必生成CO2,根据得失电子守恒和元素守恒配平方程式。
(2)Co3+具有强氧化性,在酸性条件下可将Cl-氧化为Cl2,本身被还原为Co2+。
(3)c2(OH-)≥==1.0×10-10,则c(OH-)≥1.0×10-5 mol·L-1,pH≥9。
(5)①1000 ℃时所得固体的摩尔质量为93× g·mol-1=75 g·mol-1,可知该固体为CoO。
②n(Co3+)=2n(Cl2)=2×=0.4 mol,所得溶液为CoCl2溶液,则溶液中
n(Co2+)总=[n(HCl)-2n(Cl2)]=×(0.48 L×5 mol·L-1-0.4 mol)=1.0 mol,则钴氧化物中n(Co2+)=1.0 mol-0.4 mol=0.6 mol,故n(Co2+)∶n(Co3+)=0.6∶0.4=3∶2。
相关文档
- 高考复习经济生活核心考点2021-05-138页
- 步步高2017高考英语一轮复习Unit1L2021-05-1320页
- 江苏省高考数学试卷及答案 Word2021-05-1311页
- 高考化学复习物质制备及性质探究类2021-05-139页
- 2015高考数学(理)(几何证明选讲(一)相2021-05-1310页
- 2015高考数学(理)(数系的扩充与复数的2021-05-138页
- 高考物理专题冲刺专题23变压器与电2021-05-139页
- 2019高考英语二轮阅读理解(三月强2021-05-134页
- 2017年江苏数学高考试卷含答案和解2021-05-1327页
- 全国新课标高考文科数学试题及答案2021-05-138页