- 895.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高中化学化学用语专题复习 高考复习题
学校:___________姓名:___________班级:___________考号:___________
一、单选题
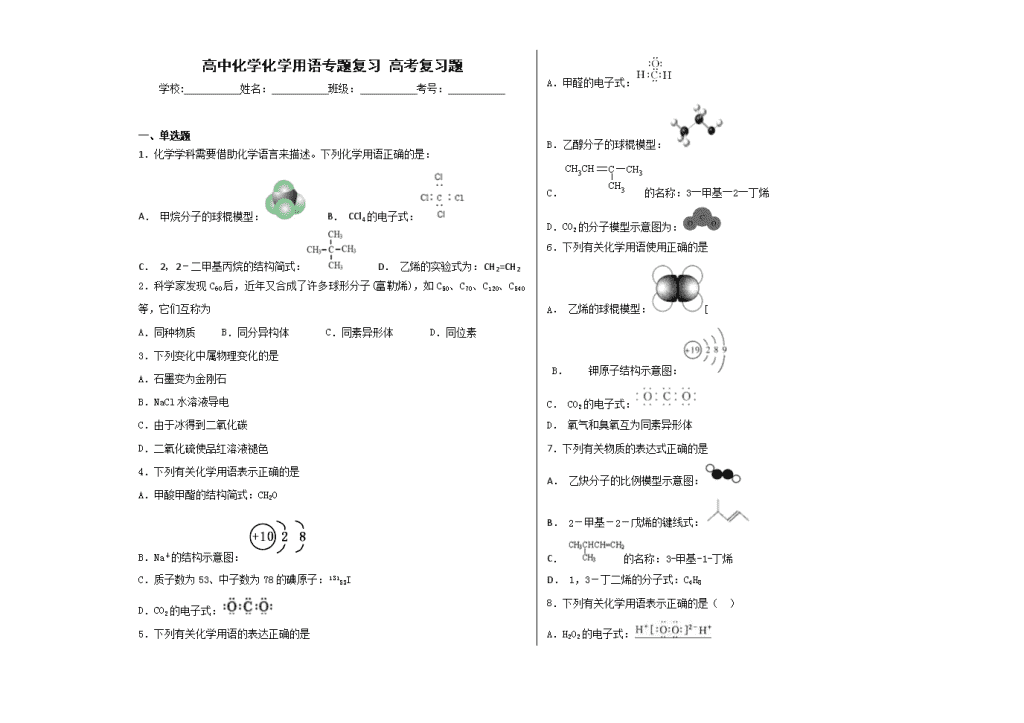
1.化学学科需要借助化学语言来描述。下列化学用语正确的是:
A. 甲烷分子的球棍模型: B. CCl4的电子式:
C. 2,2﹣二甲基丙烷的结构简式: D. 乙烯的实验式为:CH2=CH2
2.科学家发现C60后,近年又合成了许多球形分子(富勒烯),如C50、C70、C120、C540等,它们互称为
A.同种物质 B.同分异构体 C.同素异形体 D.同位素
3.下列变化中属物理变化的是
A.石墨变为金刚石
B.NaCl水溶液导电
C.由于冰得到二氧化碳
D.二氧化硫使品红溶液褪色
4.下列有关化学用语表示正确的是
A.甲酸甲酯的结构简式:CH2O
B.Na+的结构示意图:
C.质子数为53、中子数为78的碘原子:13153I
D.CO2的电子式:
5.下列有关化学用语的表达正确的是
A.甲醛的电子式:
B.乙醇分子的球棍模型:
C.的名称:3―甲基―2―丁烯
D.CO2的分子模型示意图为:
6.下列有关化学用语使用正确的是
A. 乙烯的球棍模型:[
B. 钾原子结构示意图:
C. CO2的电子式:
D. 氧气和臭氧互为同素异形体
7.下列有关物质的表达式正确的是
A. 乙炔分子的比例模型示意图:
B. 2-甲基-2-戊烯的键线式:
C. 的名称:3-甲基-1-丁烯
D. 1,3-丁二烯的分子式:C4H8
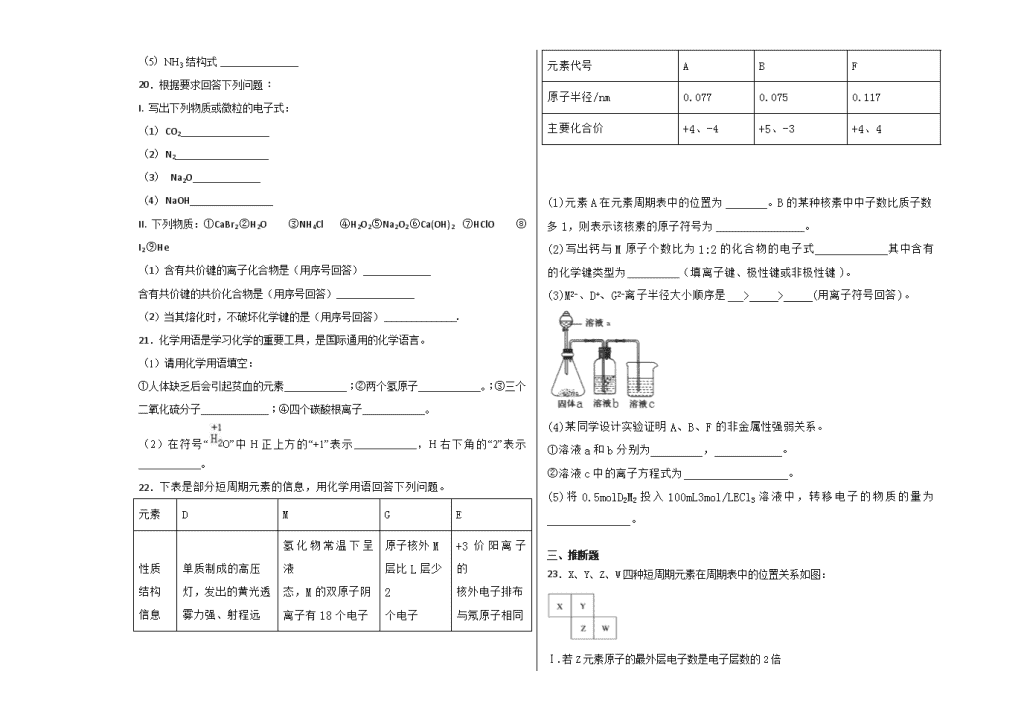
8.下列有关化学用语表示正确的是( )
A.H2O2的电子式:
B.铝离子的结构示意图:
C.质子数为35、中子数为45的溴原子: Br
D. C与C互为同素异形体
9.下列表示物质结构的化学用语或模型图正确的是
A.HClO的结构式:H-O-Cl
B.H2O2的电子式:H+[∶∶∶] 2-H+
C.CO2的比例模型:
D.14C的原子结构示意图:
10.下列有关化学用语的表述正确的是
A. A B. B C. C D. D
11.下列各组表达式意义相同的是
A. 和-OH B. HCOOCH3和HOOCCH3
C. 和 D. -NO2和NO2
12.下列变化或过程属于物理变化的是
A.激光法蒸发石墨得C60 B.渗析法净化氢氧化铁胶体
C.鸡蛋白遇浓硝酸显黄色 D.直流电通过氯化钠水溶液
二、填空题
13.(1)写出下列物质或微粒的电子式
①CO2__②KCl__③H2O2___④N2___;
(2)用电子式表示MgCl2的形成过程__.
14.按要求写出下列物质的化学用语:
①乙烯的结构式:_______________
②乙酸的结构简式:_______________
③甲烷的电子式:_______________
④淀粉的分子式__________________
15.(8分)完成下列化学方程式
(1)实验室制乙炔:
(2)乙醇的催化氧化:
(3)甲苯的硝化:
(4)苯酚钠溶液中通入少量二氧化碳:
16.用化学符号填空
氮元素 两个氢离子 氧分子
五氧化二磷中磷元素的化合价
17.(6分)完成下列各题。
(1)“可燃冰”是天然气的水合物,外形似冰,它的主要可燃成分是甲烷,写出甲烷燃烧的化学方程式_________________
(2)碳酸氢钠可用作治疗胃酸(主要含盐酸)过多的药剂,写出该反应的化学方程式_______________________________
18.(6分)根据题目要求书写化学用语
(1)硫酸铁的电离方程式 。
(2)符合CO32-+2H+===H2O+CO2↑的化学方程式 。
(3)氯水中滴加硝酸银溶液,该反应的离子方程式 。
19.正确表达下列物质的化学用语
(1) CO2 电子式 ____________
(2)NH4Cl 电子式 _______________
(3)MgF2 电子式 ____________________________
(4)N2的结构式 _________
(5)NH3 结构式 _______________
20.根据要求回答下列问题:
I. 写出下列物质或微粒的电子式:
(1)CO2_________________
(2)N2__________________
(3) Na2O_____________
(4)NaOH________________
II. 下列物质:①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧ I2 ⑨He
(1)含有共价键的离子化合物是(用序号回答)_____________
含有共价键的共价化合物是(用序号回答)_______________
(2)当其熔化时,不破坏化学键的是(用序号回答)______________.
21.化学用语是学习化学的重要工具,是国际通用的化学语言。
(1)请用化学用语填空:
①人体缺乏后会引起贫血的元素____________;②两个氢原子____________。;③三个二氧化硫分子_____________;④四个碳酸根离子____________。
(2)在符号“O”中H正上方的“+1”表示____________,H右下角的“2”表示____________。
22.下表是部分短周期元素的信息,用化学用语回答下列问题。
元素
D
M
G
E
性质
结构
信息
单质制成的高压
灯,发出的黄光透
雾力强、射程远
氢化物常温下呈液
态,M的双原子阴
离子有18个电子
原子核外M
层比L层少2
个电子
+3价阳离子的
核外电子排布
与氖原子相同
元素代号
A
B
F
原子半径/nm
0.077
0.075
0.117
主要化合价
+4、-4
+5、-3
+4、4
(1)元素A在元素周期表中的位置为________。B的某种核素中中子数比质子数多1,则表示该核素的原子符号为_________________。
(2)写出钙与M原子个数比为1:2的化合物的电子式______________其中含有的化学键类型为__________(填离子键、极性键或非极性键)。
(3)M2-、D+、G2-离子半径大小顺序是___> > (用离子符号回答)。
(4)某同学设计实验证明A、B、F的非金属性强弱关系。
①溶液a和b分别为__________,_____________。
②溶液c中的离子方程式为____________________。
(5)将0.5molD2M2投入100mL3mol/LECl3溶液中,转移电子的物质的量为________________。
三、推断题
23.X、Y、Z、W四种短周期元素在周期表中的位置关系如图:
Ⅰ.若Z元素原子的最外层电子数是电子层数的2倍
(1)W在周期表中的位置为________________。
(2)仅有Y和Z两种元素组成的两种化合物之间可以进行相互转化,写出化学方程式:___________________________________________________________。
(3)写出铜和X的最高价氧化物水化物的稀溶液反应的离子方程式:_______________________________________________________________。
(4)W最高价氧化物水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28 mol电子转移时,共产生9 mol气体,写出该反应的化学方程式:_________________________________________________________________。
Ⅱ.若Y和Z的核外电子数之和为22。
(1)Y和H元素以原子比1∶2形成的物质的电子式为______________。
(2)将X的最高价氧化物通入到苯酚钠溶液中,实验现象是____________。
(3)X单质与W的最高价氧化物水化物的浓溶液反应,当电子转移0.4 mol时,产生气体的体积(标准状况下)是________L。
24.有关物质的转化关系如下图所示(部分物质与条件已略去)。已知A是由两种元素组成的黑色粉末,B由两种元素组成、其摩尔质量为65g•mol-1,C是空气中含量最多的单质,D是白色粉末且焰色反应呈黄色,E是一种紫红色金属,F是一种无色气体单质,H是一种红棕色气体,I是最常见的液体,K是一种强碱。
(1)B的化学式为__________________。
(2)K的电子式为__________________。
(3)写出反应①的化学方程式:_________________________________________。
(4)写出反应②的离子方程式:____________________________________。
25.(11分)A是自然界存在最广泛的ⅡA族元素,常以化合物F存在。从单质A起始发生的一系列化学反应可由下图表示:
请回答下列问题:
(1)A与水反应的化学方程式为____________,E与水反应的化学方程式为______ _ ______;
(2)F的化学式为_____________,G和D的电子式分别为____________和______________;
(3)D与H反应可能生成的盐有_______ ______ (填化学式);
(4)如何由F制备A : 。
四、计算题
26.某固体仅由一种元素组成,其密度为5g·cm-3,用X射线研究该固体的结构表明,在棱长为1×10-7cm的立方体中含有20个原子,求此元素的近似相对原子质量。
27.(9分)标准状况下,11.2LCO和CO2混合气体质量为20.4g,求混合气体中CO和CO2的体积比和质量
五、综合题
28.有A、B、C、D、E、F六种短周期的主族元素,原子序数依次增大,其中A、D元素的原子最外层均只有一个电子,且A和D可形成离子化合物;C、F同主族,B元素位于元素周期表中的第二周期,且原子最外层电子数占核外电子总数的3/4,F元素原子最外电子层比同周期E元素原子的最外电子层多5个电子。试回答:
(1)D、F两元素最高价氧化物的水化物之间发生的化学方程式是__________。
(2)D的氢氧化物和C的氢化物在水溶液中反应的离子方程式为__________。
(3)E的氢氧化物的电子式是______________;B的氢化物的电子式是
______________。
29.聚甲基丙烯酸羟乙酯的结构简式为,它是制作软质隐形眼镜的材料.请写出下列有关反应的化学方程式:
(1)由甲基丙烯酸羟乙酯制备聚甲基丙烯酸羟乙酯_________________________;
(2)由甲基丙烯酸制备甲基丙烯酸羟乙酯_________________________;
(3)由乙烯制备乙二醇__________________________________________________;
30.按要求写出化学方程式:
(1)苯酚与过量的浓溴水反应
(2)制备聚丙烯
(3)实验室制备乙烯
(4)制备TNT
(5)2—丙醇催化氧化
六、解答题
31.用①H2O ②H2O2 ③Ba(OH)2 ④Na2O2 ⑤MgCl2 ⑥Ar ⑦CO2 ⑧CaF2 ⑨NH4Cl
⑩CaO2 Ca(ClO)2 N2H4等物质填空。
(1)只存在离子键的是________(2) 由离子键和极性键构成的是_________
(3)由离子键和非极性键构成的是_________(4) 由极性键和非极性键构成的是_________
(5)写出下列物质的电子式:Na2S2:_________(NH4)2S:______
(6)写出下列物质的结构式:BCl3:_________ HClO:__________
(7)用电子式写出下列物质的形成过程:MgCl2:___________。
七、实验题
32.(共6分,每空1分)用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示。
实验编号
待测NaOH溶液的体积/mL
HCl溶液的体积/mL
1
25.00
26.40
2
25.00
24.38
3
25.00
24.42
试回答下列问题:
(1)使用酚酞做指示剂,滴定过程中两眼应该注视_________________,滴定终点的判断是 。
(2)实验中,指示剂加2滴不能多加是因为:
(3)未知浓度的NaOH溶液的物质的量浓度为 mol/L。(精确到0.0001)
(4)有下列错误操作:
①酸式滴定管用蒸馏水洗净后,未经标准溶液润洗就注入标准的盐酸溶液
②用碱式滴定管取用待测液前,尖嘴部分有气泡,取用过程中气泡消失
③滴定前,读取酸液体积时视线低于酸式滴定管的液面,滴定后读出酸液的体积时,
视线高于酸式滴定管的液面
④锥形瓶用待测液润洗两次
哪些错误操作会使NaOH浓度的测定值偏低?答:_____________。
哪些错误操作会使NaOH浓度的测定值偏高?答:_____________。
参考答案
1.C
【解析】A. 甲烷为正四面体结构,分子中含有4个碳氢键,甲烷正确的球棍模型为:,故A错误;B .CCl4的电子式为:,故B错误;C.依据烷烃的命名原则,2,2﹣二甲基丙烷主链上有3个碳原子,2号碳上有2个甲基,所以结构简式为:,故C正确;D.乙烯的实验式为CH2,故D错误;故答案选C。
2.C
【解析】
试题分析:根据由同一元素形成的不同单质称为同素异形体;同分异构体是分子式相同结构式不同的化合物;结构和性质完全相同的是同一种物质;质子数相同中子数不同原子互称同位素;C50、C70、C120、C540等物质都是由碳元素组成的单质,是同素异形体,故选:C;
考点:考查“四同”的判断
3.C
【解析】物理变化和化学变化的本质区别在于是否有新物质生成。一般来说,物质发生物理变化的时候往往破坏的是范德华力,并不生成新物质,而发生化学变化的时候则是破坏原来的化学键,再形成新键,那有新物质生成。A、B、D项都属在变化过程中产生新物质,即发生了化学变化,故选C。
4.C
【解析】
试题分析:A.甲酸甲酯的结构简式为HCOOCH3,最简式为CH2O,故A错误;B.钠原子失去最外层的1个电子形成钠离子,质子数不变为11,核外电子数为10,有2个电子层,最外层电子数为10,钠离子结构示意图为,故B错误;C.质子数为53、中子数为78的碘原子,质量数=53+78=131,故该碘原子符号为53131I,故C正确;D.二氧化碳分子中碳原子与氧原子之间形成2对共用电子对,电子式为,故D错误;故选C。
【考点定位】考查常用化学用语
【名师点晴】本题考查常用化学用语,旨在考查学生对基础知识的理解掌握,注意掌握常用化学用语的书写。解决这类问题需要注意:①书写电子式时应特别注意如下几个方面:阴离子及多核阳离子均要加“[]”并注明电荷,书写共价化合物电子式时,不得使用“[]”,没有成键的价电子也要写出来。②书写结构式、结构简式时首先要明确原子间结合顺序(如HClO应是H—O—Cl,而不是H—Cl—O),其次是书写结构简式时,碳碳双键、碳碳三键应该写出来。③比例模型、球棍模型要能体现原子的相对大小及分子的空间结构。
5.B
【解析】
试题分析:A中,甲醛的电子式书写错误,碳与氧之间形成碳氧双键。B反映的确实是乙,乙醇分子的球棍模型。C的名称应该为2—甲基—2—丁烯。二氧化碳是属于直线型分子,故D错。
考点:重点考查了电子式的书写,球棍模型,有机物的命名,分子模型示意图。
6.D
【解析】略
7.C
【解析】分析:A.乙炔是直线形结构;
B.将碳、氢元素符号省略,只表示分子中键的连接情况,每个拐点或终点均表示有1个碳原子,称为键线式;
C.根据有机物是烯烃判断;
D.1,3-丁二烯含有2个碳碳双键。
详解:A. 乙炔是直线形结构,该模型不能表示乙炔分子的比例模型,A错误;
B. 该键线式表示的是4-甲基-2-戊烯,B错误;
C. 是烯烃,主链含有4个碳原子,含有1个甲基作支链,则其名称为3-甲基-1-丁烯,C正确;
D. 1,3-丁二烯的分子式为C4H6,D错误。答案选C。
8.B
【解析】
试题分析:A、双氧水为共价化合物;
B、铝离子是铝原子失去三个电子形成的;
C、质量数=质子数+中子数;
D、由同种元素形成的不同单质互为同素异形体.
解:A、双氧水为共价化合物,分子中存在两个氧氢键和一个O﹣O键,双氧水的电子式为:,故A错误;
B、铝离子是铝原子失去三个电子形成的,故铝离子的结构示意图为,故B正确;
C、质量数=质子数+中子数,故质子数为35、中子数为45的溴原子的质量数为80,故符号为8035Br,故C错误;
D、由同种元素形成的不同单质互为同素异形体,而146C与126C均为碳原子,不是单质,故不是同素异形体,故D错误.
故选B.
9.A
【解析】
试题分析:A、次氯酸的原子连接顺序是H-O-Cl,所以结构式正确,正确;B、过氧化氢属于共价化合物,不能用“[ ]”表示电子式,错误;C、二氧化碳分子中,C原子的半径大于O原子的半径,比例模型与原子半径不符,错误;D、C原子的核内有6个质子,中子数是8个,错误,答案选A。
考点:考查化学用语的判断
10.C
【解析】
试题分析:A、该物质的命名为2-甲基-1,3-丁二烯,错误;B、该物质应以醇为母体,命名为1-甲基丙醇,错误;C、二氧化碳是直线型分子,C与O原子之间以碳氧双键结合,正确;D、该模型为乙烯的比例模型,错误,答案选C。
考点:考查对化学用语的判断
11.C
【解析】分析:A.根据是否带有电荷分析判断;B.前者为甲酸甲酯,后者为乙酸,二者表示的为不同的烃的衍生物;C.根据乙基的结构简式的书写方法分析判断;D.-NO2 表示官能团,NO2表示物质。
详解:A.-OH为羟基,羟基中氧原子最外层7个电子,表示的是阴离子,二者表示的意义不同,故A错误;B
.前者表示的是甲酸甲酯,属于酯类,后者表示的是乙酸,属于羧酸,二者互为同分异构体,表示的物质不同,故B错误;C.二者表示的取代基类型相同,均为乙基和环戊基,表示的是同一种物质,表达式意义相同,故C正确;D.-NO2为硝基,属于有机物的官能团,NO2为氮元素的氧化物,二者表示的意义不同,故D错误;故选C。
点睛:本题考查了化学表达式的含义,掌握常见化学表达式的书写方法是解题的关键。本题的易错点为A,要注意羟基不带电,电子式为。
12.B
【解析】石墨与C60互为同素异形体,浓硝酸使鸡蛋白发生变性作用,电解质导电必然伴随着氧化还原反应的发生,它们都发生化学变化。
13.
【解析】本题考查电子式的书写,(1)①CO2是共价化合物,碳原子和氧原子间共用两个电子对,即电子式为;②KCl是离子化合物,阴离子注意用[ ],其电子式为;③H2O2属于共价化合物,存在“-O-O-”,电子式为;④N2中两个氮原子共用三个电子对,即电子式为;(2)MgCl2属于离子化合物,注意箭头右端相同离子不能合并写,应在Mg2+左右两端,即为。
点睛:本题易错点在问题(2),用电子式表示形成过程时,首先判断此物质是离子化合物还是共价化合物,用箭头连接,不能用等号,箭头右端相同离子不能合并写,因此为。
14. CH3COOH (C6H10O5)n
【解析】①乙烯的结构式为,故答案为:;
②乙酸的结构简式为CH3COOH,故答案为:CH3COOH;
③甲烷的电子式为,故答案为:;
④淀粉的分子式为(C6H10O5)n,故答案为:(C6H10O5)n。
15.(1)CaC2 + 2H2O → C2H2↑+ Ca(OH)2
(2) 2CH3CH2OH + O2 → 2CH3CHO + 2H2O
【解析】(1)实验室制乙炔用电石与水反应,方程式为:CaC2 + 2H2O → C2H2↑+ Ca(OH)2;
(2)乙醇的催化氧化:2CH3CH2OH + O2 → 2CH3CHO + 2H2O(铜或银做催化剂,加热)
(3)甲苯的硝化:
(4)苯酚钠溶液中通入少量二氧化碳:
16.N 2H+ O2
【解析】
试题分析:元素用元素符号表示,氮元素为N;离子的表示方法是在元素符号的右上角标上所带的电荷和电性,两个氢离子表示为2H+
;分子用化学式表示,一个氧气分子有2个氧原子构成,氧分子的化学符号为O2;物质中元素的化合价标在该物质中元素符号的正上方,五氧化二磷中磷元素的化合价为。
考点:考查化学符号的使用
17.(1)CH4 + 2O2→CO2+ 2H2O (2)NaHCO3+HCl=NaCl + H2O+CO2↑
【解析】
试题分析:(1)甲烷是可燃性气体,完全燃烧生成CO2和水,反应的化学方程式是CH4 + 2O2→CO2+ 2H2O。
(2)碳酸氢钠是酸式盐,能和盐酸反应生成CO2、水和氯化钠,反应的化学方程式是NaHCO3+HCl=NaCl + H2O+CO2↑。
考点:考查化学方程式的书写
点评:化学方程式,也称为化学反应方程式,是用化学式表示不同物质之间化学反应的式子。化学方程式反映的是客观事实。因此书写化学方程式要遵守两个原则:一是必须以客观事实为基础,绝不能凭空臆想、臆造事实上不存在的物质和化学反应;二是要遵守质量守恒定律,等号两边各原子种类与数目必须相等。
18.(化学式错、没配平均不得分) (各2分,共6分)
(1) Fe2(SO4)3 = 2 Fe3+ +3 SO42-
(2) Na2 CO3 + 2H Cl = 2 NaCl + H2O+CO2↑
(3) Ag+ + Cl- = AgCl↓
【解析】略
19.
【解析】(1)CO2是共价化合物,电子式为;(2)NH4Cl是离子化合物,电子式为;(3)MgF2是离子化合物,电子式为
;(4)N2的结构式为;(5)NH3的结构式 为。
20. ③⑤⑥ ②④⑦ ②④⑦⑧⑨
【解析】I. (1)CO2是共价化合物,电子式为; (2)N2分子中存在氮氮三键,电子式为;(3) Na2O是离子化合物,电子式为;(4)NaOH是含有离子键和共价键的离子化合物,电子式为;
II. ①CaBr2是含有离子键的离子化合物;②H2O是含有共价键的共价化合物;③NH4Cl是含有离子键和共价键的离子化合物;④H2O2是含有共价键的共价化合物;⑤Na2O2是含有离子键和共价键的离子化合物;⑥Ca(OH)2是含有离子键和共价键的离子化合物;⑦HClO是含有共价键的共价化合物;⑧I2是含有共价键的单质;⑨He是稀有气体分子,不存在化学键,则
(1)根据以上分析可知含有共价键的离子化合物是③⑤⑥;含有共价键的共价化合物是②④⑦;(2)当其熔化时破坏的是离子键,共价键不变,则不破坏化学键的是②④⑦⑧⑨。
21. Fe 2H 3SO2 4CO32﹣ 在水中氢元素显+1价 一个水分子中含有2个氢原子;
【解析】(1)①人体缺乏后会引起贫血的元素是Fe;②两个氢原子可表示为2H;③三个二氧化硫分子可表示为3SO2;④四个碳酸根离子可表示为4CO32-。
(2)在符号“O”中H正上方的“+1”表示在水中氢元素显+1价,H右下角的“2”表示一个水分子中含有2个氢原子。
22. 第二周期ⅣA族 715N 离子键和非极性键 S2->O2->Na+ 硝酸(HNO3) 饱和NaHCO3溶液 SiO32-+CO2+H2O=H2SiO3↓+CO32- 0.5 mol
【解析】短周期A、F的化合价都是+4和-4,所以为第VIA元素,结合半径可得:A为C元素、F为Si元素;由B的半径和化合价可得:B为N元素;D单质制成的高压灯,发出的黄光透雾力强、射程远,所以D为Na元素;M的氢化物常温下呈液态,M的双原子阴离子有18个电子,所以M为O元素;G原子核外M层比L层少2个电子,所以G原子核内有16个质子,为S元素;E的+3价阳离子的核外电子排布与氖原子相同,所以E为Al元素。
(1)A为C元素,在元素周期表中的位置为:第二周期ⅣA族;B为N元素,B
的某种核素中子数比质子数多1,则表示该核素的原子符号为:。
(2)M为O元素,钙与氧原子个数比为1 : 2的化合物的电子式为:;既含离子键又含非极性键。
(3)M2-、D+、G2-离子分别为:O2-、Na+、S2-,S2-核外电子排布有3层,半径最大,O2-和Na+核外电子排布有2层,原子序数:Na>O,半径:O2->Na+,综上,O2-、Na+、S2-半径大小顺序是:S2->O2->Na+。
(4)用如图装置证明C、N、Si的非金属性强弱关系,是利用强酸制弱酸原理,通过比较碳酸、硝酸、硅酸的酸性强弱的方法达到目的,故①溶液a为硝酸、固体a为碳酸钠或碳酸钙、溶液b为饱和碳酸氢钠(除去挥发的硝酸),溶液c为硅酸钠;②溶液c中的离子方程式为:SiO32-+CO2+H2O=H2SiO3↓+CO32-。
(5)将Na2O2投入AlCl3溶液中,Na2O2与水发生氧化还原反应:2Na2O2+2H2O=4NaOH+O2↑,Na2O2既是氧化剂又是还原剂,0.5molNa2O2反应转移0.5 mol电子。
点睛:本题考查原子结构与元素周期律的关系,非金属元素在元素周期表中的位置及其性质的递变规律,氧化还原反应电子转移等,题目难度不大,注意掌握“位、构、性”三者关系。第(5)小题注意电子转移情况:。
23. 第3周期第ⅦA族 2SO2+O22SO3 3Cu+2NO+8H+===3Cu2++2NO↑+4H 2O 4HClO42Cl2↑+7O2↑+2H2O 溶液变浑浊 6.72
【解析】因为X、Y、Z、W四种短周期元素,由元素在周期表的位置关系可知,X、Y处于第二周期,Z、W处于第三周期。
Ⅰ.若Z元素原子的最外层电子数是电子层数的2倍,则Z最外层电子数为6,故Z为硫元素,由元素在周期表中的相对位置可知,X为氮元素、Y为氧元素、W为Cl元素;(1)W为Cl元素,原子核外电子数为3,有3个电子层,最外层电子数为7,故处于周期表第三周期ⅦA族。
(2)氧元素与硫元素组成的化合物为:SO2、SO3,相互转化的化学方程式为:2SO2+O22SO3。
(3)铜与稀硝酸反应生成硝酸铜、NO与水,反应离子方程式为:3Cu+2NO3-+8H+ = 3Cu2+ + 2NO↑+4H2O。
(4)高氯酸浓溶液不稳定,受热分解,产生黄绿色气体为氯气,根据电子转移守恒可知,氧元素被氧化生成氧气,由氢元素守恒,还有水生成,当有28mol电子转移时,n(Cl2)==2mol,生成氧气为9mol-2mol=7mol,故反应方程式为:4HClO42Cl2↑+7O2↑+2H2O。
Ⅱ.若Y和Z的核外电子数之和为22,设Y的核外电子数为y,则Z的核外电子数为y+8,则y+y+8=22,解得y=7,故Y为N元素、Z为P元素,则X为C元素、W为S元素。
(1)N与H以原子比1∶2形成的物质是N2H4,电子式为。
(2)碳酸的酸性比苯酚强,反应生成苯酚,通常条件下苯酚溶解性较小,故溶液变浑浊。
(3)碳与浓硫酸反应生成二氧化碳、二氧化硫和水,当转移0.4mol电子时,n(SO2)==0.2mol、n(CO2)==0.1mol,故标准状况下产生气体的体积为(0.2mol+0.1mol)×22.4L/mol=6.72L。
点睛:元素周期表、周期律相关推断题,首先根据已知信息推出相关元素,然后根据元素化合物的性质及相关离子反应、氧化还原反应等知识解题。该类题目综合性较强,注重考查学生分析解决问题的能力,往往难度加大,注意熟练掌握基础知识。
24. NaN3 CuO+2NaN3Cu+Na2O+3N2 3Cu+8H++2NO3- =3Cu2-+2NO↑+4H2O
【解析】C是空气中含量最多的单质,则C是N2;D是白色粉末且焰色反应呈黄色,则D中含有Na元素;E是一种紫红色金属,则E是Cu;结合转化关系图,结合其他已知条件可得:A是CuO、B是叠氮化钠、D是Na2O、E是Cu、G是NO、H是NO2、I是H2O、J是HNO3、K是NaOH、L是Cu(NO3)2。
(1)叠氮化钠的化学式为NaN3;
(2)NaOH的电子式为;
(3)反应①为叠氮化钠和CuO受撞击反应生成N2、Na2O和Cu,故化学方程式为
:CuO+2NaN3Cu+Na2O+3N2;
(4)反应②为Cu和稀硝酸的反应,离子方程式为:3Cu+8H++2NO3- =3Cu2-+2NO↑+4H2O。
点睛:无机框图推断题,既能检查学生元素化合物基础知识的掌握情况,又能检查学生灵活应用知识的能力,更能考查学生的逻辑推理能力,难度较大。解答无机框图推断题,应认真分析题干,找出明显条件和隐蔽条件。通过已知条件找出突破口,正推法、逆推法、假设法、猜测法等得出结论。
25.(共11分)(1)Ca+2H2O=Ca(OH)2+ H2↑,NaH+H2O=NaOH+ H2↑
C
O
O
(2)CaCO3 Ca2+[]2- (3)Na2CO3 NaHCO3
(4)将CaCO3与盐酸反应转化为CaCl2,然后电解熔融状态的CaCl2固体就制得单质Ca。
【解析】
试题分析:(1)A是自然界存在最广泛的ⅡA族元素,根据化学常识判断A是Ca元素,而Ca常以碳酸钙形式存在,所以F是碳酸钙。则Ca与水反应生成氢氧化钙与氢气,所以C是氢氧化钙,B是氢气,氢氧化钙与二氧化碳反应生成碳酸钙,则D是二氧化碳,碳酸钙高温分解生成氧化钙和二氧化碳,所以G是CaO,氢气与Na反应生成E是NaH,NaH与水反应生成NaOH和氢气,所以H是NaOH。则A与水反应的化学方程式为Ca+2H2O=Ca(OH)2+ H2↑,E与水反应的化学方程式为NaH+H2O=NaOH+ H2↑;
(2)F的化学式是CaCO3,G是CaO属于离子化合物,电子式为Ca2+[ ]2- , D是二氧化碳,属于共价化合物,电子式为;
(3)二氧化碳与氢氧化钠反应生成的盐有Na2CO3 NaHCO3
(4)F是碳酸钙,A是钙单质,活泼金属单质的制取常用电解法。由碳酸钙制取钙需要将CaCO3与盐酸反应转化为CaCl2,然后电解熔融状态的CaCl2固体就制得单质Ca。
考点:考查元素的判断,元素及其化合物的性质的应用,金属的制备
26.20个原子的质量=·=(1×10-7cm)3×5g·cm-3=5×10-21g,则该元素原子的摩尔质量=5×10-21g×=150g·mol-1。所以该元素的近似相对原子质量为150。
【解析】求元素的相对原子质量,应先求出该元素原子的摩尔质量,二者数值相等。据题意若可求出20个原子的质量,则可计算出(取值为6.02×1023)个原子的质量,即1mol原子的质量。
点评:解题过程中学会应用以前学过的知识如=·和新知识摩尔质量、质量、阿伏加德罗常数之间的联系。由=和=可得==·,此种推导方法常应用在解题当中。
27.
【解析】略
28. NaOH+HClO4==Na ClO4 +H2O OH-+HF==F-+H2O
【解析】有A、B、C、D、E、F六种短周期的主族元素,原子序数依次增大,B元素位于元素周期表中的第二周期,且原子最外层电子数占核外电子总数的3/4,(2+x)×3/4=x,x=6,为O元素;其中A、D元素的原子最外层均只有一个电子,且A和D可形成离子化合物;A为氢D为Na,C、F同主族,C的原子序数介于氧和Na之间,则为F元素,F为Cl;F元素原子最外电子层比同周期E元素原子的最外电子层多5个电子,则E最外层电子数为2,故E为Mg。
(1)D、F两元素最高价氧化物的水化物之间,NaOH和HClO4之间发生中和反应,化学方程式是NaOH+HClO4==Na ClO4 +H2O ;(2)D的氢氧化物NaOH和C的氢化物HF在水溶液中反应的离子方程式为 OH-+HF==F-+ H2O ;(3)Mg(OH)2 的电子式是,水的电子式。
29. nCH2=C(CH3)COOCH2CH2OH CH2=C(CH3)COOH+HOCH2CH2OHCH2=C(CH3)COOCH2CH2OH+H2O CH2=CH2+Br2→CH2Br-CH2Br、CH2Br-CH2Br+2NaOHHOCH2CH2OH+2NaBr
【解析】
试题分析:(1)含有碳碳双键,发生加聚反应生成高分子化合物,其反应方程式为nCH2=C(CH3)COOCH2CH2OH;(2)此产物是甲基丙烯酸和乙二醇发生酯化反应得到的,CH2=C(CH3)COOH+HOCH2CH2OHCH2=C(CH3)COOCH2CH2OH+H2O;(3)乙烯制备乙二醇,引入两个羟基,是由乙烯先生成两个卤代烃原子,然后卤代烃原子在碱性条件下发生水解,因此合成路线是CH2=CH2+Br2→CH2BrCH2Br,CH2BrCH2Br+2OH-HOCH2CH2OH+2Br-。
考点:考查有机合成、官能团的性质等知识。
30.(10分)(1)
(2)
(3)
(4)
(5)
【解析】
试题解析: 苯酚与过量的浓溴水反应发生环上的2,4,位取代,三溴苯酚白色沉淀;
(2)丙烯发生加聚反应生成聚丙烯:
(3)乙醇和浓硫酸混合加热170℃发生消去反应生成乙烯:
(4)用甲苯和浓硝酸浓硫酸水浴加热发生2,4,6位取代生成三硝基甲苯即TNT:
(5)2—丙醇与氧气在催化剂作用下,羟基被氧化为酮羰基,
考点: 考察有机反应的方程式的书写;
31. ⑤⑧ ③⑨⑪ ④⑩ ②⑫
【解析】试题分析:(1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素形成非极性共价键、不同种非金属元素之间形成极性共价键;
(2)Na2S2中Na原子和S原子之间存在离子键、S原子和S原子之间存在非极性键;硫化铵中铵根离子和硫离子之间存在离子键、N原子和H原子之间存在共价键;
(3)BCl3中B、Cl通过共价键结合,次氯酸分子中O原子和H原子、Cl原子之间都存在一对共用电子对,;
(4)MgCl2形成过程中,镁失电子形成镁离子、氯原子得电子形成氯离子,镁离子、氯离子通过离子键形成氯化镁;
解析:(1)活泼金属和活泼非金属元素之间易形成离子键,只含有离子键的是⑤MgCl2、 ⑧CaF2;(2)不同种非金属元素之间易形成极性共价键,活泼金属和活泼非金属元素之间易形成离子键,由离子键和极性键构成的是③Ba(OH)2 ⑨NH4Cl、Ca(ClO)2;(3) 活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性共价键,由离子键和非极性键构成的是含有共价键的共价化合物是④Na2O2 、 ⑩CaO2;(4) 同种非金属元素形成非极性共价键、不同种非金属元素之间形成极性共价键,由极性键和非极性键构成的是②H2O2、N2H4;(5) Na2S2中Na原子和S原子之间存在离子键、S原子和S原子之间存在非极性键,Na2S2的电子式 ;硫化铵中铵根离子和硫离子之间存在离子键、N原子和H原子之间存在共价键,(NH4)2S的电子式
(6) BCl3中B原子通过3个共价键与3个Cl原子结合, BCl3的结构式
次氯酸分子中O原子和H原子、Cl原子之间都存在一对共用电子对,HClO的结构式为;
(7) MgCl2形成过程中,镁失电子形成镁离子、氯原子得电子形成氯离子,镁离子、氯离子通过离子键形成氯化镁,形成过程表示为
点睛:一般非金属原子在形成阴离子时,得到电子,使最外层达到稳定结构,这些电子都应画出,并将符号用“[]”括上,右上角标出所带的电荷数;共价化合物是原子间通过共用电子对结合而成的。书写时将共用电子对画在两原子之间,每个原子的未成对电子和孤对电子也应画出。
32.
(1)锥形瓶中溶液颜色的变化 溶液红色褪去,且半分钟内颜色不恢复.
(2)酚酞本身也参与反应 (3)0.1288 (4) ②③ ①④
【解析】