- 133.00 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
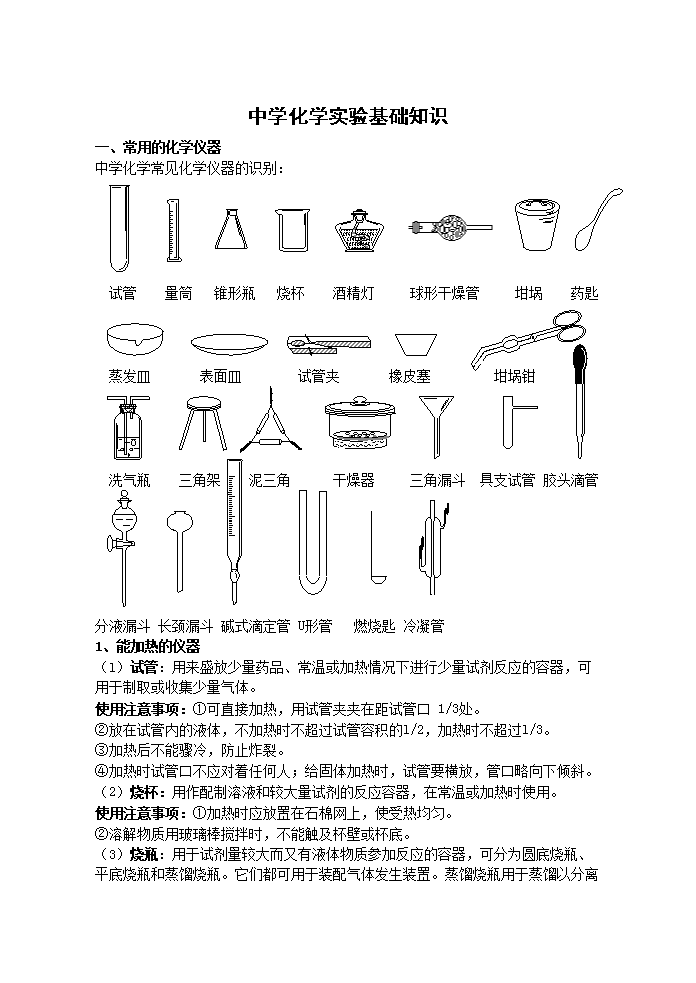
中学化学实验基础知识
一、常用的化学仪器
中学化学常见化学仪器的识别:
试管 量筒 锥形瓶 烧杯 酒精灯 球形干燥管 坩埚 药匙
蒸发皿 表面皿 试管夹 橡皮塞 坩埚钳
洗气瓶 三角架 泥三角 干燥器 三角漏斗 具支试管 胶头滴管
分液漏斗 长颈漏斗 碱式滴定管 U形管 燃烧匙 冷凝管
1、能加热的仪器
(l)试管:用来盛放少量药品、常温或加热情况下进行少量试剂反应的容器,可用于制取或收集少量气体。
使用注意事项:①可直接加热,用试管夹夹在距试管口 1/3处。
②放在试管内的液体,不加热时不超过试管容积的l/2,加热时不超过l/3。
③加热后不能骤冷,防止炸裂。
④加热时试管口不应对着任何人;给固体加热时,试管要横放,管口略向下倾斜。
(2)烧杯:用作配制溶液和较大量试剂的反应容器,在常温或加热时使用。
使用注意事项:①加热时应放置在石棉网上,使受热均匀。
②溶解物质用玻璃棒搅拌时,不能触及杯壁或杯底。
(3)烧瓶
:用于试剂量较大而又有液体物质参加反应的容器,可分为圆底烧瓶、平底烧瓶和蒸馏烧瓶。它们都可用于装配气体发生装置。蒸馏烧瓶用于蒸馏以分离互溶的沸点不同的物质。
使用注意事项:①圆底烧瓶和蒸馏烧瓶可用于加热,加热时要垫石棉网,也可用于其他热浴(如水浴加热等)。
②液体加入量不要超过烧瓶容积的1/2。
(4)蒸发皿:用于蒸发液体或浓缩溶液。
使用注意事项:①可直接加热,但不能骤冷。
②盛液量不应超过蒸发皿容积的2/3。
③取、放蒸发皿应使用坩埚钳。
(5)坩埚:主要用于固体物质的高温灼烧。
使用注意事项:①把坩埚放在三脚架上的泥三角上直接加热。
②取、放坩埚时应用坩埚钳。
(6)酒精灯 化学实验时常用的加热热源。
使用注意事项:①酒精灯的灯芯要平整。
②添加酒精时,不超过酒精灯容积的2/3;酒精不少于l/4。
③绝对禁止向燃着的酒精灯里添加酒精,以免失火。
④绝对禁止用酒精灯引燃另一只酒精灯。
⑤用完酒精灯,必须用灯帽盖灭,不可用嘴去吹。
⑥不要碰倒酒精灯,万一洒出的酒精在桌上燃烧起来,应立即用湿布扑盖。
2.分离物质的仪器
(1)漏斗:分普通漏斗、长颈漏斗、分液漏斗。普通漏斗用于过滤或向小口容器转移液体。长颈漏斗用于气体发生装置中注入液体。分液漏斗用于分离密度不同且互不相溶的不同液体,也可用于向反应器中随时加液。也用于萃取分离。
(2)洗气瓶:中学一般用广口瓶、锥形瓶或大试管装配。洗气瓶内盛放的液体,用以洗涤气体,除去其中的水分或其他气体杂质。使用时要注意气体的流向,一般为“长进短出”。
(3)干燥管:干燥管内盛放的固体,用以洗涤气体,除去其中的水分或其他气体杂质,也可以使用U型管。
3.计量仪器
(l)托盘天平:用于精密度要求不高的称量,能称准到0.1g。所附砝码是天平上称量时衡定物质质量的标准。
使用注意事项:①称量前天平要放平稳,游码放在刻度尺的零处,调节天平左、右的平衡螺母,使天平平衡。
②称量时把称量物放在左盘,砝码放在右盘。砝码要用镊子夹取,先加质量大的砝码,再加质量小的砝码。
③称量干燥的固体药品应放在在纸上称量。
④易潮解、有腐蚀性的药品(如氢氧化钠),必须放在玻璃器皿里称量。
⑤称量完毕后,应把砝码放回砝码盒中,把游码移回零处。
(2)量筒:用来量度液体体积,精确度不高。
使用注意事项:①不能加热和量取热的液体,不能作反应容器,不能在量筒里稀释溶液。
②量液时,量简必须放平,视线要跟量简内液体的凹液面的最低处保持水平,再读出液体体积。
(3)容量瓶:用于准确配制一定体积和一定浓度的溶液。使用前检查它是否漏水。用玻璃棒引流的方法将溶液转入容量瓶。
使用注意事项:①只能配制容量瓶上规定容积的溶液。
②容量瓶容积是在20℃时标定的,转移到瓶中的溶液的温度应在20℃左右。
(4)滴定管:用于准确量取一定体积液体的仪器。带玻璃活塞的滴定管为酸式滴定管,带有内装玻璃球的橡皮管的滴定管为碱式滴定管。
使用注意事项:①酸式、碱式滴定管不能混用。
②25mL、50mL滴定管的估计读数为±0.01mL。
③装液前要用洗液、水依次冲洗干净,并要用待装的溶液润洗滴定管。
④调整液面时,应使滴管的尖嘴部分充满溶液,使液面保持在“0’或“0”以下的某一定刻度。读数时视线与管内液面的最凹点保持水平。
(5)量气装置:可用广口瓶与量筒组装而成。如图所示。排到量筒中水的体积,即是该温度、压强下所产生的气体的体积。适用于测量难溶于水的气体体积。
4.物质储存仪器
(1)储存气体:集气瓶、储气瓶;
(2)储存固体:广口试剂瓶,分为无色玻璃瓶和棕色玻璃瓶、磨砂玻璃塞和丝扣塑料塞瓶、塑料瓶;
(3)储存液体:细口试剂瓶,又分为无色和棕色试剂瓶、滴瓶。
5.其它仪器
铁架台 、坩埚钳、燃烧匙、药勺、玻璃棒、温度计、冷凝管、表面皿、集气瓶、广口瓶、细口瓶、滴瓶、滴管、水槽、研钵、试管架、三角架、干燥器
6.化学仪器上的“0”刻度。
(1)滴定管:“0”刻度在上面。(2)量筒:无“0”刻度。
(3)托盘天平:“0”刻度在刻度尺最左边;标尺中央是一道竖线非零刻度。
(4)容量瓶、移液管等只有一个标示溶液的刻度,不是零刻度。
7.几处使用温度计的实验:
(1)实验室制乙烯:温度170℃,温度计在反应液面下,测反应液温度。
(2)实验室蒸馏石油:温度计水银球插在蒸馏瓶支管口略下部位测蒸气的温度。
(3)苯的硝化实验:水银球插在水溶液中,控制温度50~60℃。
(4)KNO3溶解度的实验:水银球插在KNO3溶液水浴中,使测得温度更加精确。
二、化学实验基本操作
1、仪器的洗涤
玻璃仪器洗净的标准是:内壁上附着的水膜均匀,既不聚成水滴,也不成股流下。若附着不易用水洗涤的物质时,应选不同的“洗涤剂”区别对待。
若用水、洗涤剂等方法仍刷洗不掉,我们可采用特殊洗涤法:
(1)油脂、苯酚、乙酸乙酯:溶液
(2)、、:稀盐酸
(3)、酚醛树脂、苯酚:乙醇 (4)镜:稀
2、药品的取用和保存
(1)实验室里所用的药品,不能用手接触药品,不要把鼻孔凑到容器口去闻药品的气味,不得尝任何药品的味道。注意节约药品,如果没有说明用量,一般应按最少量取用:液体l-2mL,固体只需要盖满试管底部。
(2)固体药品的取用
粉末:药匙或纸槽,一横、二送、三直立
块状:镊子,一横、二放、三慢竖
(3)液体药品的取用
倾倒:塞倒放、签向手心、紧挨瓶口、缓慢倒入
滴加:滴管直立、正上方滴加
(4)几种特殊试剂的存放
(A)钾、钙、钠在空气中极易氧化,遇水发生剧烈反应,应放在盛有煤油的广口瓶中以隔绝空气。
(B)白磷着火点低,在空气中能缓慢氧化而自燃,通常保存在冷水中。
(C)液溴有毒且易挥发,需盛放在磨口的细口瓶里,并加些水(水覆盖在液溴上面),起水封作用。
(D)碘易升华且具有强烈刺激性气味,盛放在磨口的广口瓶里。
(E)浓硝酸、硝酸银见光易分解,应保存在棕色瓶中,贮放在黑暗而且温度低的地方。
(F)氢氧化钠固体易潮解,应盛放在易于密封的干燥大口瓶中保存;其溶液盛放在无色细口瓶里,瓶口用橡皮塞塞紧,不能用玻璃塞。
3、试纸的使用
试纸的种类很多。常用的有红色石蕊试纸、蓝色石蕊试纸、PH试纸、淀粉碘化钾试纸和品红试纸等。
(l)在使用试纸检验溶液的性质时,一般先把一小块试纸放在表面皿或玻璃片上,用沾有待测溶液的玻璃棒点试纸的中部,观察颜色的变化,判断溶液的性质。]
(2)在使用试纸检验气体的性质时,一般先用蒸馏水把试纸润湿。粘在玻璃棒的一端,用玻璃棒把试纸放到盛有待测气体的试管口(注意不要接触),观察试纸的颜色变化情况来判断气体的性质。
注意:使用PH试纸不能用蒸馏水润湿。
4、溶液的配制
(l)配制溶质质量分数一定的溶液
计算:算出所需溶质和水的质量。把水的质量换算成体积。如溶质是液体时,要算出液体的体积。
称量:用天平称取固体溶质的质量;用量简量取所需液体、水的体积。
溶解:将固体或液体溶质倒入烧杯里,加入所需的水,用玻璃棒搅拌使溶质完全溶解.
(2)配制一定物质的量浓度的溶液
计算:算出固体溶质的质量或液体溶质的体积。
称量:用托盘天平称取固体溶质质量,用量简量取所需液体溶质的体积。
溶解:将固体或液体溶质倒入烧杯中,加入适量的蒸馏水(约为所配溶液体积的1/6),用玻璃棒搅拌使之溶解,冷却到室温后,将溶液引流注入容量瓶里。洗涤(转移):用适量蒸馏水将烧杯及玻璃棒洗涤2-3次,将洗涤液注入容量瓶。振荡,使溶液混合均匀。
定容:继续往容量瓶中小心地加水,直到液面接近刻度2-3m处,改用胶头滴管加水,使溶液凹面恰好与刻度相切。把容量瓶盖紧,再振荡摇匀。
5.加热
加热前:擦干容器外壁的水
加热时:用外焰加热、先均匀受热、再固定部位加热
加热方式:直接加热、垫石棉网加热、浴热(水浴、油浴、沙浴等)
6.物质的溶解
固体:用烧杯、试管溶解,振荡、搅拌、粉碎、升温可加快溶解,但FeCl3、AlCl3等固体溶解不能加热。
液体:注意浓硫酸的稀释
气体:溶解度不大的气体,应将导管直接插入水中
易溶于水的气体,要防倒吸
7.装置气密性检查
原理:利用气体热胀冷缩的物理性质
方法:微热法:适用于简单装置
液差法:适用于启普发生器及其简易装置
酒精灯局部加热法:适用于整套装置的气密性检查
8.蒸馏 蒸馏是提纯或分离沸点不同的液体混合物的方法。用蒸馏原理进行多种混合液体的分离,叫分馏。
操作时要注意:
①在蒸馏烧瓶中放少量碎瓷片,防止液体暴沸。
②温度计水银球的位置应与支管底口下缘位于同一水平线上。
③蒸馏烧瓶中所盛放液体不能超过其容积的2/3,也不能少于l/3。
④冷凝管中冷却水从下口进,从上口出。
⑤加热温度不能超过混合物中沸点最高物质的沸点,例如用分馏的方法进行石油的分馏。
9.过滤 过滤是除去溶液里混有不溶于溶剂的杂质的方法。
过滤时应注意:
①一贴:将滤纸折叠好放入漏斗,加少量蒸馏水润湿,使滤纸紧贴漏斗内壁。
②二低:滤纸边缘应略低于漏斗边缘,加入漏斗中液体的液面应略低于滤纸的边缘。
③三靠:向漏斗中倾倒液体时,烧杯的夹嘴应与玻璃棒接触;玻璃棒的底端应和过滤器有三层滤纸处轻轻接触;漏斗颈的末端应与接受器的内壁相接触,例如用过滤法除去粗食盐中少量的泥沙。
10.蒸发和结晶 蒸发是将溶液浓缩、溶剂气化或溶质以晶体析出的方法。结晶是溶质从溶液中析出晶体的过程,可以用来分离和提纯几种可溶性固体的混合物。结晶的原理是根据混合物中各成分在某种溶剂里的溶解度的不同,通过蒸发减少溶剂或降低温度使溶解度变小,从而使晶体析出。加热蒸发皿使溶液蒸发时、要用玻璃棒不断搅动溶液,防止由于局部温度过高,造成液滴飞溅。当蒸发皿中出现较多的固体时,即停止加热,例如用结晶的方法分离NaCl和KNO3混合物。
11.分液 分液是把两种互不相溶、密度也不相同的液体分离的方法。将分液漏斗静置,待液体分层后进行分液,分液时下层液体从漏斗口放出,上层液体从上口倒出。
12.升华 升华是指固态物质吸热后不经过液态直接变成气态的过程。利用某些物质具有升华的特性,将这种物质和其它受热不升华的物质分离开来,例如加热使碘升华,来分离I2和SiO2的混合物。
13.渗析 利用半透膜(如膀胱膜、羊皮纸、玻璃纸等),使胶体跟混在其中的分子、离子分离的方法。常用渗析的方法来提纯、精制胶体溶液。
14.实验安全操作
(1)防爆炸:点燃可燃气体要验纯
(2)防暴沸:稀释浓硫酸,加热液体混合物要加沸石(碎瓷片)
(3)防中毒:制取有毒气体,要在通风橱中操作,要注意尾气的处理(灼烧式、吸收式、收集式)
(4)防倒吸:
(5)防堵塞:
(6)意外事故的处理
金属钠、钾起火
用湿抹布盖灭
酒精灯不慎碰倒起火
用湿抹布盖灭
浓碱沾到皮肤上
用大量水冲洗,再涂硼酸溶液
浓硫酸沾到皮肤上
先用抹布抹去,再用大量水冲洗
液溴、苯酚沾到皮肤上
用酒精擦洗
不慎将酸沾到眼中
用大量水冲洗,边洗边眨眼睛
重金属盐中毒
喝大量豆浆、牛奶,并及时送医院
水银洒在桌面上
用硫粉覆盖,或用胶头滴管吸回试剂瓶