- 755.00 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2013年高考化学试题汇编:化学实验设计 评价(一)
编审:郁俊峰 2013-12-6
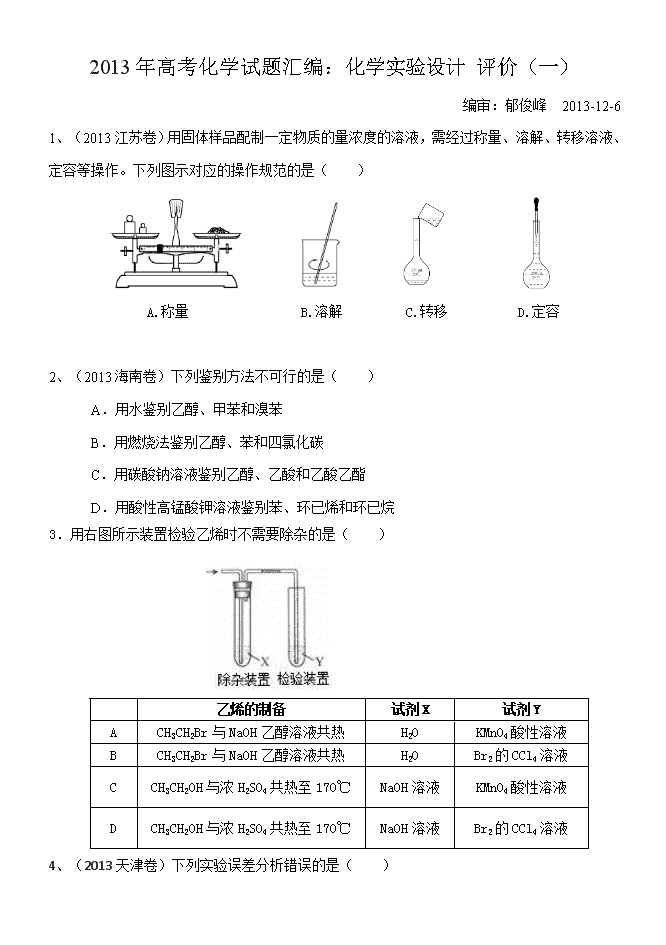
1、(2013江苏卷)用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、
定容等操作。下列图示对应的操作规范的是( )
A.称量 B.溶解 C.转移 D.定容
2、(2013海南卷)下列鉴别方法不可行的是( )
A.用水鉴别乙醇、甲苯和溴苯
B.用燃烧法鉴别乙醇、苯和四氯化碳
C.用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
D.用酸性高锰酸钾溶液鉴别苯、环已烯和环已烷
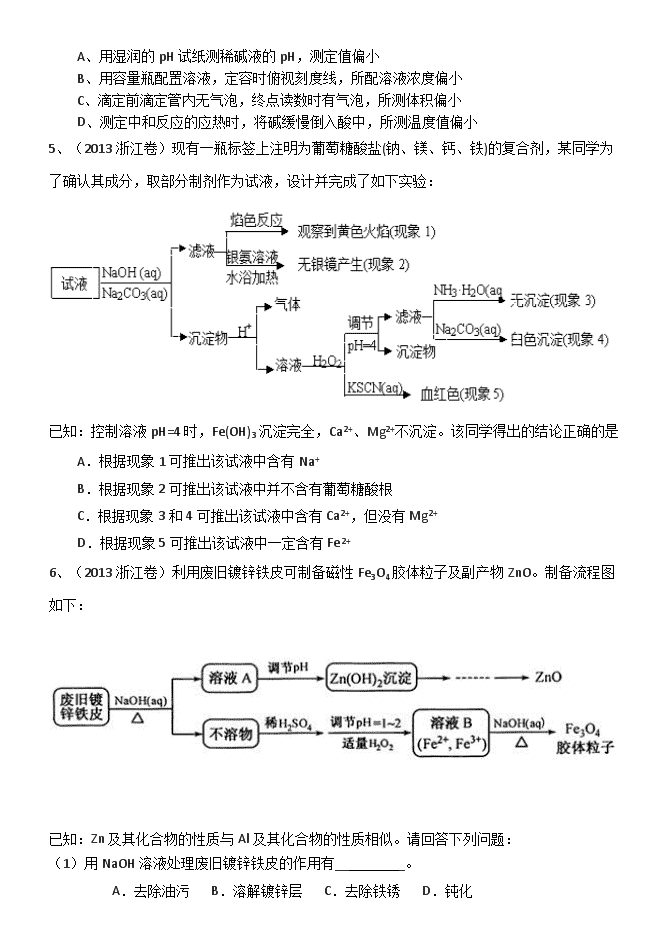
3.用右图所示装置检验乙烯时不需要除杂的是( )
乙烯的制备 试剂 X 试剂 Y
A CH3CH2Br 与 NaOH 乙醇溶液共热 H2O KMnO4酸性溶液
B CH3CH2Br 与 NaOH 乙醇溶液共热 H2O Br2的 CCl4溶液
C CH3CH2OH 与浓 H2SO4共热至 170℃ NaOH 溶液 KMnO4酸性溶液
D CH3CH2OH 与浓 H2SO4共热至 170℃ NaOH 溶液 Br2的 CCl4溶液
4、(2013 天津卷)下列实验误差分析错误的是( )
A、用湿润的 pH 试纸测稀碱液的 pH,测定值偏小
B、用容量瓶配置溶液,定容时俯视刻度线,所配溶液浓度偏小
C、滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D、测定中和反应的应热时,将碱缓慢倒入酸中,所测温度值偏小
5、(2013 浙江卷)现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合剂,某同学为
了确认其成分,取部分制剂作为试液,设计并完成了如下实验:
已知:控制溶液 pH=4 时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。该同学得出的结论正确的是
A.根据现象 1 可推出该试液中含有 Na+
B.根据现象 2 可推出该试液中并不含有葡萄糖酸根
C.根据现象 3 和 4 可推出该试液中含有 Ca2+,但没有 Mg2+
D.根据现象 5 可推出该试液中一定含有 Fe2+
6、(2013 浙江卷)利用废旧镀锌铁皮可制备磁性 Fe3O4胶体粒子及副产物 ZnO。制备流程图
如下:
已知:Zn及其化合物的性质与 Al 及其化合物的性质相似。请回答下列问题:
(1)用 NaOH 溶液处理废旧镀锌铁皮的作用有__ _。
A.去除油污 B.溶解镀锌层 C.去除铁锈 D.钝化
(2)调节溶液 A 的 pH 可产生 Zn(OH)2沉淀,为制得 ZnO,后续操作步骤是___________。
(3)由溶液 B 制得 Fe3O4胶体粒子的过程中,须持续通 N2,其原因是_______________。
(4)Fe3O4胶体粒子能否用减压过滤法实现固液分离?___ __(填“能”或“不能”),
理由是_________ ______。
(5)用重铬酸钾法(一种氧化还原滴定法)可测得产物 Fe3O4中二价铁含量。若需配制浓度为
0.01000 mol/L的 K2Cr2O7的标准溶液 250 mL,应准确称取______g K2Cr2O7 (保留 4 位有效数字,
已知 MK2Cr2O7==294.0 g/mol)。配制该标准溶液时,下列仪器不必要用到的有___ __
(用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
(6)滴定操作中,如果滴定前装有 K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后
气泡消失,则测定结果将_______(填“偏大”、“偏小”或“不变”)。
7、(2013 全国新课标卷 2)(15 分)正丁醛是一种化工原料。某实验小组利用如下装置合成
正丁醛。
发生的反应如下:
CH3CH2CH2CH2OH CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ 密度/(g·cm-3) 水中溶解性
正丁醇 11.72 0.8109 微溶
正丁醛 75.7 0.8017 微溶
实验步骤如下:
将 6.0gNa2Cr2O7放入 100mL 烧杯中,加 30mL 水溶解,再缓慢加入 5mL 浓硫酸,将所得溶
液小心转移至 B 中。在 A 中加入 4.0g 正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加 B
中溶液。滴加过程中保持反应温度为 90~95℃,在 E 中收集 90℃以下的馏分。将馏出物倒入
分液漏斗中,分去水层,有机层干燥后蒸馏,收集 75~77℃馏分,产量 2.0g。
回答下列问题:
Na2Cr2O7
H2SO4加热
(1)实验中,能否将 Na2Cr2O7溶液加到浓硫酸中,说明理由
。
(2)加入沸石的作用是 。
若加热后发现未加沸石,应采取的正确方法是 。
(3)上述装置图中,B 仪器的名称是 ,D仪器的名称是 。
(4)分液漏斗使用前必须进行的操作是 (填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在 层(填“上”或“下”)。
(6)反应温度应保持在 90~95℃,其原因是 。
(7)本实验中,正丁醛的产率为 %。
8 、 [2013 高考·重庆卷·9](15 分)某研究小组利用下图装置探究温度对 CO 还原 Fe2O3的影响(固
定装置略)
(1)MgCO3的分解产物为 。
(2)装置 C 的作用是 ,处理尾气的方法为 。
(3)将研究小组分为两组,按题中图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装
置 D 加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
步骤 操作 甲组现象 乙组现象
1 取黑色粉末加入盐酸 溶解,无气泡 溶解,有气泡
2 取步骤 1 中溶液,滴加 K3[Fe(CN)6]溶液 蓝色沉淀 蓝色沉淀
3 取步骤 1 中溶液,滴加 KSCN 溶液 变红 无现象
4 取步骤 3 溶液中滴加新制氯水 红色褪去 先变红,后褪色
①乙组得到的黑色粉末是 。
②甲组步骤 1 中反应的离子方程式为 。
③乙组步骤 4 中,溶液变红的原因为 ,溶液褪色可能的原因及其验证方
法为 。
④从实验安全考虑,题 9 图装置可采取的改进措施是 。
9.(9 分)BaCl2·xH2O中结晶水数目可通过重量法来确定:
①称取 1.222g 样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀
完全,静置;
②过滤并洗涤沉淀;
③将盛有沉淀的滤纸包烘干并中温灼烧;转入高温炉中,反复灼烧到恒重,称得沉淀质量为
1.165g。
回答下列问题:
足量 NaOH 溶液
MgCO3 Zn 粉
无水 CaCl2
Fe2O3
澄清石灰水
A B
C
D
E F
(1)在操作②中,需要先后用稀硫酸和 洗涤沉淀;检验沉淀中氯离子是否洗净
的方法是 。
(2)计算 BaCl2·xH2O 中的 x= (要求写出计算过程)。
(3)操作③中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为 BaS,这
使 x 的测定结果 (填“偏低”、“偏高”或“不变”)。
10、(2013 北京卷)(15 分)某学生对 SO2与漂粉精的反应进行实验探究:
操作 现象
取 4g 漂粉精固体,加入 100mL 水 部分固体溶解,溶液略有颜色
过滤,测漂粉精溶液的 pH pH 试纸先变蓝(约为 12),后褪色
ⅰ.液面上方出现白雾;
ⅱ.稍后,出现浑浊,溶液变为黄绿色;
ⅲ.稍后,产生大量白色沉淀,黄绿色褪去
(1)Cl2和 Ca(OH)2制取漂粉精的化学方程是 。
(2)pH 试纸颜色的变化说明漂粉精溶液具有的性质是 。
(3)向水中持续通入 SO2,未观察到白雾。推测现象 i 的白雾由 HCl 小液滴形成,进行如下实
验: a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的 AgNO3溶液检验白雾,产生白色沉淀。
① 实验 a目的是 。
②由实验 a、b 不能判断白雾中含有 HC1,理由是 。
(4)现象 ii 中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和 C1-发生
反应。通过进一步实验确认了这种可能性,其实验方案是
。
(5)将 A 瓶中混合物过滤、洗涤,得到沉淀 X。
①向沉淀 X 中加入稀 HC1,无明显变化。取上层清液,加入 BaC12溶液,产生白色沉淀。则
沉淀 X 中含有的物质是 。
②用离子方程式解释现象 iii 中黄绿色褪去的原因:
。
11、(2013 天津卷)FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产
流程制备无水 FeCl3,再用副产品 FeCl3溶液吸收有毒的 H2S。
I.经查阅资料得知:无水 FeCl3在空气中易潮解,加热易升华。他们设计了制备无水 FeCl3的实
验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
Cl2→
铁屑
冷水
收集器
无水 CaCl2
FeCl2溶液
A
B
C
D E
①检查装置的气密性;
②通入干燥的 Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成
④……
⑤体系冷却后,停止通入 Cl2,并用干燥的 N2赶尽 Cl2,将收集器密封
请回答下列问题:
(1)装置 A 中反应的化学方程式为_____________________________________。
(2)第③步加热后,生成的烟状 FeCl3大部分进入收集器,少量沉积在反应管 A 的右端。要使
沉积得 FeCl3进入收集器,第④步操作是____________________________________________。
(3)操作步骤中,为防止 FeCl3潮解所采取的措施有(填步骤序号)________________________。
(4)装置 B 中的冷水浴的作用为__________________;装置 C 的名称为______ __________;
装置 D 中 FeCl2全部反应完后,因为失去吸收 Cl2的作用而失效,写出检验 FeCl2是否失效的试
剂:___ ________。
(5)在虚线框内画出尾气吸收装置 E 并注明试剂。
II.该组同学用装置 D 中的副产品 FeCl3溶液吸收 H2S,得到单质硫;过滤后,再以石墨为电极,
在一定条件下电解滤液。
(6) FeCl3与 H2S 反应的离子方程式为______________________________________________。
(7)电解池中 H+在阴极放电产生 H2,阳极的电极反应为_______________________________。
(8)综合分析实验 II 的两个反应,可知该实验有两个显著优点:
①H2S 的原子利用率 100%;②_______________________________________________。
12、(2013 全国新课标卷 1)醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验
装置如下:
可能用到的有关数据如下:
相对分子质量 密度 沸点 溶解性
环己醇 100 0.9618 161 微溶于水
环己烯 82 0.8102 83 难溶于水
合成反应:
在 a 中加入 20 g 环己醇和 2 小片碎瓷片,冷却搅动下慢慢加入 1 mL 浓硫酸。b 中通入冷
却水后,开始缓慢加热 a,控制馏出物的温度不超过 90 oC。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量 5% 碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗
粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯 10 g。
(1)装置 b 的名称是_______________
(2)加入碎瓷片的作用是____________;如果加热一段时间后发现忘记加瓷片,应该采取的
正确操作是____________(填正确答案标号)。
A.立即补加 B. 冷却后补加 C. 不需补加 D. 重新配料
(3)本实验中最容易产生的副产物的结构简式为_________________。
(4)分液漏斗在使用前必须清洗干净并________。在本实验分离过程中,产物应该从分液漏
斗的__________(填“上口倒出”或“下口倒出”)。
(5)分离提纯过程中加入无水氯化钙的目的是_________________。
(6)在环已烯粗产物蒸馏过程中,不可能用到的仪器有_________(填正确答案标号)。
A.圆底烧瓶 B. 温度计 C. 吸滤瓶 D. 环形冷凝管 E. 接收器
(7)本实验所得到的环己烯产率是_________(填正确答案标号)。
A. 41% B. 50% C. 61% D. 70%
13、(2013 山东卷)(15 分)TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白
色颜料。
(1)实验室利用反应 TiO2(s)+2CCl4(g)=TiCl4(g)+CO2(g),在无水无氧条件下,制取
TiCl4实验装置示意图如下
有关性质如下表
物质 熔点/℃ 沸点/℃ 其他
CCl4 -23 76 与 TiCl4互溶
TiCl4 -25 136 遇潮湿空气产生白雾
仪器 A 的名称是 ,装置 E中的试剂是 。反应开始前依次进行如
下操作:组装仪器、 、加装药品、通 N2、一段时间后点燃酒精灯.反应
结束后的操作包括:①停止通氮气②熄灭酒精灯③冷却至室温。正确的顺序为
(填序号)。欲分离 D 中的液态混合物,所采用操作的名称是 。
(2)工业上由钛铁矿(FeTiO3)(含 Fe2O3、SiO2等杂质)制备 TiO2的有关反应包括:
酸溶 FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+ TiOSO4(aq)+ 2H2O(l)
水解 TiOSO4(aq)+ 2H2O(l) H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:
①试剂 A 为 。钛液Ⅰ需冷却至 70℃左右,若温度过高会导致产品收率降低,原因
是 。
②取少量酸洗后的 H2TiO3,加入盐酸并振荡,滴加 KSCN 溶液后无明显现象,再加 H2O2后出现
微红色,说明 H2TiO3中存在的杂质离子是 。这种 H2TiO3即使用水充分洗涤,煅烧后获
得的 TiO2也会发黄,发黄的杂质是 (填化学式)。
2013年高考化学汇编:化学实验设计(一)(答案)
1、【答案】B【解析】本题属于基础实验与基本实验操作的考查范畴。内容源于《必修一》P16
物质的量浓度溶液的配制。A.托盘天平称量物品中的左物右码。现物品在右托盘,错。 B.搅
拌溶解,操作合理。C.引流要用玻璃棒,并伸至刻度线以下位置。 D.定容时不得将滴管伸入
容量瓶。
本题以常见气体制取、蒸干、除杂、萃取、分液为实验操作为素材,考查学生对实验操作的
熟悉程度和实验原理的应用能力,试图引导中学化学教学关注化学实验操作的真实性。
2、[答案]D [解析]:A、B、C均可鉴别:A 中,乙醇溶于水,甲苯比水密度小,溴苯比水密
度大;B中,乙醇、苯燃烧火焰有明显差别,而四氯化碳不燃烧;C 中,乙醇溶于碳酸钠,乙
酸与碳酸钠反应产生气泡,乙酸乙酯浮于溶液表面。
3、【答案】B 【解析】A、B 选项乙烯中的杂质为乙醇,乙醇可使 KMnO4褪色,故必须用水
除去。乙醇不能使 Br2的 CCl4溶液褪色,故不需出去。
C、D选项乙烯中杂质为乙醇、SO2和 CO2。其中乙醇、SO2均可使 KMnO4褪色,故用氢氧化钠
溶液除去;尽管乙醇不能使 Br2的 CCl4溶液褪色,但 SO2在有 H2O(g)存在的情况下能使 Br2
的 CCl4溶液褪色,故用氢氧化钠溶液除去。故 ACD 错误,B 正确。
4、答案:B 【解析】该题考查基本实验的误差分析。A 选项湿润的 pH 试纸测稀碱液的 pH
时,碱液被稀释,pH 值偏小,正确。B 选项用容量瓶配置溶液定容时俯视刻度线,所加水偏少,
所配溶液浓度偏大,错误。C 选项滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小,
也就是读数偏小,正确。D 选项测定中和反应的应热时,将碱缓慢倒入酸中,热量损失比较多,
所测温度值偏小,正确。
5、答案:C 【解析】A 选项:因加入了 NaOH (aq)和 Na2CO3(aq),在滤液中引入了 Na+,不能
根据滤液焰色反应的黄色火焰判断试液是否含 Na+。B 选项:试液是葡萄糖酸盐溶液,其中一
定含葡萄糖酸根,葡萄糖能发生银镜反应,葡萄糖酸根不能发生银镜反应。D 选项:溶液加入
H2O2,后再滴加 KSCN(aq)显血红色,不能证明葡萄糖酸盐试液中是否含 Fe2+。正确的方法是:
在溶液中滴加 KSCN(aq)不显血红色,再滴入滴加 H2O2显血红色,证明溶液中只含 Fe2+。若此前
各步均没有遇到氧化剂,则可说明葡萄糖酸盐试液中只含 Fe2+。C 选项:根据“控制溶液 pH=4
时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀”信息,在过滤除去 Fe(OH)3的滤液中分别加入NH3·H2O(aq)
和 Na2CO3(aq),加入 NH3·H2O(aq)不产生沉淀说明滤液中不含 Mg2+,加入 Na2CO3 (aq)产生白色
沉淀,说明滤液中含 Ca2+。
6、【解析】本题以“废旧镀锌铁皮可制备磁性 Fe3O4胶体粒子及副产物 ZnO”为载体,考查实
验基本操作和技能。涉及标准溶液的配制及滴定的误差分析。试题主要取材于《实验化学》模
块中《镀锌铁皮镀层厚度的测定》。试题难度不大。
【答案】(1)AB (2)抽滤、洗涤、灼烧 (3)N2气氛下防止 Fe2+被氧化
(4)不能 胶体粒子太小,抽滤时易透过滤纸
(5)0.7350 (0.01000 mol/L×0.250 L×294.0 g/mol) ③⑦ (6)偏大
7、解析:(1)不能将 Na2Cr2O7溶液加到浓硫酸中,应该将浓硫酸加到 Na2Cr2O7溶液,因为浓
硫酸溶于水会放出大量热,容易溅出伤人。
(2)沸石的作用是防止液体暴沸,若加热后发现未加沸石,应采取的正确方法冷却后补加,
以避免加热时继续反应而降低产率。
(3)B 仪器是分液漏斗,D仪器是直形冷凝管。(4)分液漏斗使用前必须检查是否漏水。
(5)因为正丁醛的密度是 0.8017 g·cm-3,比水轻,水层在下层。
(6)反应温度应保持在 90~95℃,根据正丁醛的沸点和还原性,主要是为了将正丁醛及时分
离出来,促使反应正向进行,并减少正丁醛进一步氧化。
(7)按反应关系,正丁醛的理论产量是:4.0g×72
74
=3.9g,实际产量是 2.0g,
产率为:
2.0
3.9
×100%=51.3%。
答案:(1)不能;易迸溅。(2)防止暴沸;冷却后补加。(3)分液漏斗;直形冷凝管。
(4)c(5)下(6)既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化。(7)51%
8、答案:(1)MgO、CO2 (2)除 CO2 点燃
(3)①Fe ②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe2+被氧化为 Fe3+,Fe3+遇 SCN-显红色;假设 SCN-被 Cl2氧化,向溶液中加入 KSCN 溶液,
若出现红色,则假设成立(其他合理答案均可得分) ④在装置 B C 之间添加装置 E 防倒吸
(其他合理答案均可得分)
【解析】(1)难溶的碳酸盐受热易分解为氧化物和 CO2,因此 MgCO3受热分解得到产物是 MgO
与 CO2。
(2)结合实验目的可知在装置 B 处,CO2与 Zn 作用生成 CO 气体,进入后面装置进行实
验,故装置 C 中 NaOH 是用来吸收 CO 中混有的 CO2气体;CO 气体不一定完全反应,因此尾气
中会有 CO,可利用其可燃性采取点燃法来进行尾气处理。
(3)①利用黑色固体可溶于盐酸并产生气体,结合“原子守恒”可知用酒精喷灯的乙组
实验得到的固体为 Fe;②利用甲组现象可知 Fe2O3与 CO 在酒精灯加热的条件下,Fe2O3被还原
得到黑色固体为 Fe3O4,由此可写出反应的离子方程式;③因 Fe3+遇 SCN-显红色,所以步骤 4
中溶液变红是溶液中 Fe2+被 Cl2氧化为 Fe3+所致、溶液褪色的原因可能是 Cl2将 SCN-氧化,若该
假设成立,则溶液中还存在 Fe3+,再继续加入 KSCN 溶液则溶液变红;④若 B 处停止加热后,C
中液体易倒吸入 B 中引起玻璃管炸裂,因此可采取的改进措施是在装置 B C 之间添加装置 E 防
倒吸。
9、[答案] (1)蒸馏水 取水洗液于试管中,加入稀硝酸酸化,滴加 AgNO3溶液,若无白色
浑浊出现,则表明 Cl-已经冼净。
(2)样品中 BaCl2 的物质的量为
质量
(3)偏高
[解析]:(1)若沉淀洗涤后洗涤液中不含 Cl-则已经洗净,这是沉淀洗涤的常用方法;
(2)计算氯化钡和水的物质的量比,即求出 x;
(3)题中已经表明硫酸钡被还原为 BaS,则沉淀质量减小,相对水的质量比提高,x 数据将偏
高。
10、【答案】
(1)2Cl2+2Ca(OH)2=CaCl2+2Ca(ClO)2+2H2O; (2)碱性、漂白性;
(3)①检验白雾中是否含有 Cl2,排除 Cl2 干扰;②白雾中含有 SO2,SO2可与酸化的 AgNO3
溶液反应产生白色沉淀;(4)向漂白精溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色;
(5)①CaSO4; ②Cl2+SO2+2H2O=4H+
+2Cl-+SO4
2-。
【解析】(1)Cl2和 Ca(OH)2生成氯化钙、次氯酸钙与水;
(2)pH 试纸先变蓝(约为 12),说明溶液呈碱性,后颜色褪去,说明具有漂白性;
(3)①反应中生成 Cl2,用湿润的碘化钾淀粉试纸检验白雾中是否 Cl2,排除 Cl2干扰;
②白雾中含有 SO2,可以被硝酸氧化为硫酸,故 SO2可以使酸化的 AgNO3溶液产生白色沉淀;
(4)向漂白精溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色;
(5)①取上层清液,加入 BaC12溶液,产生白色沉淀,说明 SO2被氧化为 SO4
2-,故沉淀 X为 CaSO4;
②溶液呈黄绿色,有 Cl2生成,Cl2与 SO2反应生成盐酸与硫酸。
11、【解析】(1)A 中是制备氯化铁的,则反应的化学方程式为 2Fe+3Cl2 2FeCl3。
(2)要使沉积的 FeCl3进入收集器,根据 FeCl3加热易升华的性质,第④的操作应该是:在沉
积的的 FeCl3固体下方加热。(3)为防止 FeCl3 潮解所采取的措施有②通入干燥的 Cl2,⑤用干
燥的 N2赶尽 Cl2,即答案选②⑤。(4)B 中的冷水作用为是冷却 FeCl3使其沉积,便于收集产
品;装置 C 的名称为干燥管。装置 D 中 FeCl2全部反应完后,因为失去吸收 Cl2的作用而失效,
检验 FeCl2是否失效就是检验二价铁离子,最好用 K3[FeCN]6溶液,也可以用酸性高锰酸钾溶液
检验。
(5)氯气有毒,应该有氢氧化钠溶液吸收 。由于吸收的是氯气,不用考虑防倒
吸。
(6)铁离子具有氧化性,能把 H2S 氧化生吃单质 S,所以反应的离子方程式是 2Fe3++H2S=2Fe2
+
+S↓+2H+
。
(7)阳极失去电子,发生氧化反应,所以阳极电极反应为 Fe2+-3e-=Fe3+。
(8)在实验中得到氯化铁,而氯化铁是可以循环使用的,即该实验的另一个优点是 FeCl3 可以
循环利用。
答案:(1)2Fe+3Cl2 2FeCl3;(2)在沉积的的 FeCl3固体下方加热;(3)②⑤
(4)冷却,使 FeCl3沉积,便于收集产品;干燥管;K3[FeCN]6溶液。(5) 。
(6)2Fe3++H2S=2Fe2++S↓+2H+
; (7)Fe2+-3e-=Fe3+;(8)FeCl3得到循环利用。
12、答案:(1)直形冷凝管 (2)防止暴沸; B (3)
(4)检漏;上口倒出; (5)干燥(或除水除醇)(6)CD (7)C
解析:该题以醇的消去反应为知识载体考查了物质的分离和提纯的方法,以及实验数据的处理
能力。
(1)根据仪器的构造特点可知,装置 b 是直形冷凝管。
(2)实验中为了防止暴沸,应该加入碎瓷片;如果忘记加入碎瓷片,须冷却后再添加,若立
即添加液体会暴沸,答案选 B。
(3)联想到实验室制乙烯的反应,可以得出最可能的副反应就是醇分子间生成醚,即该反应
的副产物的结构简式应该是 。
(4)分液漏斗在使用前应该检查是否漏液。在分液时密度大的液体从漏斗下口倒出,密度小
的液体从山口倒出。(5)无水氯化钙具有吸水性,可以除去粗产品中的少量水分。
(6)在环己烯的蒸馏过程中,用不到吸滤瓶和球形冷凝管,答案选 CD。
(7)根据反应式 可知,理论上生成环己烯的
质量是
g4.16
100
82g20
=
,所以环己烯的产率是
%61%100
g4.16
g10
=
,即答案选 C。
13、解析:(1)仪器 A 是干燥管,因为 TiCl4遇到水蒸气会水解,所以 E 中可以用浓硫酸来隔
离空气。对于气体的制取性质实验应该:组装仪器、检验气密性、加装药品……。终止实验时
为防止倒吸,应先熄灭酒精灯,冷却到室温后再停止通入 N2。分离两种沸点不同的液体混合物
应该用蒸馏。
(2)①因为矿石经硫酸溶解后得到的 Fe2(SO4)3,而后面过滤得到的是 FeSO4·7H2O,所以试剂
A 是铁粉,把 Fe3+还原为 Fe2+。由于 TiOSO4容易水解,若温度过高,则会有较多 TiOSO4水解为
固体 H2TiO3而经过滤进入 FeSO4·7H2O 中导致 TiO2产率降低。
②加 KSCN 溶液无现象,加 H2O2后出现红色,说明存在 Fe2+。经加热后 Fe2+氧化为 Fe2O3而使
产品发黄。
答案:(1)干燥管;浓硫酸;检查气密性;②③①,分馏(或蒸馏)
(2)①Fe;温度过高会导致 TiOSO4提前水解,产生 H2TiO3沉淀。 ②Fe2+,Fe2O3