- 187.28 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
氯 及 其 化 合 物
1 (2015江苏)酸性溶液中KIO3与KI反应生成I2:NO3-+I-+6H+===I2+3H2O
2 (2015广东)向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,现象是溶液变成蓝色,说明氧化性:Cl2 > I2
3 (2015山东)向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色,说明Br-还原性强于Cl-
4 (2015上海)HClO见光不会分解
5 (2015北京)消毒液可用NaOH溶液吸收Cl2制备:
Cl2+2OH-===ClO-+Cl-+H2O
6 (2015北京)消毒液的pH约为12:ClO-+H2O ⇌ HClO+OH-
7 (2015北京)消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2:
2H++Cl-+ClO-===Cl2↑+H2O
8 (2015北京)消毒液加白醋生成HClO,可增强漂白作用:
CH3COOH+ClO-===HClO+CH3COO-
9 (2016上海)Cl2能使湿润的淀粉碘化钾试纸变蓝,说明Cl2具有氧化性
10 (2016全国卷Ⅰ)将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2
11 (2016全国卷Ⅲ)漂白粉能漂白织物的原因是次氯酸盐具有氧化性
12 (2016全国卷Ⅲ)将浓盐酸与MnO2共热产生的气体先通过浓H2SO4,后通过饱和食盐水来制备纯净Cl2
13 (2016四川)氯气作水的杀菌消毒剂时没有发生化学变化
14 (2017全国卷III)目的:清洗碘升华实验所用试管;操作:先用酒精清洗,再用水清洗
15 (2019江苏)实验操作:向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色;结论:Br2的氧化性比I2的强
16 (2019北京)物质(杂质):Cl2(HCl);除杂试剂:H2O、浓H2SO4
17 (2019全国卷III)碘酒可用于皮肤外用消毒
18 (2019全国卷III)目的:制取较高浓度的次氯酸溶液;实验:将Cl2通入碳酸钠溶液中
19 (2019上海)次氯酸漂白只涉及物理变化
4
20 (2010山东)HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
21(2010山东)新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
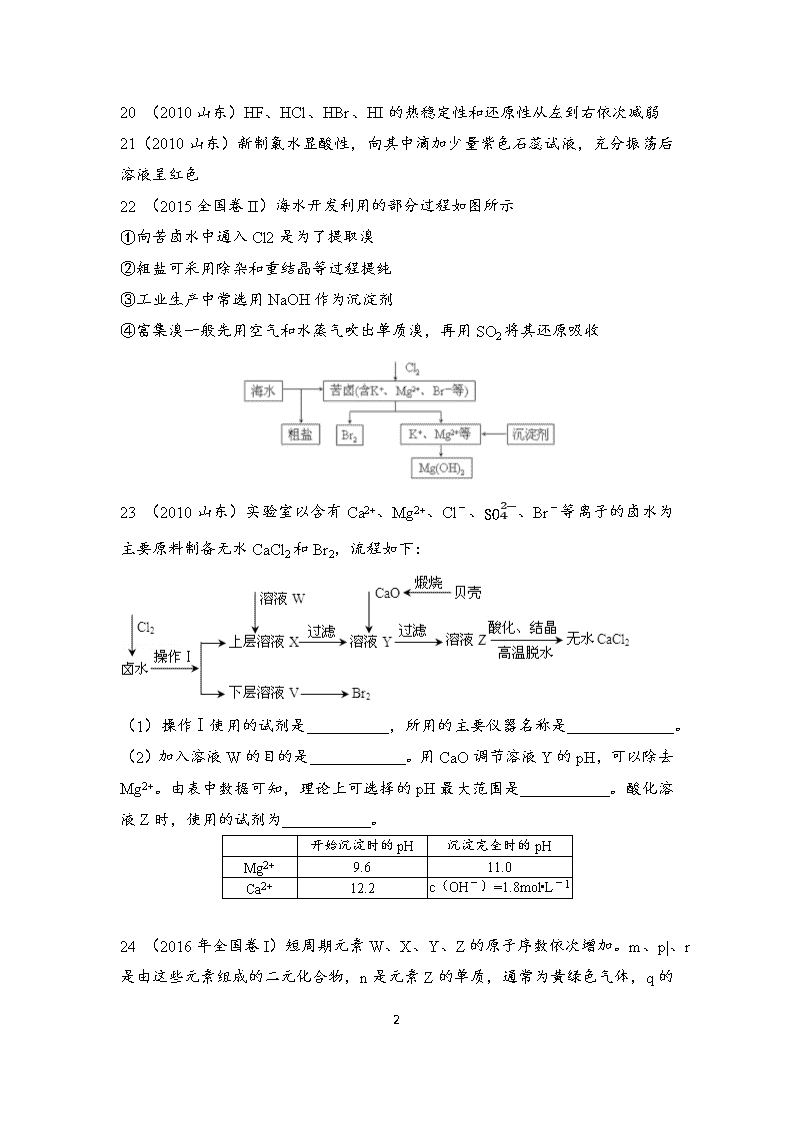
22 (2015全国卷II)海水开发利用的部分过程如图所示
①向苦卤水中通入Cl2是为了提取溴
②粗盐可采用除杂和重结晶等过程提纯
③工业生产中常选用NaOH作为沉淀剂
④富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
23 (2010山东)实验室以含有Ca2+、Mg2+、Cl﹣、SO42-、Br﹣等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
(1)操作Ⅰ使用的试剂是 ,所用的主要仪器名称是 。
(2)加入溶液W的目的是 。用CaO调节溶液Y的pH,可以除去Mg2+。由表中数据可知,理论上可选择的pH最大范围是 。酸化溶液Z时,使用的试剂为 。
开始沉淀时的pH
沉淀完全时的pH
Mg2+
9.6
11.0
Ca2+
12.2
c(OH﹣)=1.8mol•L﹣1
24 (2016年全国卷I)短周期元素W、X、Y、Z的原子序数依次增加。m、p|、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol/L r溶液的pH为2,s通常是难溶于水的混合物。
4
m n p q r
25(2019江苏)在酸性NaClO溶液中,HClO氧化NO生成Cl−和NO3- ,其离子方程式为
26 (2018北京28)实验小组制备高铁酸钾(K2FeO4)并探究其性质。资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。制备K2FeO4(夹持装置略)
①A为氯气发生装置。A中反应方程式是
(锰被还原为Mn2+)。②将除杂装置B补充完整并标明所用试剂。
27 (2015江苏19)实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4。
装置A中KMnO4与盐酸反应生成MnCl2和Cl2,其离子方程式为 ,将制备的Cl2通过装置B可除去 (填化学式)
28 (2017年11月浙江选考29题4分)取7.90g KMnO4加热分解后剩余固体7.42g。该剩余固体与足量的浓盐酸在加热条件下充分反应,生产单质气体A,产物中锰元素以Mn2+存在。请计算:
(1)KMnO4的分解率 (2)气体A的物质的量
4
29 (2015年10月浙江选考25)已知氧化性Br2>Fe3+。向含溶质a mol 的FeBr2溶液中通入b mol Cl2充分反应。
离子的还原性强弱(Fe2+、Br-、Cl-):
发生的离子反应:
30(2010上海)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色.如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色.
完成下列填空:1)写出并配平CCl4层由紫色变成无色的化学反应方程式(I2被氧化为HIO3):
2)整个过程中的还原剂是
3)把KI换成KBr,则CCl4层变为 色:继续滴加氯水,CCl4层的颜色没有变化.Cl2、HIO3、HBrO3氧化性由强到弱的顺序是
25 (2015海南高考)工业上,向500~600 ℃的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行实验。
回答下列问题:
(1)制取无水氯化铁的实验中,A中反应的化学方程式为________________________________________,装置B中加入的试剂是________。
(2)制取无水氯化亚铁的实验中,装置A用来制取________。尾气的成分是________。若仍用D的装置进行尾气处理,存在的问题是_________________、__________________。
(3)若操作不当,制得的FeCl2会含有少量FeCl3,检验FeCl3常用的试剂是________。欲制得纯净的FeCl2,在实验操作中应先________,再________。
4