- 894.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2013-2014学年度第一学期期末五校联考高三化学试卷
可能用到的相对原子质量:
H:1 C:12 O:16 N:14 Na:23 Mg:24 Al:27 Fe:56 Cu:64 Ag:108
(第I卷 选择题共50分)
一、单选(本题共25个小题,每题2分,共50分)
1.下列物质的用途正确的是
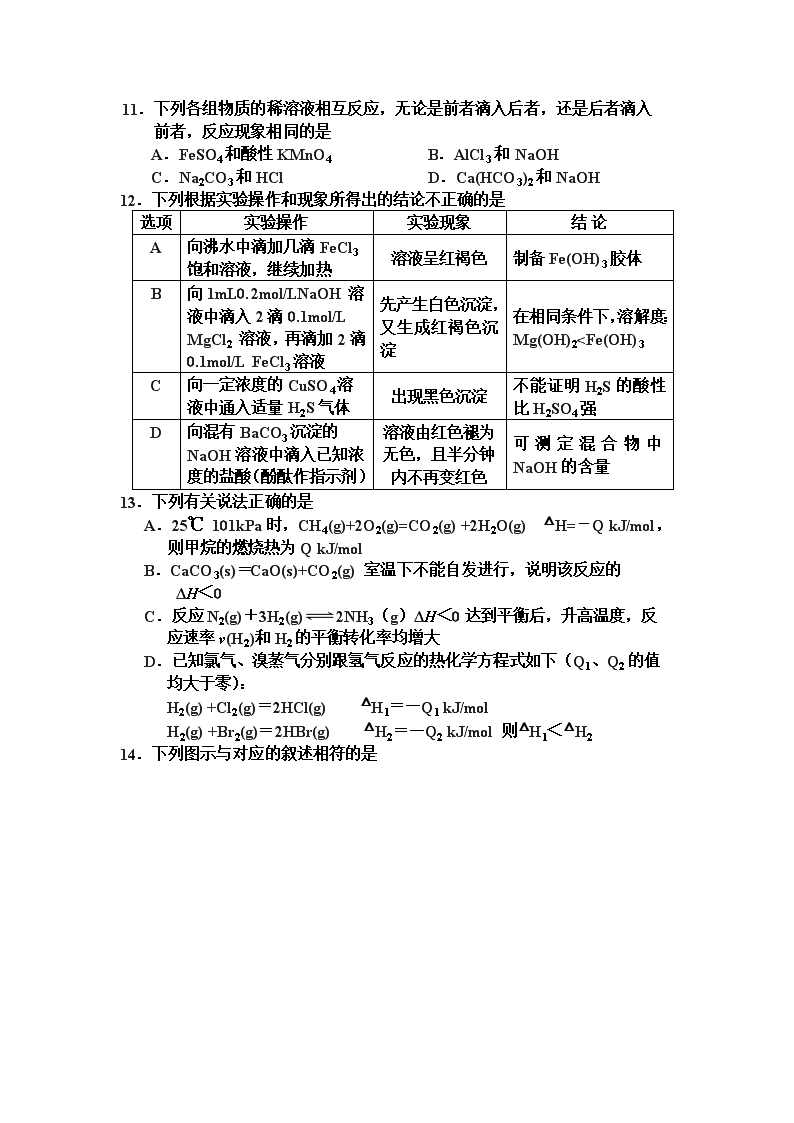
A. 可以用Na2O2漂白食品,而不能用SO2于干果防腐
B.用石英制太阳能电池
C. 食醋可去除水垢,NH4Cl溶液可去除铁锈
D.用电解熔融氯化铝的方法制得单质铝
2.下列叙述不正确的是
A.水受热不易分解,与水分子之间存在氢键无关
B.有化学键断裂的变化不一定是化学变化
C.熔化状态下能导电的物质不一定是离子化合物
D.易溶于水的物质一定是电解质
3.下列实验现象的描述正确的是
A.氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白色烟雾
B.向碳酸钠、碳酸氢钠的饱和溶液中滴加酚酞,仅前者溶液变红
C.铜在氯气中燃烧,产生棕黄色烟
D.在硫酸亚铁溶液中滴加稀K3[Fe(CN)6]后,变为特征性蓝色溶液
4. 奥运会会标是五环旗,假定奥运五环旗中的每一环或每种颜色表示一种物
质,相连的环(物质)间一定条件下能发生反应,
且四种反应中必须包含化合反应、置换反应及复
分解反应,则适合的一组是
选项
蓝
黄
黑
绿
红
A
SO2
H2S溶液
FeCl3溶液
Fe
CuSO4溶液
B
O2
Cu
稀HNO3
NaOH溶液
CO2
C
Cl2
NH3·H2O
稀H2SO4
NaOH溶液
Al(OH)3
D
N2
Mg
CO2
CaO
稀HCl
5.元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说
法不合理的是
A.若X+和Y2-的核外电子层结构相同,则原子序数:X > Y
B.因为酸性H2SO3> H2CO3,所以非金属性S>C
C.硅、锗都位于金属与非金属的交界处,都可以做半导体材料
D.Ca和Ba分别位于第IIA族第四周期和第六周期,则碱性:
Ca(OH)2 SO42-
D.该反应中还原剂是S2O32-
9. 下列离子方程式不正确的是
A. 三氯化铝溶液中加入过量氨水:Al3++4NH3·H2O==4NH4++AlO2—+2H2O
B. 4 mol/L的NaAlO2溶液和7 mol/L的HCl溶液等体积互相均匀混合:
4AlO2—+7H++H2O = 3Al(OH)3↓+Al3+
C. 在Mn2+的溶液中加入HNO3再加入PbO2,得紫红色溶液:
5PbO2+2Mn2++4H+ = 5Pb2++2MnO4—+2H2O
D. 将数滴0.1 mol/L的Na2CO3溶液缓缓滴入0.1 mol/L 25 mL盐酸溶液中:2H++ CO32— =CO2↑+ H2O
10.向含有FeBr2、FeI2的溶液中通入一定量的氯气后,再向溶液中滴加KSCN
溶液,溶液变为红色,则下列叙述不正确的是
A.通入氯气后的溶液中一定不存在I-;
B.通入氯气之后原溶液中的Fe2+全部被氧化;
C.原溶液中的Br-可能被氧化;
D.若取少量所得溶液,再加入CCl4溶液充分振荡,静置、分液,下层
溶液可能呈紫红色
11.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入
前者,反应现象相同的是
A.FeSO4和酸性KMnO4 B.AlCl3和NaOH
C.Na2CO3和HCl D.Ca(HCO3)2和NaOH
12.下列根据实验操作和现象所得出的结论不正确的是
选项
实验操作
实验现象
结 论
A
向沸水中滴加几滴FeCl3饱和溶液,继续加热
溶液呈红褐色
制备Fe(OH)3胶体
B
向1mL0.2mol/LNaOH溶液中滴入2滴0.1mol/L MgCl2 溶液,再滴加2滴0.1mol/L FeCl3溶液
先产生白色沉淀,又生成红褐色沉淀
在相同条件下,溶解度:
Mg(OH)2 PI
B. 图乙表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液,
溶液的pH随加入盐酸体积的变化
C. 依据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO,
调节pH≈4
D. 图丁中开关K置于A或B处均可以减缓铁的腐蚀
15. 下列叙述正确的是
A.将pH=2的盐酸和pH=2的醋酸等体积混合,混合后溶液的pH=2
B.HA—比HB—更难电离,则NaHA溶液的pH一定比NaHB溶液的大
C.在饱和氨水中加入同浓度的氨水,平衡正向移动
D.某温度下,Ba(OH)2溶液中,Kw=10—12,pH=8的该溶液中加入等体积pH=4的盐酸,混合溶液的pH=7
16. 某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶
液,溶液中pOH [ pOH=-lg(OH—) ]与pH的变化
关系如图所示,则下列说法正确的是
A.M点所示溶液导电能力强于Q点
B.M点和N点所示溶液中水的电离程度相同
C. N点所示溶液中c(CH3COO-)>c(Na+)
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
17.常温常压下,将x mol CO2气体通入1 L y mol/L的NaOH溶液中,下列对所得溶液 的描述不正确的
A.当x=2y时,随着CO2气体的通入,溶液中
由水电离出的c(H+)有如右图变化关系
B.当x=y时,所得溶液中存在:
c(OH-)+c(CO32—)=c(H+)+c(H2CO3)
C.当2x=y时,所得溶液中存在:
c(Na+)>c(CO32—)>c(OH-)>c(HCO3-)>c(H+)
D.当1/2<x/y<1时,所得溶液中一定存在:
c(Na+)=c(CO32—)+c(HCO3-)+c(H2CO3)
18. 将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极
进行电解,电解中溶液pH随时间t变化的曲线如图,则下列说法正确的是
A.阳极产物一定是Cl2,阴极产物一定是Cu
B.BC段表示在阴极上是H+放电产生了H2
C.整个过程中阳极先产生Cl2,后产生O2
D.CD段表示阳极上OH一放电破坏了水的电离平衡,产生了H+
19.一定温度下,某恒定容积的密闭容器中发生如下可逆反应:CO(g)+H2(g) C(s)+H2O(g);ΔH>0,以1 mol CO和2 mol H2为起始反应物,t1时达到平衡,生成0.5mol H2O(g)。t2时改变反应条件,化学反应速率(v)与时间(t)的关系如图所示。下列叙述正确的是
A.t2时改变的条件可能是升高了温度或增大了压强
B.平衡后若加入少量炭,平衡向逆反应方向移动
C.平衡后若加入氢气,上述反应的ΔH会增大
D.起始时刻和达平衡后容器的压强之比为5∶6
20.在一定条件下,向一体积为2 L的恒容密闭容器中充入2 mol A、1mol B,发生如下反应:2A(g)+B3C(g) △H=—Q kJ/mol(Q>0)。经过60 s达到平衡,测得B物质的量为0.2 mol,下列对该平衡的叙述正确的是
A.用A浓度表示该反应速率为1.6 mol/(L•min)
B.若使容器变为1 L,则B的物质的量一定减小
C.达到平衡,测得放出热量为x kJ,则x=Q
D.若向容器再充入1 mol C,重新达到平衡,A的体积分数保持不变,
则B为气态
21. 右图为摇摆电池的工作原理图,在充放电过程中Li+在两极间“摇来摇去”,其总反应为:LiCoO2+6C Li(1-x)CoO2+ LixC6 下列有关说法正确的是
A. 放电时,负极反应为:
LiCoO2—= Li(1-x)CoO2 + xLi+
B. 充电时,B极发生还原反应
C. 充电时,Li+穿过隔离膜向B极移动
D. 当A极得到x mol电子,电池消耗6 mol C
22.按图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示
①c(Ag+) ②c(AgNO3) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
A. ①③ B.③④ C.①②⑤ D.①②④
23. 一定条件下,碳钢腐蚀与溶液pH的关系如下:
pH
2
4
6
6.5
8
13.5
14
腐蚀快慢
较快
慢
较快
主要产物
Fe2+
Fe3O4
Fe2O3
FeO2—
下列说法不正确的是
A.在pH<4溶液中,碳钢主要发生析氢腐蚀
B.在pH>6溶液中,碳钢主要发生吸氧腐蚀
C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e—=2H2O
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
24.常温下,在某200 mL的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。(设硝酸只被还原为NO气体)。下列有关分析错误的是
A.原混合酸中NO3-物质的量为0.2 mol
B.原混合酸中H2SO4物质的量浓度为2mol/L
C.溶液中最终溶质为FeSO4
D.OA段与BC段反应中电子转移的物质的量之比为2:1
25. 下列叙述与对应图像或数据描述正确的是
A.由下列短周期元素性质的数据推断③元素最高价氧化物对应的水化物碱
性最强
①
②
③
④
⑤
⑥
⑦
⑧
原子半径最高或最低化合价
0.74
1.60
+2
1.52
+1
1.10
+5
0.99
+7
1.86
+1
0.75
+5
0.82
+3
—2
—3
—1
—3
B.图甲表示Zn—Cu原电池反应过程中的电流强度的变化,T时可能加入
了H2O2
C.图乙表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变
D.图丙表示周期表的一部分,元素X,Y,Z、W中X的氢化物酸性最强
第II卷 (非选择题 50分)
26.(共18分)
I.(10分)四种短周期元素X、Y、Z、W,原子序数依次增大,请结合表中
信息回答下列问题。
X
Y
Z
W
结构
或
性质
X的最高价氧化物对应的水化物与其气态氢化物反应可得到一种盐
焰色反应呈黄色
在同周期主族元素形成的简单离子中,Z的离子半径最小
原子核外最外层电子数是次外层电子数的一半
(1)用电子式表示X的氢化物的形成过程_____________________________。
(2)W元素在周期表中的位置为____________________。
(3)上述元素的最高价氧化物对应的水化物中,有一种物质甲与其它三种物质在一定条件下均能发生化学反应,则甲中所含的化学键有________(填序号)。
a.离子键 b.极性共价键 c.非极性共价键 d.氢键
(4)向含有Z元素的简单阳离子的溶液中加入过量的NaOH溶液,发生反应的离子方程式为_____________________________________。
(5)下列可作为比较Z和Mg金属性强弱的方法是_______(填代号)。
a.比较两种元素在化合物中化合价的高低
b.测等浓度相应氯化物水溶液的pH
c.在常温条件下比较单质与浓硝酸反应的剧烈程度
d.在两种金属氯化物的水溶液中分别滴加过量的NaOH溶液
II.(8分)多种物质的转化关系如下图所示(部分反应物或产物已略去,反应条件未列出):
已知:①A、B、C、D、G含有同种元素,且它们的状态与颜色如下表
所示:
②E是通常情况下密度最小的气体;B与AgNO3生成不溶于稀硝酸的白色沉淀;一种气体氧化物M通入B溶液中可被氧化为F,F是含有三种元素的共价化合物,F与A反应生成E和G。
请回答下列问题:
(1)写出下列物质的化学式:D___________;E__________。
(2)写出下列反应的离子方程式:
①B+M→F:________________________________________;
②A+F→E+G:______________________________________。
(3)下列氧化物中能与G溶液反应直接生成C固体的是_______(填字母)。
a.Na2O2 b.SO2 c.CO2 d.BaO2
27.(8分)某研究小组模拟工业无隔膜电解法处理电镀含氰废水,进行以下有关实验。填写下列空白:
实验I:制取次氯酸钠溶液
用石墨作电极电解饱和食盐水制取次氯酸钠溶液,设计
右图所示装置进行实验。
(1)电源中,a电极名称是__________。
(2)反应时,生成次氯酸钠的离子方程式为
__________________________________________。
实验II:测定含氰废水处理百分率
利用下图所示装置进行实验。将CN—的浓度为0.2 mol/L的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②锥形瓶中充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。
已知装置②中发生的主要反应依次为:
CN— + ClO— = CNO— + Cl—,
2CNO— + 2H+ + 3ClO— = N2↑ + 2CO2↑ + 3Cl— + H2O。
(3)①和⑥的作用是_______________________________________________。
(4)装置②中,生成需由装置③除去的物质的离子方程式为:
______________________________________________________.
(5)反应结束后,缓缓通入空气的目的是_____________________________
_____________________________________________。
28.(8分)已知25℃时弱电解质电离平衡常数:Ka(CH3COOH)=1.8×10—5,Ka(HSCN)=0.13。
(1)将20 mL 0.10 mol/L CH3COOH溶液和20 mL 0.10 mol/L的HSCN溶液
分别与0.10 mol/L的NaHCO3溶液反应,实验测得产生CO2气体体积V
与时间t的关系如图甲所示:
反应开始时,两种溶液产生CO2的速率明显不同的原因是____________
_________________________________________________;反应结束后所得溶液中c(SCN—)______c(CH3COO—) (填“>”、“=”或“<”)。
(2)2.0×10—3 mol/L的HF水溶液中,调节溶液pH(忽略调节pH时溶液的
体积变化),测得平衡体系中c(F—)、c(HF)与溶液pH的关系如图乙所示。
则25℃时,HF电离平衡常数为Ka(HF)=_____________________________
______________________(列式并求值,不写单位)。
(3)难溶物CaF2溶度积常数(Ksp)= 1.5×10—10,将4.0×10—4mol/L的HF溶液
与4.0×10—4mol/L的CaCl2溶液等体积混合,调节溶液pH=4(忽略调节
pH时溶液的体积变化),试分析混合后是否有沉淀生成?________(填“有”
或“没有”),简述理由:__________________________________________。
29.(16分)
I.向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
xA(g) + 2B(s)yC(g) △H< 0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如下图。请回答下列问题:
(1)用A的浓度变化表示该反应0~10 min内的平均反应速率V(A)=_______。
(2)推测第10 min引起曲线变化的反应条件可能是_____(填序号,下同);第16 min引起曲线变化的反应条件可能是______。
①减压 ②增大A的浓度 ③增大C的量
④升温 ⑤降温 ⑥加入催化剂
(3)若平衡I的平衡常数为K1,平衡II的平衡常数为K2,则K1______K2(填“>”、“=”或“<”)。
II. 铁元素是重要的金属元素,单质铁在工业和生活中使用得最为广
泛。铁还有很多的化合物及其化学反应,如铁与水的反应:
3Fe(s) + 4H2O(g)Fe3O4(s) + 4H2(g) △H
(1)已知:① 3Fe(s) + 2O2(g)Fe3O4(s) △H1=-1118.4 kJ/mol
② 2H2(g) + O2(g)2H2O(g) △H2=-483.8 kJ/mol
③ 2H2(g) + O2(g)2H2O(l) △H3=-571.8 kJ/mol
则△H =____________________(计算结果保留一位小数)。
(2)在t ℃时,该反应的平衡常数K=16,在2 L恒温恒容密闭容器甲和乙中,分别按下表所示加入物质,在t ℃时反应经过一段时间后达到平衡。
Fe
H2O(g)
Fe3O4
H2
甲/mol
1.0
1.0
1.0
1.0
乙/mol
1.0
1.5
1.0
1.0
①甲容器中H2O的平衡转化率为____________(结果保留一位小数)
②下列说法正确的是______________(填字母序号)
A. 若容器压强恒定,则反应达到平衡状态
B. 若容器内密度恒定,则反应达到平衡状态
C. 甲容器中H2O的平衡转化率大于乙容器中H2O的平衡转化率
D. 增加Fe3O4就能提高H2O的转化率
(3)若将(3)中装置改为恒容绝热(不与外界交换能量)的装置,按下表
充入起始物质,起始时与平衡后的各物质的量见下表:
Fe
H2O(g)
Fe3O4
H2
起始/mol
3.0
4.0
0
0
平衡/mol
m
n
p
q
若在达平衡后的装置中继续加入A、B、C三种状况下的各物质,见下表:
Fe
H2O(g)
Fe3O4
H2
A/mol
3.0
4.0
0
0
B/mol
0
0
1.0
4.0
C/mol
m
n
p
q
当上述可逆反应再一次达到平衡状态后,将上述各装置中H2的百分含量按由大到小的顺序排列:___________________(用A、B、C表示)。
(4)一种以甲醇做燃料的电池示意图如下图。写出该电池放电时负极的电极反应式:_______________________________。
2013-2014学年度第一学期期末五校联考高三化学试卷
答题纸
26.(共18分)
I.(1)________________________________________。
(2)W元素在周期表中的位置为____________________。
(3)________(填序号)。
(4)离子方程式为_____________________________________。
(5)___________(填代号)。
II.(1)化学式:D___________;E__________。
(2)写出下列反应的离子方程式:
①B+M→F:________________________________________;
②A+F→E+G:______________________________________。
(3)_______(填字母)。
27.(8分)
(1)a电极名称是__________。
(2)离子方程式_______________________________________________。
(3)①和⑥的作用是____________________________________________
____________________________________________________。
(4)离子方程式_______________________________________________.
(5)目的是____________________________________________________
_____________________________________________。
28.(8分)
(1)原因是______________________________________________________
__________________________________________________________;
c(SCN—)______c(CH3COO—) (填“>”、“=”或“<”)。
(2)Ka(HF)=_____________________________________________________
(列式并求值,不写单位)。
(3)________(填“有”或“没有”),简述理由:____________________
_____________________________________________________________
__________________。
29.(16分)
I.(1)V(A)=________________________。
(2)________(填序号,下同);_________。
(3)K1______K2(填“>”、“=”或“<”)。
II.(1)△H =____________________。
(2)①____________(结果保留一位小数)
②______________(填字母序号)
(3)由大到小的顺序排列:___________________(用A、B、C表示)。
(4)负极的电极反应式:_______________________________。
2013-2014学年度第一学期期末五校联考高三化学试卷
参考答案
单选,每题2分,共50分
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
C
D
C
D
B
B
C
A
A
B
D
B
D
题号
14
15
16
17
18
19
20
21
22
23
24
25
答案
C
A
B
D
C
A
D
D
C
C
D
B
26.(18分)答案
I.(1)(2分)
(2)第三周期 第ⅣA族 (2分) (3)ab(2分)
(4)Al3+ + 4OH—= AlO2— +2H2O(2分) (5)bd(2分)
II.(1)Fe2O3;H2(2分)
(2)① 2Fe3+ + SO2 + 2H2O = 2Fe2+ +4H+ + SO42—(2分)
② Fe + 2H+ = Fe2+ + H2↑(2分)
(3)ad(2分)
27.(8分)(1)负极(1分)
(2)Cl2 + 2OH— = ClO— + Cl— + H2O (2分)
(3)排除空气中的CO2对实验的干扰(1分)
(4)ClO— + Cl— + 2H+ = Cl2 ↑+ H2O (2分)
(5)使装置内残留的CO2全部进入装置⑤(2分)
28.(8分)
(1)因为Ka(HSCN)>Ka(CH3COOH),溶液中HSCN电离出的c(H+)比CH3COOH电离的大,故HSCN溶液中产生CO2的速率快。(2分);
>(1分)
(2)Ka(HF)= (2分)
(3)有(1分),
因溶液中c(Ca2+)• c2 (F—)=5.12×10—10 >Ksp(CaF2)=1.5×10—10(2分)
29.(16分)
I.答案(1)0.02 mol/(L•min) (2分)
(2)④⑥;④(3分)
(3)>(1分)
II:(1)—150.8 kJ/mol(2分)
(2)①33.3%(2分) ②B(2分)
(3)B>C>A(2分)
(4)CH3OH—6e—+3O2—=CO2↑+2H2O(2分)