- 499.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
学员
辅导教师
使用日期
年 月 日
(11年天津化学)1.以下有关原子结构及元素周期律的叙述正确的是( )
A第IA族元素铯的两种同位素137CS比133CS多4个质子
B同周期元素(除0族元素外)从左到右,原子半径逐渐减小
C第VIIA族元素从上到下,其氢化物的稳定性逐渐增强
D同主族元素从上到下,单质的熔点逐渐降低
(10年天津化学)2.下列鉴别方法可行的是( )
A.用氨水鉴别Al3+、Mg2+和Ag+
B.用Ba(NO3)2溶液鉴别Cl-、SO和CO
C.用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷
D.用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO
(08年天津化学)3.下列叙述正确的是
A、1个甘氨酸分子中存在9对共用电子
B、PCl3和了BCl3分子中所有原子的最外层都达到8电子稳定结构
C、H2S和CS2分子都是含极性键的极性分子
D、熔点由高到低的顺序是:金刚石>碳化硅>晶体硅
(08年天津化学)4.下列离方程式书写正确的是
A、石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3↓
B、NH4HSO3液与足量NaOH液混合加热:NH4++HSO3-+2OH-NH3+SO32-+2H2O
C、酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
D、AgNO3溶液中加入过量的氨水:Ag++NH3·H2O=AgOH +NH4+
(07年天津化学)5.2007年3月21日,我国公布了111号元素Rg的中文名称。该元素名称及所在周期
A.钅仑 第七周期 B.镭 第七周期 C.铼 第六周期 D.氡 第六周期
(07年天津化学)6.下列关于粒子结构的描述不正确的是
A.H2S和NH3均是价电子总数为8的极性分子
B.HS-和HCl均是含一个极性键的18电子粒子
C.CH2C12和CCl4均是四面体构型的非极性分子
D.1 mol D216O中含中子、质子、电子各10 NA(NA代表阿伏加德罗常数的值)
(06年天津化学)7.下列说法正确的是
A.用乙醇或 CCl4可提取碘水中的碘单质
B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同
C. 24Mg 32S晶体中电子总数与中子总数之比为1:1
D.H2S和 SiF4分子中各原子最外层都满足8电子结构
(06年天津化学)8.引起下列环境污染的原因不正确的是
A.重金属、农药和难分解有饥物等会造成水体污染
B.装饰材料中的甲醛、芳香烃及氡等会造成居室污染
C.SO2、NO2 或 CO2 都会导致酸雨的形成
D.CO2 和氟氯烃等物质的大量排放会造成温室效应的加剧
(06年天津化学)9.下列说法正确的是
A.IA族元素的金属性比ⅡA族元素的金属性强
B.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
(05年天津化学)10.下列说法正确的是
A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体;
甲醇、乙二醇和丙三醇互为同系物
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.由IA族和VIA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含有
共价键的离子型化合物
(05年天津化学)11.下列各组离子在溶液中能大量共存的是
A.酸性溶液Na+、K+、MnO4—、Br— B.酸性溶液Fe3+、NH4+、SCN—、NO3—
C.碱性溶液Na+、K+、AlO2—、SO42— D.碱性溶液Ba2+、Na+、CO32—、Cl—
(04年天津化学)12.代表阿伏加德罗常数值,下列说法正确的是( )
A.9g重水所含有的电子数为
B.1molMgCl2中含有离子数为
C.氯气与足量NaOH溶液反应转移的电子数为
D.1molC10H20分子中共价键总数为
(04年天津化学)13.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象( )
A. B.
C.元素周期表中VA族所有元素的原子 D.元素周期表中第1周期所有元素的原子
(04年天津化学)14.仅用一种试剂鉴别如下物质:苯、、溶液、溶液、溶液,下列试剂中不能选用的是 ( )
A. 溴水 B. 溶液 C. 酸性溶液 D. 溶液
(03年全国化学)15.人类探测月球发现,在月球的土壤中含有较丰富的质量数为 3 的氦,它可以作为未来核聚变的重要原料之一。氦的该种同位素应表示为
A. B. C. D.
(03年全国化学)16.在两个容积相同的容器中,一个盛有 HCl 气体,另一个盛有 H2 和 Cl2 的混合气体。在同温同压下,两容器内的气体一定具有相同的
A.原子数 B.密度 C.质量 D.质子数
(03年全国化学)17.某无色混合气体可能由 CH4、NH3、H2、CO、CO2 和 HCl
中的某几种气体组成。在恒温恒压条件下,将此混合气体通过浓 H2SO4 时,总体积基本不变;通过过量的澄清石灰水,未见变浑浊,但混合气体的总体积减小,把剩余气体导出后,在 O2 中能够点燃,燃烧产物不能使 CuSO4 粉末变色。则原混合气体的成份是
A HCl 和 CO B.HCl、H2 和 CO
C.CH4 和 NH3 D.HCl、CO 和 CO2
(02年全国化学)18.目前我国许多城市和地区定期公布空气质量报告,在空气质量报告中,一般不涉及
A. S02 B. NO2 C.CO2 D.可吸入颗粒物
(02年全国化学)19.为了除去蛋白质溶液中混入的少量氯化钠,可以采用的方法是
A.过滤 B.电泳 C.渗析 D.加入AgNO3溶液,过滤
(02年全国化学)20.铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别为
A.Fe(OH)3 ;Fe2O3 B.Fe(OH)2 ;FeO
C.Fe(OH)2、Fe(OH)3 ;Fe304 D.Fe2O3 ;Fe(OH)3
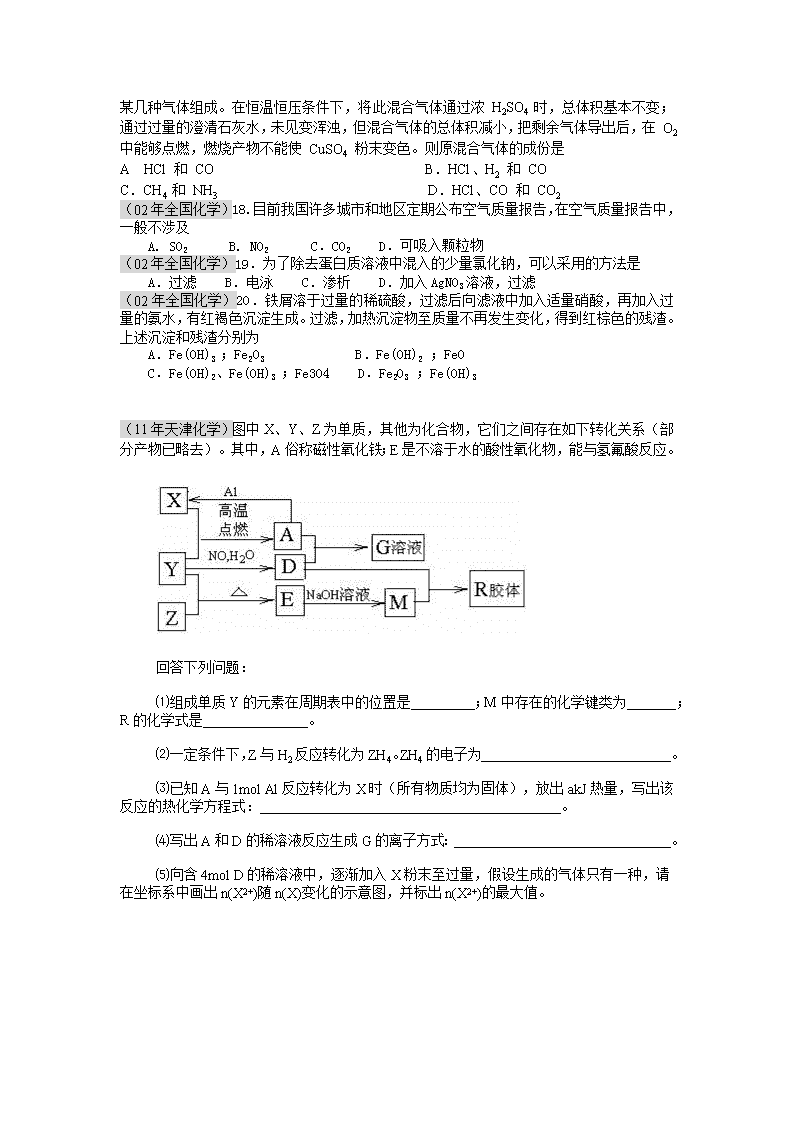
(11年天津化学)图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应。
回答下列问题:
⑴组成单质Y的元素在周期表中的位置是 ;M中存在的化学键类为 ;R的化学式是 。
⑵一定条件下,Z与H2反应转化为ZH4。ZH4的电子为 。
⑶已知A与1mol Al反应转化为X时(所有物质均为固体),放出akJ热量,写出该反应的热化学方程式: 。
⑷写出A和D的稀溶液反应生成G的离子方式: 。
⑸向含4mol D的稀溶液中,逐渐加入X粉末至过量,假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。
(10年天津化学)(14分)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
⑴L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是__________________(用元素符号表示)。
⑵ Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
⑶ 硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7 mol·L-1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
⑷ 用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式:_________;由R生成Q的化学方程式:___________________________________。
(09年天津化学)(14分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族
周期
IA
0
1
①
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
②
③
④
3
⑤
⑥
⑦
⑧
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为_____________________ ,
N→⑥的单质的化学方程式为________________ 。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
(08年天津化学)(14分)W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为 。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为 。
(3)X的硝酸盐水溶液显 性,用离子方程式解释原因 。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(5)比较Y、Z气态氢化物的稳 定性: > (用分子式表示)。
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是: > > > 。
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量。写出该反应的热化学方程式: 。
(07年天津化学)(14分)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
⑴.V的单质分子的结构式为_______________;XW的电子式为____________;
Z元素在周期表中的位置是_____________。
⑵.U元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体 ③ 分子晶体 ④ 金属晶体
⑶.U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________,用一个离子方程式加以证明____________________________________________________。
⑷.YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________________________________,由此可知VW和YW2
还原性较强的是(写化学式)______________________________。
(06年天津化学)(14分)中学化学中几种常见物质的转化关系如下:
将 D溶液滴入沸水中可得到以 F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体中 F粒子直径大小的范围:___________________。
(2)A、B、H的化学式:A __________、B ___________、H ___________。
(3)①H2O2 分子的电子式:________________ 。
②写出 C的酸性溶液与双氧水反应的离子方程式:____________________________。
(4)写出鉴定 E中阳离子的实验方法和现象:
(5)在 C溶液中加入与 C等物质的量的 Na2O2,恰好使 C转化为 F,写出该反应的离子方程式:
(05年天津化学)A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和
实验现象:
请回答:
⑴ 出A、B和C的化学式:A_______________,B______________,C____________。
⑵ 依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
____________________________________________;
____________________________________________。
⑶ 写出将SO2气体通入K溶液发生反应的离子方程式:
___________________________________________。
⑷ 写出由F→H的化学方程式:
____________________________________________。
(04年天津化学)(14分)
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成。
回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式 。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水 ③ 硫酸锌和氢氧化钠 ④ 硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式 。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因 。
(03年全国化学)(l3分)A、B、C 是短周期 IA 和 ⅡA 族元素的碳酸盐,它们的质量分别为 mA、mB、mc,与足量盐酸完全反应,消耗盐酸的物质的量分别为 、、。
已知:mA=mB+mC,=+。请填空:
(1)写出短周期 IA 和 ⅡA 族元素形成的所有碳酸盐的名称: 。
(2)若以 MA、MB 和 MC 分别表示 A、B、C 的相对分子质量,试写出 MA、MB 和 MC 三者的相互关系式
(3)A 的正确选择有 种,其化学式为: 。
(4)若 A 和 B 为 ⅡA 族元素的碳酸盐,C 为 IA 族元素的碳酸盐,则 A、B、C 的化学式依次是 。MB∶mC= 。(保留 2 位小数)
(03年全国化学)(11分)X、Y、Z 是短周期元素的三种常见氧化物。X 跟水反应后可生成一种具有还原性的不稳定的二元酸,该酸的化学式是 ;Y 和 X 的组成元素相同,Y 的化学式是 ; lmol Z 在加热时跟水反应的产物需要用 6mol 的氢氧化钠才能完全中和,Z 的化学式 ,其中和产物的化学式是 。在一定条件下 Y 可以跟非金属单质 A 反应生成 X 和 Z,其反应的化学方程式是 。