- 86.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
09届高考化学纠错再练一
1.CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-=2CuI↓+I2而得到。现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液。电解开始不久,阴极区溶液呈红色,而阳极区溶液呈蓝色。对阳极区溶液呈蓝色的正确解释是 ( )
A.2I--2e-=I2 碘遇淀粉变蓝 B.Cu-2e-=Cu2+ Cu2+ 显蓝色
C.2Cu+4I--4e-=2CuI↓+I2 碘遇淀粉变蓝
D.4OH――4e-=2H2O+O2 O2将I-氧化为I2,碘遇淀粉变蓝
2.下列叙述正确的是 ( )
A.为了测定一包白色粉末的质量,将药品放在右盘,砝码放在左盘,并需移动游码使之平衡,会引起测定结果偏高
B.将40℃的饱和石灰水冷却至10℃;或加入少量CaO,但温度仍保持40℃,在这两种情况下溶液中溶质的质量分数、水的电离平衡和Ca(OH)2的溶解平衡均未改变
C.配制物质的量浓度的溶液,定容时仰视刻度线,会引起测定结果偏高
D.有电解质参加的化学反应一定可以用离子方程式表示,生成阳离子的反应不一定是氧化反应,生成物只有一种的化学反应不一定是化合反应。
3、对于平衡:2A+2BC+2D+3E+H2O(A、B、C、D、E为溶液中可自由移动的微粒),下列判断正确的是:
A.加水平衡左移 B.增加A,B的转化率不一定提高
C.平衡后,按起始投料比,再次投入A和B,则A和B的转化率都将增大
D.升温该平衡一定发生移动。
4.某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A = H+ + HA-,
HA- H++A2-,又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是:
A.因为A2-+H2O HA-+OH-,HA-+H2O H2A+OH-,所以Na2A为强电解质且其溶液显碱性
B.H2A为弱电解质且0.1mol·L-1 H2A溶液中氢离子的物质的量浓度为0.11 mol·L-1
C.NaHA溶液中各种离子浓度的关系是c(Na+ ) > c(HA-) > c(H+) > c(A2-) > c(OH- )
D.在NaHA溶液中,HA-电离的趋势大于其水解的趋势
5.雷达的微波过滤器里使用铁氧磁性体,如钇铁石榴石Y3Fe5O12,其中Y是ⅢB族稀土元素。下面有关钇铁石榴石的叙述中正确的是
A.可表示为3YO3·3FeO·Fe2O3 B.可表示为Y3O5·Fe3O4·Fe2O3
C.其中钇、铁的化合价均为+3价 D.其中钇、铁的化合价均有+2、+3价
6.已知25℃时有关弱酸的电离平衡常数:
弱酸化学式
CH3COOH
HCN
H2CO3
电离平衡常数(25℃)
1.8×l0_5
4.9×l0_10
K1=4.3×l0_7
K2=5.6×l0_11
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L—1 HCN溶液与b mol·L—1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-)
7.在密闭容器中,将1.0 mol CO与1.0 mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g)CO2(g)+H2(g)。一段时间后该反应达到平衡,测得CO的物质的量为0.5 mol。则下列说法正确的是
A.800℃下,该反应的化学平衡常数为0.25
B.427℃时该反应的平衡常数为9.4,则该反应的△H<0
C.同温下,若继续向该平衡体系中通入1.0 mol的H2O(g),则平衡时CO转化率为66.7%
D.同温下,若继续向该平衡体系中通入1.0 mol的CO(g),则平衡时CO物质的量分数为33.3%
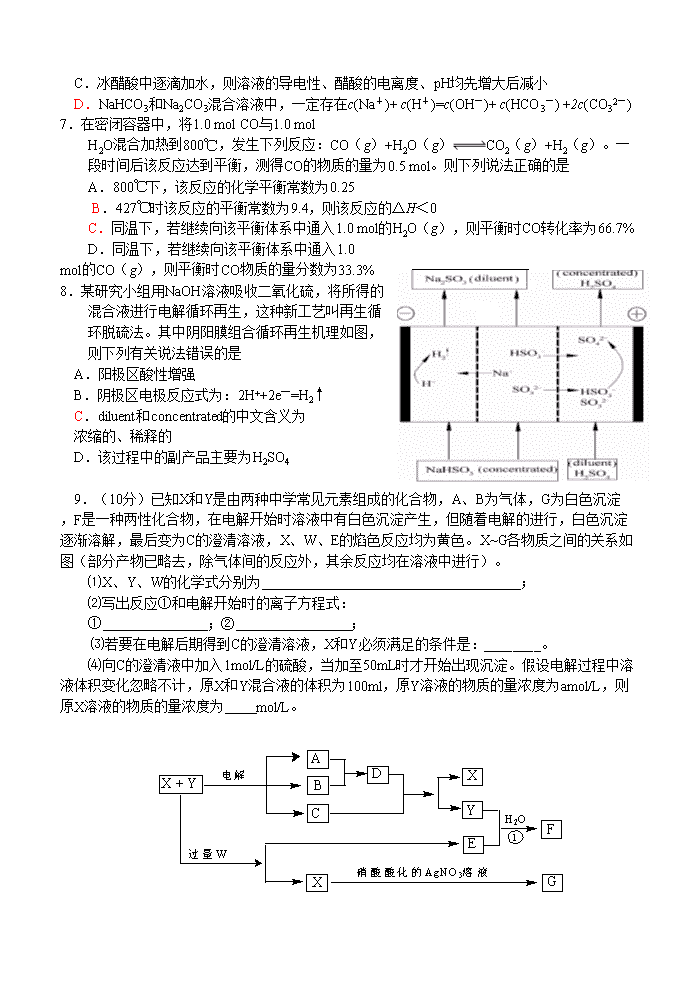
8.某研究小组用NaOH溶液吸收二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如图,则下列有关说法错误的是
A.阳极区酸性增强
B.阴极区电极反应式为:2H++2e—=H2↑
C.diluent和concentrated的中文含义为
浓缩的、稀释的
D.该过程中的副产品主要为H2SO4
9.(10分)已知X和Y是由两种中学常见元素组成的化合物,A、B为气体,G为白色沉淀,F是一种两性化合物,在电解开始时溶液中有白色沉淀产生,但随着电解的进行,白色沉淀逐渐溶解,最后变为C的澄清溶液,X、W、E的焰色反应均为黄色。X~G各物质之间的关系如图(部分产物已略去,除气体间的反应外,其余反应均在溶液中进行)。
⑴X、Y、W的化学式分别为_____________________________________;
⑵写出反应①和电解开始时的离子方程式:
① ;② ;
⑶若要在电解后期得到C的澄清溶液,X和Y必须满足的条件是:____ _ 。
⑷向C的澄清液中加入1mol/L的硫酸,当加至50mL时才开始出现沉淀。假设电解过程中溶液体积变化忽略不计,原X和Y混合液的体积为100ml,原Y溶液的物质的量浓度为amol/L,则原X溶液的物质的量浓度为 mol/L。
化学纠错再练一
参考答案
1 C 2 A 3 D 4AB 5 C 6D 7 BC 8 C
9 本题共10分)
(1)NaCl、AlCl3 、NaOH;(2分,答全3个给2分,答对一个给1分,只要错一个就不给分)
(2)Al3+ + 3AlO2-+ 6H2O == 4Al(OH)3↓;(2分)
;(2分)
(3)n(X):n(Y)≥1 (2分)
(4)a+1 (2分