- 512.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2013年普通高等学校招生全国统一考试(浙江卷)
理科综合 化学试题
元素
H
C
N
O
Na
Al
S
Cl
K
Cr
Fe
Cu
I
相对原子质量
1
12
14
16
23
27
32
35.5
39
52
56
64
127
一、选择题(本题共16小题,每小题6分,共120分,每小题只有一项是符合题目要求的)
7.[13.浙]下列说法不正确的是
A.多孔碳可用作氢氧燃料电池的电极材料
B.pH计不能用于酸碱中和滴定终点的判断
C.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素
D.和CO2反应生成可降解聚合物,反应符合绿色化学的原则
8.[13.浙]下列说法正确的是
A.实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取
B.用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度
C.Cl-存在时,铝表面的氧化膜易被破坏,因此含盐腌制食品不宜直接存放在铝制容器中
D.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性
9.[13.浙]短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是
A.钠与W可能形成Na2W2化合物
B.由Z和Y组成的物质在熔融时能导电
C.W得电子能力比Q强
D.X有多种同素异形体,而Y不存在同素异形体
10.下列说法正确的是
A.按系统命名法,化合物的名称是2,3,5,5-四甲基-4,4-二乙基己烷
B.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C.苯和甲苯互为同系物,均能使KMnO4酸性溶液褪色
D.结构片段的高聚物,其单体是苯酚和甲醛
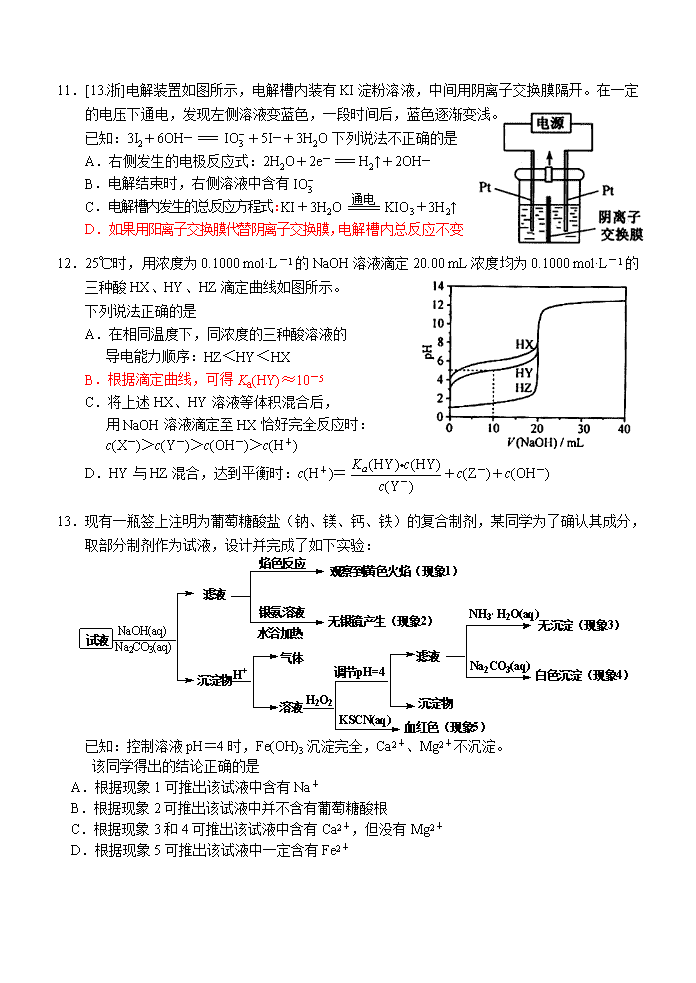
11.[13.浙]电解装置如图所示,电解槽内装有KI淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
已知:3I2+6OH―=+5I―+3H2O下列说法不正确的是
A.右侧发生的电极反应式:2H2O+2e-=H2↑+2OH―
B.电解结束时,右侧溶液中含有
C.电解槽内发生的总反应方程式:KI+3H2OKIO3+3H2↑
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内总反应不变
12.25℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ滴定曲线如图所示。
下列说法正确的是
A.在相同温度下,同浓度的三种酸溶液的
导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10-5
C.将上述HX、HY溶液等体积混合后,
用NaOH溶液滴定至HX恰好完全反应时:
c(X-)>c(Y-)>c(OH-)>c(H+)
D.HY与HZ混合,达到平衡时:c(H+)=+c(Z-)+c(OH-)
13.现有一瓶签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:
已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是
A.根据现象1可推出该试液中含有Na+
B.根据现象2可推出该试液中并不含有葡萄糖酸根
C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D.根据现象5可推出该试液中一定含有Fe2+
卷Ⅱ(非选择题)
26.[15分]氢能源是一种重要清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的H2(已折算成标准状况)。甲与水反应也能放出H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25 g·L-1。请回答下列问题:
(1)甲的化学式是 ;乙的电子式是 。
(2)甲与水反应的化学方程式是 。
(3)气体丙与金属镁反应的产物是 (用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式 。有人提出产物Cu中可能还混有Cu2O,请设计实验方案验证之 。
(已知:Cu2O+2H+=Cu+Cu2++H2O)
(5)甲与乙之间 (填“可能”或“不可能”)发生反应产生H2,
判断理由是 。
27.[14分]捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。
目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)(NH4)2CO3(aq) △H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) (NH4)2HCO3(aq) △H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)2(NH4)2HCO3(aq) △H3
请回答下列问题:
(1)△H3与△H1、△H2之间的关系是:△H3 。
(2)为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1)。则:
①△H3 0(填>、=或<)。
②在T1~T2及T4~T5二个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,
其原因是 。
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示。当时间到达t1时,将该反应体系温度上升到T2,并维持该温度。请在图中画出t1时刻后溶液的pH变化总趋势曲线。
(3)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有 (写出2个)。
(4)下列物质中也可能作为CO2捕获剂的是 。
A.NH4Cl B.Na2CO3 C.HOCH2CH2OH D.HOCH2CH2NH2
28.[14分]利用废旧锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:
已知:Zn及化合物的性质与Al及化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧锌铁皮的作用有 。
A.去除油污 B.溶解镀锌层 C.去除铁锈 D.钝化
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是 。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,原因是 。
(4)Fe3O4胶体粒子能否用减压过滤发实现固液分离? (填“能”或“不能”),理由是 。
(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取 g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。
配制该标准溶液时,下列仪器中不必要用到的有 。(用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
(6)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将 (填“偏大”、“偏小”或“不变”)。
29.[15分]某课题组以苯为主要原料,采用以下路线合成利胆药—柳胺酚。
已知:。请回答下列问题:
(1)对于柳胺酚,下列说法正确的是 。
A.1 mol柳胺酚最多可以和2 molNaOH反应 B.不发生硝化反应
C.可发生水解反应 D.可与溴发生取代反应
(2)写出A→B反应所需的试剂 。
(3)写出B→C的化学方程式 。
(4)写出化合物F的结构简式 。
(5)写出同时符合下列条件的F的同分异构体的结构简式 (写出3种)。
①属酚类化合物,且苯环上有三种不同化学环境的氢原子;②能发生银镜反应。
(6)以苯和乙烯为原料可合成聚苯乙烯,请设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下实例流程图:
CH3CHOCH3COOHCH3COOCH2CH3
15.《物质结构与性质》模块[10分]
请回答下列问题:
(1)N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
电离能 I1 I2 I3 I4 ……
In/kJ.mol-1 578 1817 2745 11578 ……
则该元素是 ① (填写元素符号)。
(2)基态锗(Ge)原子的电子排布式是 ② 。
Ge的最高价氯化物分子式是 ③ 。
该元素可能的性质或应用有 ④ 。
A.是一种活泼的金属元素 B.其电负性大于硫
C.其单质可作为半导体材料 D.其最高价氯化物的沸点低于其溴化物的沸点
(3)关于化合物,下列叙述正确的有 ⑤ 。
A.分子间可形成氢键 B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键 D.该分子在水中的溶解度大于2-丁烯
(4)NaF的熔点 ⑥ 的熔点(填>、=或<),
其原因是 ⑦ 。
16.《化学与技术》模块[10分]
电石浆是氯碱工业中的一种废弃物,其大致组成如下表所示:
成分
CaO
SiO2
Al2O3
Fe2O3
MgO
CaS
其它不溶于酸的物质
质量分数(%)
65~66
3.5~5.0
1.5~3.5
0.2~0.8
0.2~1.1
1.0~1.8
23~26
用电石浆可生产无水CaCl2,某化工厂设计了以下工艺流程:
已知氯化钙晶体化学式是:CaCl2·6H2O,H2S是一种酸性气体,具有还原性。
(1)反应器中加入的酸应选用 ① 。
(2)脱色槽中应加入的物质X是 ② ;设备A的作用是 ③ ;
设备B的名称是 ④ ;设备C的作用是 ⑤ 。
(3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是 ⑥ 。
A.水 B.浓硫酸 C.石灰乳 D.硝酸
(4)将设备B中产生的母液重新引入反应器的目的是 ⑦ 。
2013普通高等学校招生全国统一考试(浙江卷)
理科综合 化学答案
一、选择题(本题共17小题,每小题6分,每小题只有一项是符合题目要求的)
7
8
9
10
11
12
13
B
C
A
D
D
B
C
26.[15分]
(1)AlH3
(2)AlH3+3H2O=Al(OH)3↓+3H2↑
(3)Mg3N2
(4)3CuO+2NH3N2+3Cu+3H2O
取样后加H2SO4,如果溶液变蓝,说明产物中含有Cu2O,反之则无Cu2O。
(5)可能;AlH3中的H为-1价,NH3中的H为+1价,有可能发生氧化还原反应生成氢气。
27.[14分]
(1)2△H2-△H1
(2)①<;
②T1-T2区间,化学反应未达到平衡状态,温度越高,化学反应速率越快,所以CO2被捕获的量随着温度的升高而提高。T3-T4区间,化学反应已达到平衡状态,由于正反应为放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2的捕获。
③
(3)降低温度;增大CO2浓度(或分压)。
(4)B、D
28.[14分]
(1)A、B
(2)抽滤、洗涤、灼烧
(3)N2气氛下,防止Fe2+被氧化
(4)胶体粒子太小,抽滤时容易透过滤纸
(5)0.7350 ③⑦
(6)偏大
29.[15分]
(1)C、D
(2)浓HNO3/浓H2SO4
(3)
(4)
(5);;;(任意三种即可)
(6)
15.《物质结构与性质》模块[10分]
(1)①Al
(2)②1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p2 ③GeCl4 ④CD
(3)⑤BD
(4)⑥>;
⑦两者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低。
16.《化学与技术》模块[10分]
(1)①盐酸
(2)②活性炭 ③蒸发浓缩 ④过滤器 ⑤脱水干燥
(3)⑥C
(4)⑦对母液回收利用,降低废弃物排放量,提高经济效益。
特此鸣谢:浙江省化学教师群各位热心群友,通力协作,完成一件有点意思的事情。
2013年6月10日