- 862.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
综合训练(四) 化学反应原理
1.(2018·镇海中学模拟)下列过程吸收热量的是( )
A.钢铁生锈 B.钠与水反应
C.碳酸钙分解 D.黑火药爆炸
2.(2018·淳安中学模拟)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物时的数据)。根据能量变化示意图,下列热化学方程式正确的是( )
A.Cl2(g)+P(s)PCl3(g)
ΔH=+306 kJ·mol-1
B.3Cl2(g)+2P(s)2PCl3(g)
ΔH=-306 kJ·mol-1
C.PCl5(g)PCl3(g)+Cl2(g)
ΔH=+93 kJ·mol-1
D.PCl5(g)PCl3(g)+Cl2(g)
ΔH=-93 kJ·mol-1
3.(2018·余姚中学模拟)下列各组热化学方程式的ΔH前者大于后者的是( )
①C(s)+O2(g)CO2(g) ΔH1
C(s)+O2(g)CO(g) ΔH2
- 9 -
②S(s)+O2(g)SO2(g) ΔH3
S(g)+O2(g)SO2(g) ΔH4
③H2(g)+O2(g)H2O(l) ΔH5
2H2(g)+O2(g)2H2O(l) ΔH6
④CaCO3(s)CaO(s)+CO2(g) ΔH7
CaO(s)+H2O(l)Ca(OH)2(aq) ΔH8
A.① B.④
C.②③④ D.①②③
4.(2018·杭州模拟)根据热化学方程式:S(g)+O2(g)SO2(g) ΔH=-Q kJ·mol-1,下列分析正确的是( )
A.1 mol S(g)与1 mol O2(g)的总能量比1 mol SO2(g)的总能量低Q kJ
B.1 mol S(g)与1 mol O2(g)反应生成1 mol SO2(g)放出Q kJ的热量
C.S(s)+O2(g)SO2(g) ΔH<-Q kJ·mol-1
D.1个S(g)与1个O2(g)完全反应可以放出Q kJ的热量
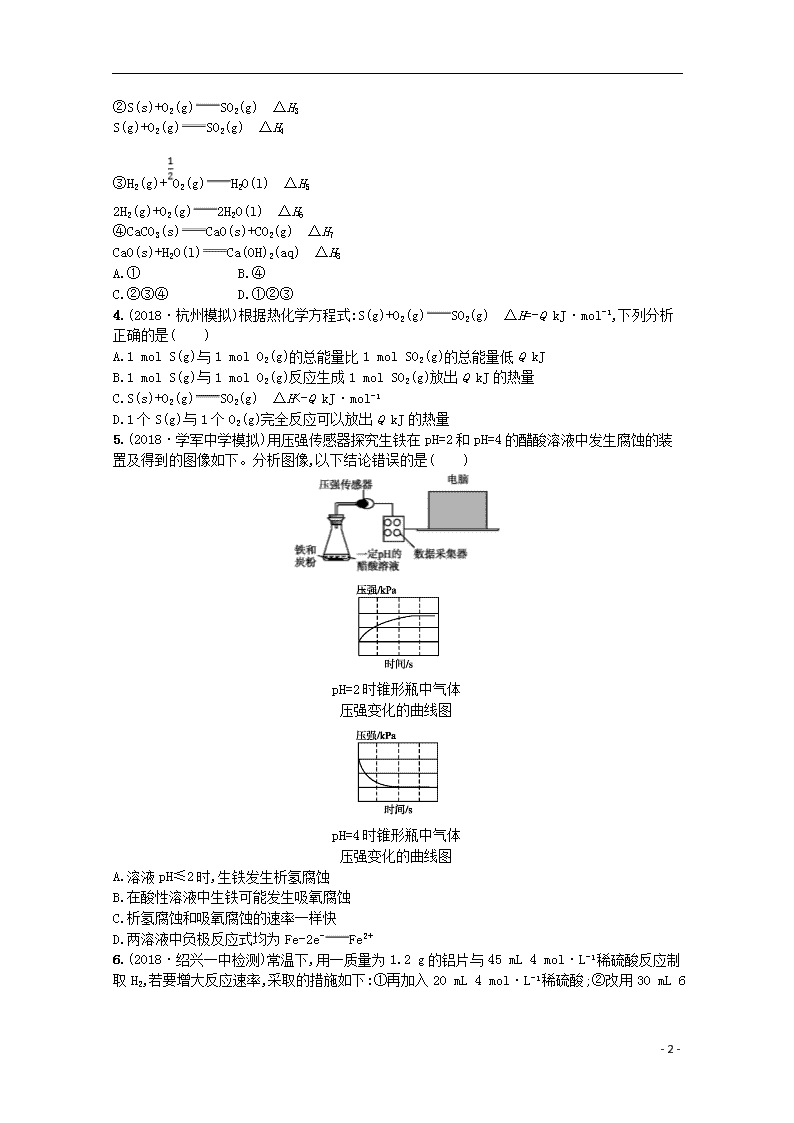
5.(2018·学军中学模拟)用压强传感器探究生铁在pH=2和pH=4的醋酸溶液中发生腐蚀的装置及得到的图像如下。分析图像,以下结论错误的是( )
pH=2时锥形瓶中气体
压强变化的曲线图
pH=4时锥形瓶中气体
压强变化的曲线图
A.溶液pH≤2时,生铁发生析氢腐蚀
B.在酸性溶液中生铁可能发生吸氧腐蚀
C.析氢腐蚀和吸氧腐蚀的速率一样快
D.两溶液中负极反应式均为Fe-2e-Fe2+
6.(2018·绍兴一中检测)常温下,用一质量为1.2 g的铝片与45 mL 4 mol·L-1稀硫酸反应制取H2,若要增大反应速率,采取的措施如下:①再加入20 mL 4 mol·L-1稀硫酸;②改用30 mL 6
- 9 -
mol·L-1的稀硫酸;③改用20 mL 18 mol·L-1浓硫酸;④改用1.2 g铝粉代替1.2 g铝片;⑤适当升高温度;⑥在敞口容器中反应。其中正确的是( )
A.①②③④ B.②④⑤
C.②③④⑤ D.②③④⑤⑥
7.(2018·台州测评)在恒容密闭容器中发生反应H2(g)+I2(g)2HI(g) ΔH=-9.4 kJ·mol-1,下列说法能说明该反应一定达到平衡状态的是( )
A.混合气体的总分子数不再发生变化
B.混合气体的颜色不再发生变化
C.反应放出的热量为9.4 kJ
D.n(H2)∶n(I2)∶n(HI)=1∶1∶2
8.(2018·绍兴模拟)工业制备氮化硅的反应为3SiCl4(g)+2N2(g)+6H2(g)Si3N4(s)+12HCl(g) ΔH<0,将0.3 mol SiCl4和一定量N2、H2投入2 L反应容器中,只改变温度条件测得Si3N4的质量变化如下表所示:
时间/
质量/gmin
温度/℃
0
1
2
3
4
5
6
250
0.00
1.52
2.80
3.71
4.73
5.60
5.60
300
0.00
2.13
3.45
4.48
4.48
4.48
4.48
下列说法正确的是( )
A.250 ℃时,前2 min内Si3N4的平均反应速率为0.02 mol·L-1·min-1
B.反应达到平衡状态时,两种温度下N2和H2的转化率之比相同
C.达到平衡状态前,300 ℃时的反应速率比250 ℃时大;达到平衡状态后,300 ℃时的反应速率比250 ℃时小
D.反应达到平衡状态时,250 ℃和300 ℃时反应放出的热量一样多
9.(2018·浙江七彩阳光联考)下列与盐类水解无关的是( )
A.为保存FeCl3溶液,要在溶液中加少量盐酸
B.热的纯碱溶液可用于除去物品表面的油污
C.铵态氮肥和草木灰(主要成分碳酸钾)不能混合使用
D.配制FeCl2溶液时需要向溶液中加少量铁粉
10.常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液,含A元素的有关微粒物质的量变化如下图所示。根据图示判断,下列说法正确的是( )
A.H2A在水中的电离方程式是:H2AH++HA-,HA-H++A2-
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C.当V(NaOH溶液)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
D.当V(NaOH溶液)=20 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(OH-)
11.常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
- 9 -
A.Ka2(H2X)的数量级约为10-6
B.曲线N表示pH与lg的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
12.(2018·嘉兴模拟)CO2可作为合成低碳烯烃的原料加以利用。如:
2CO2(g)+6H2(g)CH2CH2(g)+4H2O(g) ΔH=a kJ·mol-1
图1
图2
图1表示在体积为1 L的恒容容器中,投料为3 mol H2和1 mol CO2时,测得的温度对CO2的平衡转化率和催化剂催化效率的影响的曲线图。
已知:表示H2和CH2CH2的标准燃烧热的ΔH分别是-285.8 kJ·mol-1和-1 411.0 kJ·mol-1;
H2O(g)H2O(l) ΔH=-44 kJ·mol-1。
请回答:
(1)a= 。
(2)上述由CO2合成CH2CH2的反应在 (填“高温”或“低温”)下自发进行,理由是 。
(3)计算250 ℃时该反应平衡常数的数值K= 。
(4)下列说法正确的是 。
a.平衡常数大小:M>N
b.反应物活化分子百分数大小:M>N
c.其他条件不变,若不使用催化剂,则250 ℃时CO2的平衡转化率可能位于M1点
- 9 -
d.其他条件不变,若投料改为4 mol H2和1 mol CO2时,则250 ℃时CO2的平衡转化率可能位于M2点
e.当压强、混合气体的密度或不变时均可视为化学反应已达到平衡状态
(5)保持某温度(大于100 ℃)不变,在体积为V L的恒容容器中以n(H2)∶n(CO2)=3∶1的投料比加入反应物,至t0时达到化学平衡。t1时将容器体积瞬间扩大至2V L并保持不变,t2时重新达平衡。在图2中作出容器内混合气体的平均相对分子质量随时间变化的图像。
13.氨是一种重要的化工原料,在工农业生产中有广泛的应用。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)2NH3(g)。该可逆反应达到平衡状态的标志是 。
A.3v正(H2)=2v逆(NH3)
B.单位时间生成m mol N2的同时生成3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
(2)工业上可用天然气原料来制取合成氨的原料气——氢气。某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2 L的恒容密闭容器中测得如下表所示数据。请回答下列问题:
时间/min
CH4/mol
H2O/mol
CO/mol
H2/mol
0
0.40
1.00
0
0
5
a
0.80
c
0.60
7
0.20
b
0.20
d
10
0.21
0.81
0.19
0.64
①分析表中数据,判断5 min时反应是否处于平衡状态? (填“是”或“否”),前5 min反应的平均反应速率v(CH4)= 。
②反应在7~10 min内,CO的物质的量减少的原因可能是 (填字母)。
A.减少CH4的物质的量
B.降低温度
C.升高温度
D.充入H2
(3)氨的催化氧化:4NH3+5O2(g)4NO(g)+6H2O(g)是工业制硝酸的重要反应。在1 L密闭容器中充入4 mol NH3(g)和5 mol O2(g),保持其他条件不变,测得c(NO)与温度的关系如图所示。该反应的ΔH (填“>”“<”或“=”)0;T0温度下,NH3的转化率为 。
14.检测血液中的Ca2+能够帮助判断多种疾病。某研究小组测定血液样品中Ca2+的含量(100 mL血液中含Ca2+的质量),实验步骤如下:
- 9 -
①准确量取5.00 mL血液样品,处理后配制成50.00 mL溶液;
②准确量取溶液10.00 mL,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入12.00 mL 0.001 0 mol·L-1的KMnO4溶液,使H2C2O4完全被氧化,离子方程式为
2Mn+5H2C2O4+6H+10CO2↑+2Mn2++8H2O;
⑤用0.002 0 mol·L-1 (NH4)2Fe(SO4)2溶液滴定过量的KMnO4溶液,消耗(NH4)2Fe(SO4)2溶液的体积如图所示,反应的离子方程式为Mn+5Fe2++8H+5Fe3++Mn2++4H2O。
回答下列问题:
(1)已知H2C2O4属于二元弱酸,下列说法正确的是 。
A.H2C2O4溶液中:c(H+)=c(HC2)+c(C2)+c(H2C2O4)
B.相同温度下,等物质的量浓度的(NH4)2C2O4溶液和(NH4)2Fe(SO4)2溶液,c(N)前者小于后者
C.(NH4)2C2O4溶液中:c(N)+c(NH3·H2O)=2c(HC2)+2c(C2)+2c(H2C2O4)
D.(NH4)2Fe(SO4)2溶液中:c(S)>c(N)>c(Fe2+)>c(OH-)>c(H+)
(2)实验中发现向草酸溶液中逐滴加入酸性高锰酸钾溶液,溶液褪色速度开始时缓慢,一段时间后迅速加快,利用水浴使反应液保持恒温时也是如此,出现该现象的可能原因是
。
(3)12.00 mL 0.001 0 mol·L-1的KMnO4溶液应用 (填“酸式”或“碱式”)滴定管量取。
(4)到达滴定终点时的现象是
。
(5)若步骤⑤滴定管在使用前用蒸馏水洗后未用标准(NH4)2Fe(SO4)2溶液洗涤,测得血液中Ca2+的含量将 (填“偏高”“偏低”或“无影响”)。
(6)血样中Ca2+的含量为 g/100 mL。
参考答案
综合训练(四) 化学反应原理
1.C A项,钢铁生锈属于缓慢氧化过程,放出热量;B项,钠与水反应放出热量;C项,碳酸钙分解吸收热量;D项,黑火药爆炸放出热量。
2.C 根据能量变化示意图可知热化学方程式:Cl2(g)+P(s)PCl3(g) ΔH=-306kJ·mol-1,同理得PCl5(g)PCl3(g)+Cl2(g) ΔH=+93kJ·mol-1,C项正确。
- 9 -
3.C ΔH有正、负之分,比较时要连同“+”“-”在内一起比较,类似数学中的正、负数大小的比较。①中第一个热化学方程式减去第二个热化学方程式可得:CO(g)+O2(g)CO2(g) ΔH=ΔH1-ΔH2,该反应为放热反应,即ΔH1-ΔH2<0,所以ΔH1<ΔH2;②等量的固态硫变为硫蒸气时吸收热量,故在与O2反应产生相同量的SO2时,气态硫放出的热量多,即ΔH3>ΔH4;③发生同样的燃烧反应,反应物的物质的量越多,放出的热量越多,故ΔH5>ΔH6;④CaCO3分解吸收热量,ΔH7>0,CaO与H2O反应放出热量,ΔH8<0,显然ΔH7>ΔH8。
4.B 该热化学方程式的含义为1molS(g)与1molO2(g)反应生成1molSO2(g)放出QkJ的热量,B项正确、D项错误;反应物的总能量比生成物的总能量高,A项错误;因为S(s)S(g)吸热,所以,S(s)+O2(g)SO2(g) ΔH>-QkJ·mol-1,C项错误。
5.C 根据pH=2时锥形瓶中气体压强与时间的关系曲线,可知锥形瓶中气体压强随着反应的进行而逐渐增大,说明该装置发生析氢腐蚀,则溶液pH≤2时,生铁发生析氢腐蚀,故A正确;pH=4时锥形瓶中气体压强随着反应的进行而逐渐减小,说明生铁发生吸氧腐蚀,pH=4的醋酸溶液呈酸性,所以在酸性溶液中生铁可能发生吸氧腐蚀,故B正确;根据锥形瓶中气体压强与时间关系图,可知pH=2的溶液和pH=4的溶液中,变化相同的压强时所用时间不同,前者比后者使用时间长,说明吸氧腐蚀速率大于析氢腐蚀速率,故C错误;pH=2的醋酸溶液和pH=4的醋酸溶液中都发生电化学腐蚀,铁均作负极,电极反应式为Fe-2e-Fe2+,故D正确。
6.B ①未增大c(H2SO4),反应速率不改变;③常温下,用18mol·L-1的浓硫酸会使铝发生钝化,若加热则发生反应,但不产生H2;⑥在敞口容器中反应,H2逸出并不影响反应速率。
7.B A项,该反应前后气体物质的量不变,混合气体的总分子数不再发生变化,反应不一定达到平衡状态,错误;B项,混合气体的颜色不再发生变化,说明I2(g)浓度不变,反应一定达到平衡状态,正确;C项,反应放出的热量为9.4kJ,不一定反应不再进行,错误;D项,n(H2)∶n(I2)∶n(HI)=1∶1∶2,各物质的物质的量不一定不再变化,错误。
8.B A项,Si3N4是固体,没有浓度变化,无法用浓度变化来表示反应速率,错误;B项,两种温度下,起始加入的N2、H2的比例相同,反应中消耗的N2、H2的比例也相同,所以N2、H2的转化率之比相同,正确;C项,升高温度,反应速率增大,即反应速率:300℃>250℃,错误;D项,由于反应达到平衡状态时,两种温度下反应生成的Si3N4的物质的量不同,所以反应放出的热量不同,错误。
9.D A项,由于在水溶液中存在Fe3+的水解:Fe3++3H2OFe(OH)3+3H+,为抑制Fe3+的水解,应加少量盐酸,不符合题意;B项,加热纯碱溶液,能促进纯碱水解,溶液碱性增强,去污能力增强,不符合题意;C项,碳酸钾水解显碱性,能与铵态氮肥反应降低肥效,不符合题意;D项,实验室配制FeCl2溶液时需加入少量铁粉,目的是为了防止亚铁离子被氧化,与水解无关,符合题意。
10.D 0.2mol·L-1H2A溶液c(H+)<0.4mol·L-1,则H2A在溶液中部分电离,为弱酸,H2A在水中的电离方程式是:H2AH++HA-、HA-H++A2-,故A错误;等体积等浓度的NaOH溶液与H2A溶液混合后生成NaHA,HA-电离程度大于水解程度,对水的电离有抑制作用,故B错误;当V(NaOH溶液)=30mL时,发生反应为NaOH+H2ANaHA+H2O、NaHA+NaOHNa2A+H2O,溶液主要为等物质量的NaHA、Na2A的混合溶液,根据电荷守恒得:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-)①,由物料守恒可知:3c(HA-)+3c(A2-)+3c(H2A)=2c(Na+)②,①×2+②得:2c(H+)-2c(OH-)=c(A2-)-3c(H2A)-c(HA-),故C错误;当V(NaOH溶液)=20mL时,发生反应为NaOH+H2ANaHA+H2O,溶质为NaHA,HA-电离程度大于水解程度,溶液显酸性,则c(Na+)>c(HA-)>c(H+)>c(OH-),故D正确;故选D。
- 9 -
11.D 由图像可知,当lg=0时,则c(HX-)=c(H2X),H2XHX-+H+,Ka1(H2X)==c(H+)=10-4.4,当lg=0时,则c(X2-)=c(HX-),HX-X2-+H+,Ka2(H2X)==c(H+)=10-5.4。A选项,由上述计算可知,Ka2=10-5.4≈4×10-6,即数量级为10-6,正确;B选项,由曲线M可得Ka2(H2X),即曲线M对应lg,由曲线N可得Ka1(H2X),即曲线N对应lg,正确;C选项,在NaHX溶液中,HX-既存在电离,也存在水解;电离平衡为HX-X2-+H+;水解平衡为H2O+HX-H2X+OH-,Kh==10-9.9c(OH-),正确;D选项,当溶液呈中性时,c(H+)=c(OH-)=10-7mol·L-1,而=Ka2(H2X)=10-5.4,=101.6,即c(X2-)>c(HX-),故D错误。
12.答案: (1)-127.8
(2)低温 该反应的ΔH<0,ΔS<0,则反应在低温下自发进行
(3)0.088 (4)ad
(5)
解析: (1)表示H2的标准燃烧热的热化学方程式为①H2(g)+O2H2O(l) ΔH=-285.8kJ·mol-1;表示CH2CH2的标准燃烧热的热化学方程式为②CH2CH2(g)+3O22CO2(g)+2H2O(l) ΔH=-1411.0kJ·mol-1;③H2O(g)H2O(l) ΔH=-44kJ·mol-1;根据盖斯定律由①×6-②-③×4可得2CO2(g)+6H2(g)CH2CH2(g)+4H2O(g)
ΔH=6×(-285.8kJ·mol-1)-(-1411.0kJ·mol-1)-4×(-44kJ·mol-1)=-127.8kJ·mol-1。(2)由CO2合成CH2CH2的反应为2CO2(g)+6H2(g)CH2CH2(g)+4H2O(g)
ΔH=-127.8kJ·mol-1,该反应ΔH<0,ΔS<0,所以低温下反应自发进行。(3)由图可知,250℃时CO2的平衡转化率为50%,则
- 9 -
2CO2(g)+6H2(g)CH2CH2(g)+4H2O(g)
1 3 0 0
0.5 1.5 0.25 1.0
0.5 1.5 0.25 1.0
平衡常数K=≈0.088。
(4)a项,该反应正方向为放热反应,升高温度,平衡逆向移动,所以平衡常数大小:M>N,正确;b项,温度越高,反应物活化分子百分数越大,N点的温度高,所以反应物活化分子百分数大小:M