- 393.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
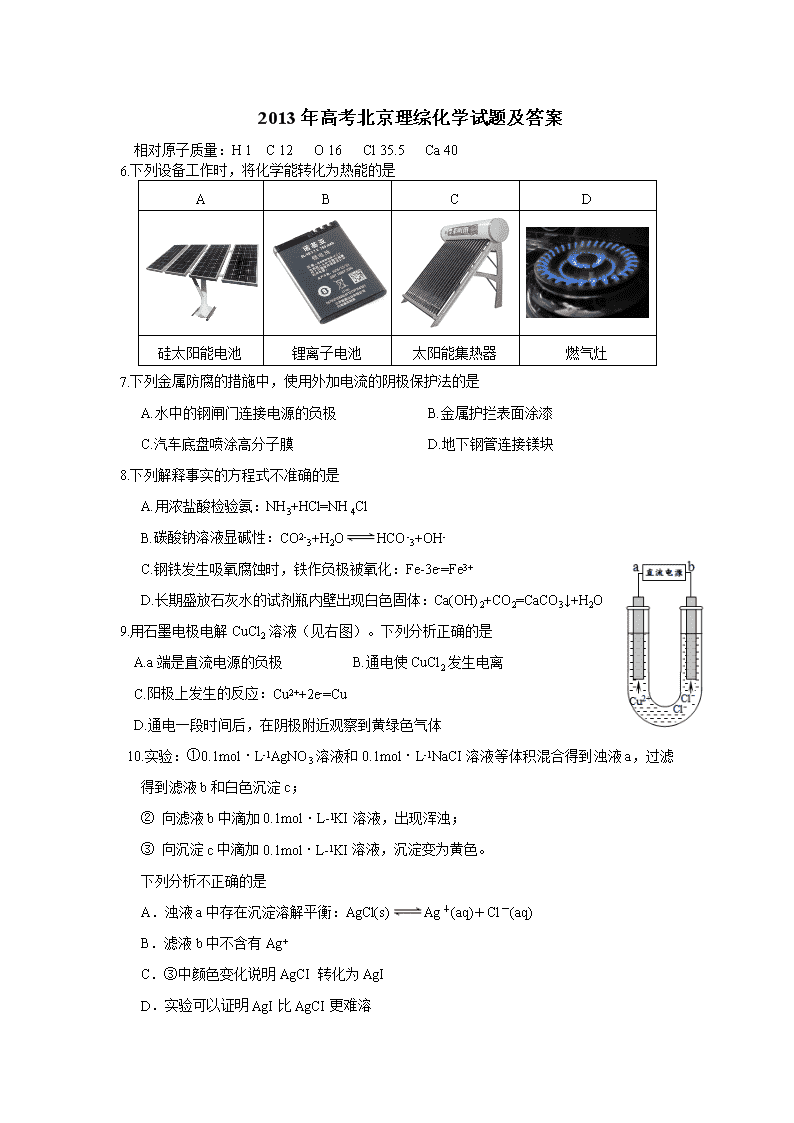
2013年高考北京理综化学试题及答案
相对原子质量:H 1 C 12 O 16 Cl 35.5 Ca 40
6.下列设备工作时,将化学能转化为热能的是
A
B
C
D
硅太阳能电池
锂离子电池
太阳能集热器
燃气灶
7.下列金属防腐的措施中,使用外加电流的阴极保护法的是
A.水中的钢闸门连接电源的负极 B.金属护拦表面涂漆
C.汽车底盘喷涂高分子膜 D.地下钢管连接镁块
8.下列解释事实的方程式不准确的是
A.用浓盐酸检验氨:NH3+HCl=NH4Cl
B.碳酸钠溶液显碱性:CO2-3+H2OHCO-3+OH-
C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O
9.用石墨电极电解CuCl2溶液(见右图)。下列分析正确的是
A.a端是直流电源的负极 B.通电使CuCl2发生电离
C.阳极上发生的反应:Cu2++2e-=Cu
D.通电一段时间后,在阴极附近观察到黄绿色气体
10.实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCI溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
② 向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;
③ 向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。
下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCI 转化为AgI
D.实验可以证明AgI比AgCI更难溶
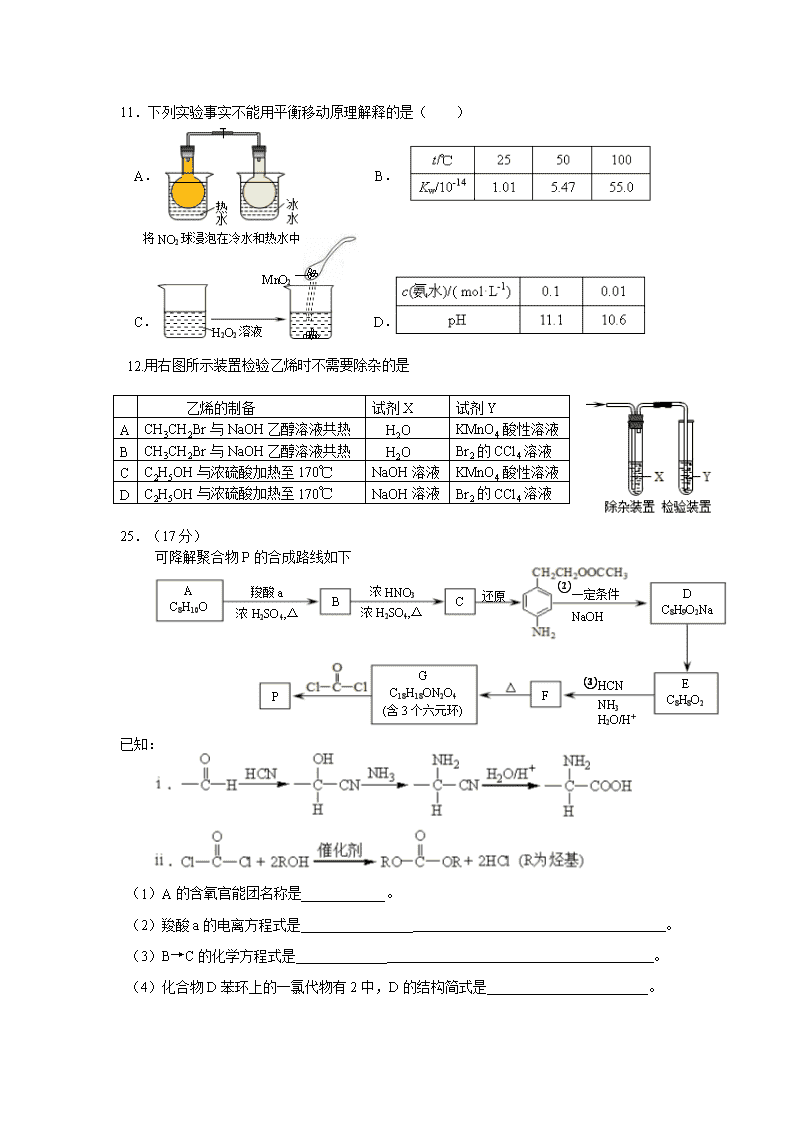
11.下列实验事实不能用平衡移动原理解释的是( )
A. B.
将NO2球浸泡在冷水和热水中
H2O2溶液
MnO2
C. D.
12.用右图所示装置检验乙烯时不需要除杂的是
乙烯的制备
试剂X
试剂Y
A
CH3CH2Br与NaOH乙醇溶液共热
H2O
KMnO4酸性溶液
B
CH3CH2Br与NaOH乙醇溶液共热
H2O
Br2的CCl4溶液
C
C2H5OH与浓硫酸加热至170℃
NaOH溶液
KMnO4酸性溶液
D
C2H5OH与浓硫酸加热至170℃
NaOH溶液
Br2的CCl4溶液
25.(17分)
可降解聚合物P的合成路线如下
羧酸a
浓H2SO4,△
浓HNO3
浓H2SO4,△
还原
①一定条件
②NaOH
A
C8H10O
D
C8H9O2Na
E
C8H8O2
G
C18H18ON2O4
(含3个六元环)
①HCN
②NH3
③H2O/H+
B
C
F
P
已知:
(1)A的含氧官能团名称是____________。
(2)羧酸a的电离方程式是________________ 。
(3)B→C的化学方程式是_____________ 。
(4)化合物D苯环上的一氯代物有2中,D的结构简式是___________ 。
(5)E→F中反应①和②的反应类型分别是___________ 。
(6)F的结构简式是_____________ 。
(7)聚合物P的结构简式是________________ 。
26.(14分)
NOx是汽车尾气中的主要污染物之一。
(1) NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_ .
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
498kJ·mol-1
945kJ·mol-1
2×(-630kJ·mol-1
)
N2(g) 2N(g)
2NO(g)
O2(g) 2O(g)
①写出该反应的热化学方程式: _ .
②随温度升高,该反应化学平衡常数的变化趋势是_ .。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放。
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:_ .
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐。其吸收能力顺序如下:12MgO <2oCaO <38SrO<56BaO.原因是 .,元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: .
27.(12分)
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ、向铝灰中加入过量稀H2SO4,过滤:
Ⅱ、向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ、加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ、加入MnSO4至紫红色消失,过滤;
Ⅴ、浓缩、结晶、分离,得到产品。
(1) H2S04溶解A1203的离子方程式是
(2) 将MnO4 - 氧化Fe2+的离子方程式补充完整:
1
1
MnO4 -+ Fe2++ = Mn2++ Fe3++
(3)已知:生成氢氧化物沉淀的pH
Al(OH)3
Fe(OH)2
Fe(OH)3
开始沉淀时
3.4
6.3
1.5
完全沉淀时
4.7
8.3
2.8
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的:
(4)已知:一定条件下,MnO4 - 可与Mn2+反应生成MnO2,
① 向 Ⅲ 的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是
.
② Ⅳ 中加入MnSO4的目的是
28.(15分)
某学生对SO2与漂粉精的反应进行实验探究:
操作
现象
取4g漂粉精固体,加入100mL水
部分固体溶解,溶液略有颜色
过滤,测漂粉精溶液的pH
pH试纸先变蓝(约为12),后褪色
i. 液面上方出现白雾;
ii. 稍后,出现浑浊,溶液变为黄绿色;
iii. 稍后,产生大量白色沉淀,黄绿色褪去
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是 。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是 。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a目的是 。
②由实验a、b不能判断白雾中含有HC1,理由是 。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是
。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是 。
②用离子方程式解释现象iii中黄绿色褪去的原因: 。
6、选择D。
赏析:以图片形式考察能量转变类型。A、硅太阳能电池是将太阳能直接转化为电能,故错误;B、锂离子电池将化学能直接转化为电能,故错误;C、太阳能集热器是将太阳能转变为热能,故错误;D、燃料燃烧将化学能直接转化为热能,故正确。
7、选择A。
赏析:考察电化学知识。A、钢闸门连接电源的负极,为电解池的阴极,被保护,属于外加电流的阴极保护法,故正确;BC、是金属表面覆盖保护层,隔绝空气,故错误D、 镁比铁活泼,构成原电池,铁为正极,被保护,是牺牲阳极的阴极保护法,故错误。
8、选择C。
赏析:考察方程式的正误。A、盐酸具有挥发性,挥发出的HCl与氨气反应生成氯化铵,冒白烟,故正确;B、碳酸钠是强碱弱酸盐,溶液中存在CO2-3水解平衡:CO2-3+H2OHCO-3+OH-,使溶液呈碱性,故正确;C、钢铁发生吸氧腐蚀,铁作负极被氧化,电极反应式为Fe-2e-=Fe2+,故错误;D、石灰水与空气中的二氧化碳反应生成碳酸钙,故正确。
9、选择A。
赏析:考察电解池原理。A、由溶液中离子移动方向可知,U型管左侧电极是阴极,连接电源的负极,a端是电源的负极,故正确;B、通电使CuCl2发生电解,不是电离,故错误;C、阳极发生氧化反应,Cl-在阳极放电2Cl--2e-=C12↑,故错误;D、Cl-发生氧化反应,在阳极放电生成C12,故D错误。
10、选择B。
赏析:考察沉淀溶解平衡。A、绝对不溶的物质没有,难溶物质在溶液中存在沉淀溶解平衡,故正确;B、溶液中存在沉淀溶解平衡,滤液中含有Ag+,故错误;C、D选项沉淀由白色变为黄色,说明生成AgI,反应向更难溶的方向进行,故正确。
11、选择C。
赏析:以图片图表的形式考察化学平衡、电离平衡、催化剂知识。A、存在平衡2NO2N2O4,升高温度平衡向生成NO2方向移动,故正确;B、水的电离是可逆过程,升高温度Kw增大,促进水的电离,故B正确;C、催化剂不能影响平衡移动,故C错误;D、弱电解质电离存在平衡,浓度越稀,电离程度越大,促进电离,但离子浓度降低,故氨水的浓度越稀,pH值越小,故D正确。
12、选择B.
赏析:考察乙烯的制备和检验.A、B选项乙烯中的杂质为乙醇,乙醇可使KMnO4褪色,故必须用水除去。乙醇不能使Br2的CCl4溶液褪色,故不需出去。C、D选项乙烯中杂质为乙醇、SO2和CO2。其中乙醇、SO2均可使KMnO4褪色,故用氢氧化钠溶液除去;尽管乙醇不能使Br2的CCl4溶液褪色,但SO2在有H2O(g)存在的情况下能使Br2的CCl4溶液褪色,故用氢氧化钠溶液除去。故ACD错误,B正确。
25、参考答案
(1)羟基;
(2)CH3COOHCH3COO-+H+;
(3)
(4) ;
(5)加成反应,取代反应;
(6) ;
(7) 。
赏析:以框图合成为载体考察有机化学知识.A不饱和度为=4,结合C的还原产物可知,A中含有一个苯环,能与羧酸a反应酯化反应生成B,a为CH3COOH,A为,B为,反应硝化反应生成C,为,化合物D苯环上的一氯代物有2种,结合与D的分子式可知,首先-NH2被转化-OH,再发生酚羟基与NaOH反应,同时发生酯的水解,D的结构简式是,D发生催化氧化后,再酸化生成E,结合E的分子式可知,醇羟基氧化为-CHO,故E的结构简式为,根据反应信息i可知,E先发生加成反应,再发生取代反应,最后发生水解反应生成F,F为,加热生成G,结合G的分子式与结构特点可知,应是2分子F通过形成肽键再形成1个六元环状,故G为,根据反应信息ii可知,P为;
26、参考答案:
(1)3NO2+2H2O=2HNO3+NO;
(2)①、N2(g)+O2(g)=2NO(g) △H=+183KJ/mol;
②、增大;
(3)①、2NO+2CON2+2CO2
②、由Mg、Ca、Sr、Ba的质子数可知,它们均处于第ⅡA族,同一主族自上而下,原子半径增大;
(4)①、还原;
②、NO+O2--2e-=NO2;
赏析:以除去氮的氧化物为环境考察理论综合,是热化学、平衡理论、电化学理论的综合。
(1)NO2与H2O反应生成HNO3与NO;
(2)①、△H=945kJ/mol+498kJ/mol-2×630KJ/mol=+183KJ/mol;
②、该反应正反应是吸热反应,升高温度,平衡向正反应移动,化学平衡常数增大;
(3)①、NO被CO还原N2,CO被氧化为CO2;
②、由Mg、Ca、Sr、Ba的质子数可知,它们均处于第ⅡA族,同一主族自上而下,原子半径增大,金属性增强;
(4)①、由工作原理示意图可知,O2在Pt电极发生还原反应生成O2-;
②、在O2-参加反应下,NO在NiO电极发生氧化反应生成NO2。
27、参考答案:
(1)Al2O3+6H+===2Al3++3H2O;
(2)5、8H+、5、4H2O;
(3)将Fe2+氧化为Fe3+,调节pH值使铁完全沉淀;
(4)①、生成有黄绿色气体;
②、加入MnSO4,除去过量的MnO4-。
赏析:以工艺流程的形式考察分离提纯的化学知识。
(1)氧化铝与硫酸反应生成硫酸铝与水;
(2)根据电子守恒原理,方程式配平为MnO4-+5 Fe2++8H+=Mn2++5Fe3++4H2O;
(3)滤液中含有Fe2+,由表中数据可知,Fe(OH)2开始沉淀的pH大于Al(OH)3 完全沉淀的pH值,而Fe(OH)3完全沉淀的pH值小于Al(OH)3开始沉淀的pH值,pH值约为3时,Al3+、Fe2+不能沉淀,步骤Ⅱ是将Fe2+氧化为Fe3+,调节pH值使铁完全沉淀;
(4)①、MnO2能将HCl氧化为Cl2,若有黄绿色气体生成说明沉淀中存在MnO2;
②、Ⅲ 的上层液呈紫红色,MnO4-过量,加入MnSO4,除去过量的MnO4-。
28、参考答案:
(1)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(2)碱性、漂白性;
(3)①、检验白雾中是否Cl2,排除Cl2干扰;
②、白雾中含有SO2,SO2可以使酸化的AgNO3溶液产生白色沉淀;
(4)向漂白精溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色;
(5)①、CaSO4;
②、Cl2+SO2+2H2O===4H++2Cl-+SO42-;
赏析:以探究二氧化硫与漂粉精反应情况为背景考察化学实验知识。
(1)Cl2和Ca(OH)2生成氯化钙、次氯酸钙与水;
(2)pH试纸先变蓝(约为12),说明溶液呈碱性,后颜色褪去,说明具有漂白性;
(3)①反应中生成Cl2,用湿润的碘化钾淀粉试纸检验白雾中是否Cl2,排除Cl2干扰;
②白雾中含有SO2,可以被硝酸氧化为硫酸,故SO2可以使酸化的AgNO3溶液产生白色沉淀;
(4)向漂白精溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色;
(5)①取上层清液,加入BaC12溶液,产生白色沉淀,说明SO2被氧化为SO42-,故沉淀X为CaSO4;
②溶液呈黄绿色,有Cl2生成,Cl2与SO2反应生成盐酸与硫酸。
相关文档
- 2017天津高考理科数学试题及答案2021-05-1411页
- 2009-2016历年高考全国理综试卷附2021-05-14157页
- 新课标2010高考生物二轮复习专题十2021-05-1415页
- 高考全国卷1文综试题及答案2021-05-1418页
- 全国高考英语大纲词汇表2021-05-1474页
- (新课标版)2020版高考历史一轮复习 2021-05-1418页
- 2008高考英语全国卷2试卷真题及答2021-05-1447页
- 2009-2013历年高考全国新课标理综2021-05-14121页
- 高考文综北京卷2021-05-1413页
- 2017年全国各地高考英语作文满分范2021-05-1410页