- 3.05 MB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
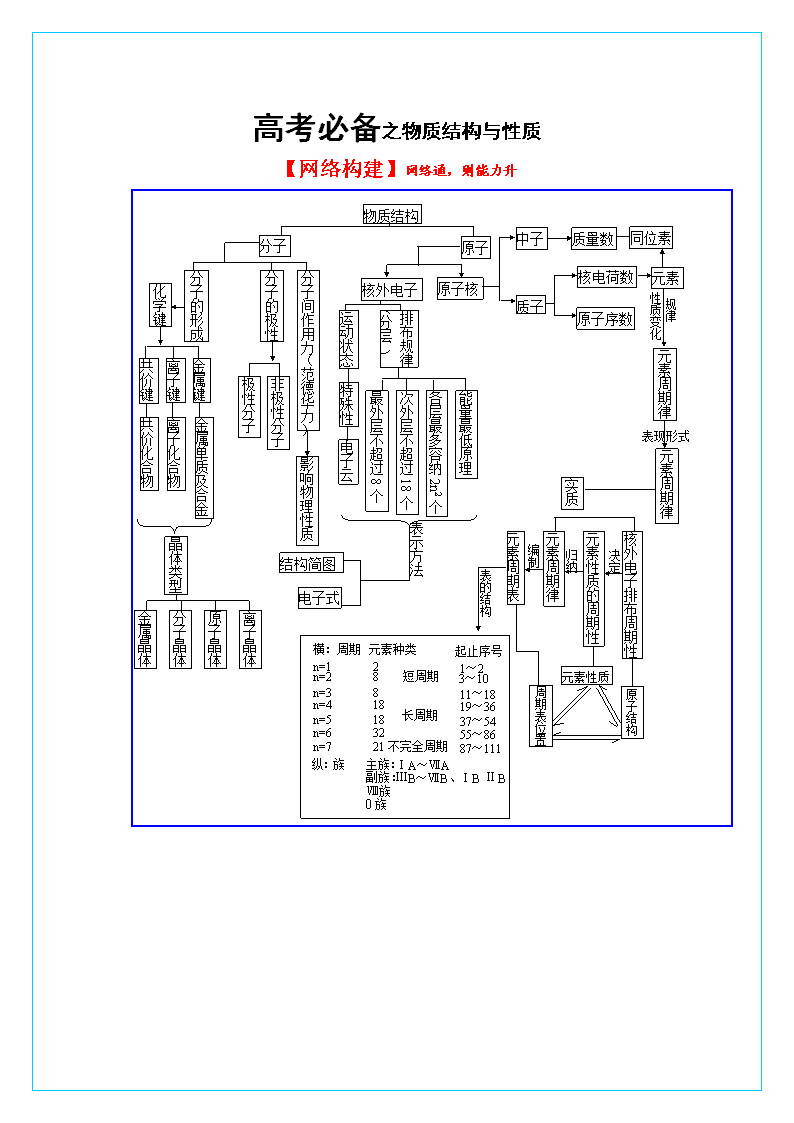
高考必备之物质结构与性质
【网络构建】网络通,则能力升
元素
质子
同位素
中子
分子
物质结构
原子
原子核
核外电子
分子的极性
质量数
分子的形成
原子序数
核电荷数
分子间作用力(范德华力)
离子化合物
离子键
共价键
金属键
极性分子
非极性分子
化学键
影响物理性质
共价化合物
金属单质及合金
运动状态
排布规律(分层 )
特殊性
电子云
元素性质的周期性
最外层不超过8个
次外层不超过18个
各层最多容纳2n2个
能量最低原理
性质变化
规律
元素周期律
元素周期律
表现形式
元素周期律
核外电子排布周期性
晶体类型
金属晶体
分子晶体
原子晶体
离子晶体
表示方法
结构简图
电子式
元素周期表
实质
决定
横:周期
周期表位置
原子结构
元素性质
归纳
编制
表的结构
起止序号
n=1
n=2
n=3
n=6
n=4
n=5
n=7
2
主族:
副族:
元素种类
纵:族
1~2
18
8
3~10
8
11~18
19~36
37~54
18
ⅢB~ⅦB、ⅠB ⅡB
32
55~86
21
87~111
短周期
长周期
不完全周期
21
ⅠA~ⅦA
Ⅷ族
0族
【要点备忘】要点熟,则底气足
原子结构与性质
1.核外电子在排布时遵循以下原理或规则:
(1)构造原理:
从图中可以看出不同能层的能级有交错现象,如E(3d) > E(4s)、E(4d) > E(5s)、E(5d) > E(6s)等。在1~36号元素中,原子核外电子排布不符合构造原理的元素有铬(Cr)、铜(Cu),最外层电子排布为ns1的元素有H、锂、钠、钾、铬、铜。
(2)能量最低原理:原子核外电子的排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。处于最低能量的原子称为基态原子,电子吸收能量后,跃迁至较高能级时称为激发态原子。
(3)泡利(Pauli)(不相容)原理:1个原子轨道里最多只能容纳2个电子且自旋方向相反。
(4)洪特(Hund)规则:当电子排布在同一能层的不同轨道时,总是优先单独占据一个轨道且自旋方向相同;洪特规则的特例当原子轨道处于全空、半满或全满时原子较稳定。
2.元素在周期表中的位置与元素性质的关系
性 质
同周期(从左往右)
同主族(自上而下)
(1)能层数
相同
从1递增到6(或7)
(2)最外层电子数
从1递增到8(第一周期例外)
相同
(3)原子半径
减小(稀有气体除外)
增大
(4)金属性(原子失电子能力)
减弱
增强
(5)非金属性(原子得电子能力)
增强
减弱
(6)电负性
增强
减弱
(7)第一电离能
增大的趋势
减小
(8)单质还原性
减弱
增强
(9)单质氧化性
增强
减弱
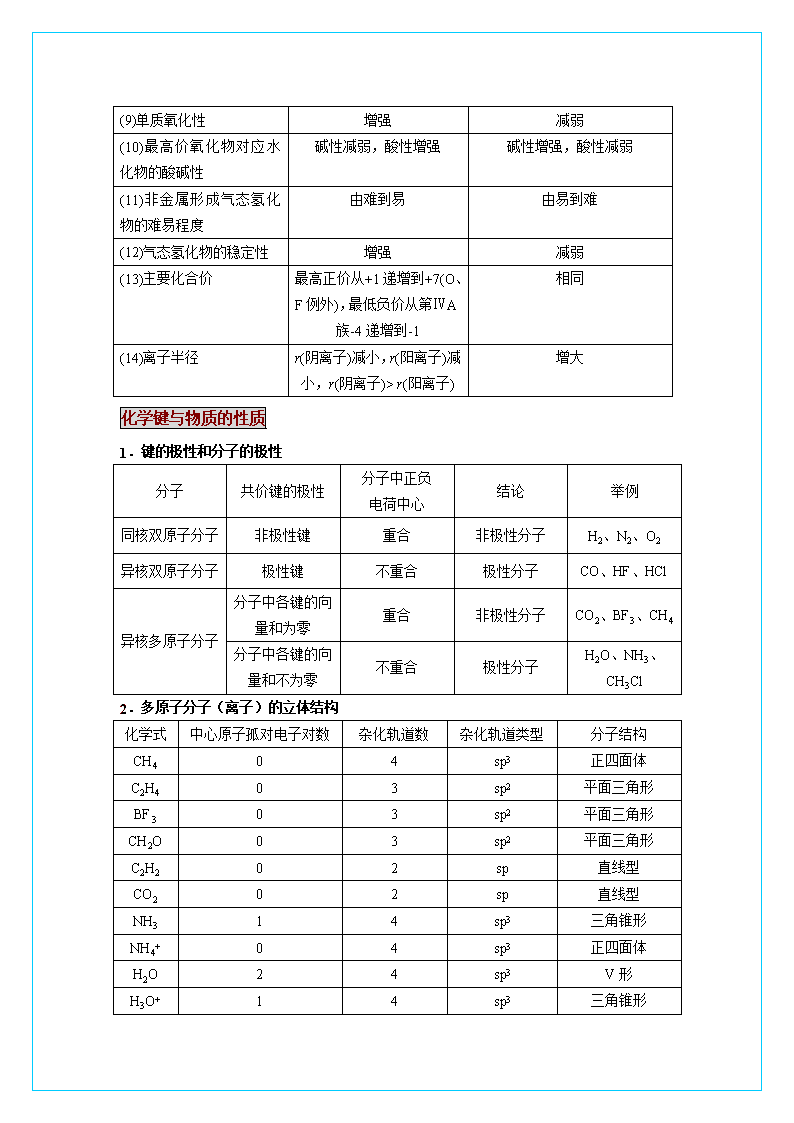
(10)最高价氧化物对应水化物的酸碱性
碱性减弱,酸性增强
碱性增强,酸性减弱
(11)非金属形成气态氢化物的难易程度
由难到易
由易到难
(12)气态氢化物的稳定性
增强
减弱
(13)主要化合价
最高正价从+1递增到+7(O、F例外),最低负价从第ⅣA族-4递增到-1
相同
(14)离子半径
r(阴离子)减小,r(阳离子)减小,r(阴离子)> r(阳离子)
增大
化学键与物质的性质
1.键的极性和分子的极性
分子
共价键的极性
分子中正负
电荷中心
结论
举例
同核双原子分子
非极性键
重合
非极性分子
H2、N2、O2
异核双原子分子
极性键
不重合
极性分子
CO、HF、HCl
异核多原子分子
分子中各键的向量和为零
重合
非极性分子
CO2、BF3、CH4
分子中各键的向量和不为零
不重合
极性分子
H2O、NH3、CH3Cl
2.多原子分子(离子)的立体结构
化学式
中心原子孤对电子对数
杂化轨道数
杂化轨道类型
分子结构
CH4
0
4
sp3
正四面体
C2H4
0
3
sp2
平面三角形
BF3
0
3
sp2
平面三角形
CH2O
0
3
sp2
平面三角形
C2H2
0
2
sp
直线型
CO2
0
2
sp
直线型
NH3
1
4
sp3
三角锥形
NH4+
0
4
sp3
正四面体
H2O
2
4
sp3
V形
H3O+
1
4
sp3
三角锥形
3.价层电子对互斥模型判断简单分子或离子的空间构型
电子对数 目
电子对的空间构型
成键电子对数
孤电子
对 数
电子对的
排列方式
分子的
空间构型
实 例
2
直 线
2
0
直 线
CO2、C2H2
3
三角形
3
0
三角形
BF3、SO3
2
1
V—形
SnCl2、PbCl2
4
四面体
4
0
四面体
CH4、SO42-
CCl4、NH4+
3
1
三角锥
NH3、PCl3
2
2
V—形
H2O、H2S
4.等电子原理及其应用
等电子体:原子数相同,价电子数也相同的微粒,如:CO和N2,CH4和NH4+;等电子体具有相似的化学键特征,性质相似。
5.简单配合物
概念
表示
条件
共用电子对由一个原子单方向提供给另一原子共用所形成的共价键。
A B
电子对给予体 电子对接受体
其中一个原子必须提供孤对电子,另一原子必须能接受孤对电子的轨道。
6.典型离子晶体的结构特征
NaCl型晶体
CsCl型晶体
每个Na+离子周围被六个C1—离子所包围,同样每个C1—也被六个Na+所包围。
每个正离子被8个负离子包围着,同时每个负离子也被8个正离子所包围。
7.金属键对金属通性的解释
金属通性
解释
金属光泽
金属中的自由电子能在一定范围内自由活动,无特征能量限制,可以在较宽范围内吸收可见光并随即放出,因而使金属不透明、具一定金属光泽(多数为银白色)。
导电
在外加电场的作用下,自由电子在金属内部发生定向运动,形成电流。
导热
自由电子把能量从温度高的区域传到温度低的区域,从而使整块金属达到同样的温度。
有延展性
当金属受到外力作用时,金属原子之间发生相对滑动,表现为良好的延展性。
8.金属原子在空间的堆积方式
钠、钾、铬、钨等
体心立方堆积
镁、钛、锌等
六方堆积
金、银、铜、铝等
面心立方堆积
分子间作用力与物质的性质
1、形成氢键的分子常见的有:H2O、HF、NH3、DNA分子、蛋白质等。
条件是:氢键通常用X-H…Y表示,其中氢原子两边的X原子和Y原子所属元素通常具有很强的电负性和很小的原子半径,主要是N、O、F。
2、晶体结构
类 型
原子晶体
离子晶体
分子晶体
金属晶体
构成微粒
原子
阴、阳离子
分子
金属离子和电子
微粒间的作用
共价键
离子键
分子间作用力
金属键
熔、沸点
很高
较高
很低
一般较高
硬 度
很大
较大
很小
一般较大
示 例
NaCl、NaOH、NH4
CO2、I2、CH3
Na、Al、Fe
金刚石、硅晶体、SiO2
Cl、Na2O2
COOH、He、NH3
3、晶体类型的判别
①离子晶体:含离子键的化合物,如强碱,大部分盐,活泼金属氧化物及“类盐”。
②原子晶体:仅有几种:金刚石、金刚砂(SiC)、石英(SiO2)、单晶硅(Si)。
③分子晶体:大部分有机物,所有的酸,弱碱,大部分非金属单质(包括稀有气体)、非金属氢化物、非金属氧化物等。
4、物质熔沸点的比较及规律
①各类晶体:一般来说,原子晶体>离子晶体>分子晶体。金属晶体差别很大,熔点高的(如钨)比某些原子晶体(SiO2)还高,熔点低的(如Cs)比某些分子晶体(如S)还低。
②同类晶体
原子晶体的熔沸点取决于共价键的键能和键长, 键能越大, 键长越短, 熔沸点越高。如熔、沸点:晶体硅<金刚砂(SiC)<金刚石。
离子晶体的熔、沸点取决于离子键的强弱, 一般来说, 离子半径越小, 离子电荷越多, 离子键越强, 熔、沸点越高。如KF>KCl>KBr。
分子晶体:组成和结构相似的物质随着相对分子质量增大, 分子间作用力也增大, 其熔、沸点升高。如F2