- 352.00 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
28题专练(二) 与硫的化合物性质有关的综合实验探究
1.(2017·磐安县第二中学高一12月月考)某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去):
试回答:
(1)上述反应中生成二氧化硫的化学方程式为___________________________________
________________________________________________________________________。
(2)乙同学认为还可能产生氢气的化学方程式是____________________________________
________________________________________________________________________。
(3)丙同学在安装好装置后,必不可少的一步操作是___________________________________
________________________________________________________________________。
(4)A中加入的试剂可能是____________________________________________________,
作用是________________________________________________________________________;
B中加入的试剂可能是________,作用是____________________________________________;
E中加入的试剂可能是________,作用是_________________________________________。
(5)可以证明气体X中含有氢气的实验现象:
5
C中:________________________________________________________________________;
D中:________________________________________________________________________。
答案 (1)Zn+2H2SO4(浓)ZnSO4+SO2↑+2H2O (2)Zn+H2SO4===ZnSO4+H2↑ (3)检查装置的气密性 (4)品红溶液 检验SO2 浓硫酸 吸收水蒸气 碱石灰 防止空气中的水蒸气进入D装置 (5)黑色的CuO变红色 白色的CuSO4变蓝
解析 由题意和实验装置可知,A装置用于检验二氧化硫,盛有高锰酸钾溶液的洗气瓶用于除去二氧化硫,B装置用于干燥剩余的气体,C装置用于检验氢气,D装置用于检验C中反应的生成物以进一步确定氢气的存在,E装置用于防止空气中的水蒸气进入D装置干扰实验。(1)上述反应中生成二氧化硫的化学方程式为Zn+2H2SO4(浓)ZnSO4+SO2↑+2H2O。(2)乙同学认为还可能产生氢气的化学方程式是Zn+H2SO4===ZnSO4+H2↑。(3)在安装好装置后,必不可少的一步操作是检查装置的气密性。(4)A中加入的试剂可能是品红溶液,作用是检验SO2;B中加入的试剂可能是浓硫酸,作用是吸收水蒸气;E中加入的试剂可能是碱石灰,作用是防止空气中的水蒸气进入D装置。(5)实验室通常用灼热的氧化铜检验氢气,现象是固体由黑色逐渐变为红色,并用无水硫酸铜检验生成的水,现象是白色粉末变蓝,所以,可以证明气体X中含有氢气的实验现象是:C中黑色的CuO变红色;D中白色的CuSO4变蓝。
2.兴趣小组同学利用下图所示装置(夹持装置已略去)探究SO2的性质,并制取一种常用食品抗氧化剂焦亚硫酸钠(Na2S2O5)。请回答下列问题:(实验前已除去装置中的空气)
(1)打开分液漏斗活塞,发现其中的液体不能流下,应采取的操作是_____________________。
(2)关闭K2、K3,打开K1,装置B中发生反应的离子方程式为________________________,
观察到装置C中发生的现象是_________________________________________________。
(3)装置D和F的作用是_________________________________________________________。
(4)关闭K1、K3,打开K2。一段时间后E中有Na2S2O5晶体析出,装置E中发生反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
答案 (1)拔掉分液漏斗上口的玻璃塞(或使分液漏斗玻璃塞上的凹槽或小孔对准瓶颈处的小孔)
(2)2Fe3++SO2+2H2O===2Fe2++SO+4H+ 有淡黄色沉淀生成
(3)吸收SO2尾气,防止污染空气
(4)SO2+Na2SO3===Na2S2O5
5
解析 (1)使用分液漏斗时应取下分液漏斗上口的玻璃塞,使分液漏斗内的压强等于大气压强,保证液体顺利流下。(2)装置A中生成SO2,装置B中FeCl3溶液与SO2发生反应,Fe3+被还原为Fe2+,SO2被氧化为SO,根据得失电子守恒、原子守恒和电荷守恒配平离子方程式。装置C中发生反应:H2O+SO2+Na2S===H2S+Na2SO3、SO2+2H2S===3S↓+2H2O,现象是有淡黄色沉淀生成。(3)装置D和F的作用是吸收SO2尾气,防止污染空气。(4)装置E中Na2SO3与SO2反应生成Na2S2O5。
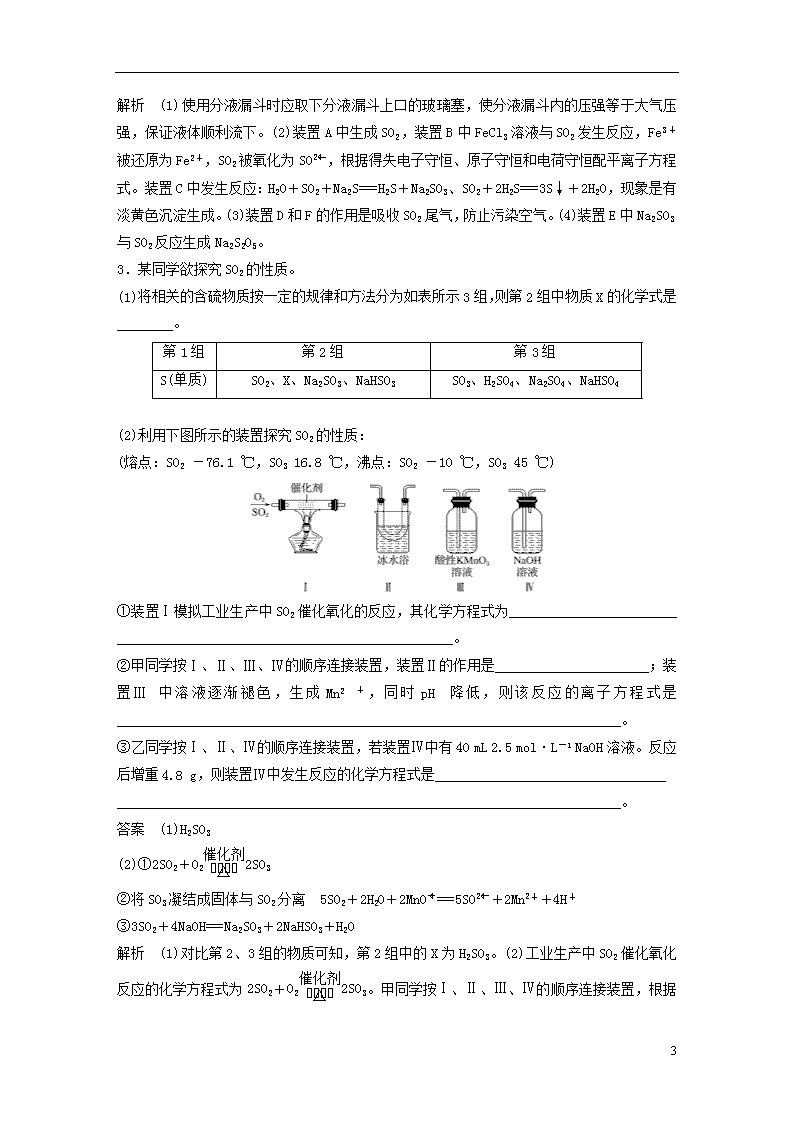
3.某同学欲探究SO2的性质。
(1)将相关的含硫物质按一定的规律和方法分为如表所示3组,则第2组中物质X的化学式是________。
第1组
第2组
第3组
S(单质)
SO2、X、Na2SO3、NaHSO3
SO3、H2SO4、Na2SO4、NaHSO4
(2)利用下图所示的装置探究SO2的性质:
(熔点:SO2 -76.1 ℃,SO3 16.8 ℃,沸点:SO2 -10 ℃,SO3 45 ℃)
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式为________________________ ________________________________________________。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是______________________;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是________________________________________________________________________。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5 mol·L-1 NaOH溶液。反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是_________________________________
________________________________________________________________________。
答案 (1)H2SO3
(2)①2SO2+O22SO3
②将SO3凝结成固体与SO2分离 5SO2+2H2O+2MnO===5SO+2Mn2++4H+
③3SO2+4NaOH===Na2SO3+2NaHSO3+H2O
解析 (1)对比第2、3组的物质可知,第2组中的X为H2SO3。(2)工业生产中SO2催化氧化反应的化学方程式为2SO2+O22SO3
5
。甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,根据题目所给SO2和SO3的熔、沸点及冰水浴,可知装置Ⅱ的作用是使SO3凝结成固体与SO2分离,便于实验的进行,减少干扰。乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,NaOH的物质的量为0.1 mol,反应后增加的质量为SO2的质量,SO2的物质的量为0.075 mol,NaOH与SO2的物质的量之比为4∶3,所以产物既有Na2SO3又有NaHSO3,化学方程式为3SO2+4NaOH===Na2SO3+2NaHSO3+H2O。
4.(2018·浙江省名校新高考研究联盟高三第二次联考)某硫酸厂周围的空气含有较多二氧化硫,某化学兴趣小组设计了以下装置和方法测定空气(内含N2、O2、SO2、CO2等)中SO2含量。
甲.用图1所示装置,通入V L空气,测定生成沉淀的质量
乙.用图2所示装置,当KMnO4溶液刚好褪色时,测定通入空气的体积为V L
丙.用图3所示装置,通入V L空气,测定U形管增加的质量
(1)你认为可行的操作是______。(填“甲”“乙”或“丙”)
(2)某环保部门为了测定空气中SO2含量,做了如下实验:取标准状况下的空气V L,缓慢通过足量溴水,在所得的溶液中加入过量的氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
①若通入气体的速率过快,则测定的SO2的体积分数________。(填“偏高”“偏低”或“不受影响”)
②如何判断氯化钡溶液已经加过量___________________________________________
________________________________________________________________________。
答案 (1)乙 (2)①偏低 ②静置,待溶液澄清后,再向上层清液中滴加氯化钡溶液,若无沉淀生成说明沉淀完全,氯化钡过量(或者静置,待溶液澄清后,取上层清液少许,置于试管,向试管中滴加Na2SO4 溶液,如果出现白色沉淀,说明BaCl2过量)
解析 本题考查实验方案设计与评价,(1)根据题中信息,空气中含有N2、O2、SO2、CO2,甲装置CO2和SO2都能与Ba(OH)2溶液反应生成沉淀,即CO2对SO2的测定产生干扰,故甲装置不可行。乙装置:SO2具有还原性,能使酸性高锰酸钾溶液褪色,其余气体不能使酸性高锰酸钾溶液褪色,故乙装置可行;丙装置:碱石灰能吸收CO2和SO2,CO2对SO2的测定产生干扰,故丙装置不可行。(2)①通入气体速率过快,SO2不能完全被吸收,测定的SO2的体积分数偏低。
5.某课题组设计实验探究SO2的性质。
5
已知:B、C、D、E中试剂均过量
(1)仪器R的名称是________________________。
(2)常温下实验室中用80%的硫酸与亚硫酸钠粉末反应制备SO2,写出A中发生反应的化学方程式:___________________________________________________________________。
(3)部分实验步骤:连接装置、检查气密性、装药品、向装置中通入几分钟氮气、启动A中反应。“通入几分钟氮气”的目的是__________________________________________。
(4)回答实验现象:B中___________,C中 ____________,D中_____________,E中_________。
答案 (1)分液漏斗
(2)Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O
(3)排尽装置内的空气,避免O2干扰实验
(4)无沉淀生成 产生白色沉淀 溶液颜色变浅 产生白色沉淀
5