- 393.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
新课程下高考晶体结构计算题的类型
一、 确定晶体的化学式
通常用均摊法。均摊是指每个图形平均拥有的粒子数目。例如晶胞为立方体结构:处于顶点的粒子,同时为8个晶胞共有,每个粒子对晶胞的贡献为1/8[一般地:若晶胞为其它几何构型,且底面为正n边形,处于顶点的粒子,同时为4n/(n-2)个晶胞共有,每个粒子对晶胞的贡献为(n-2)/4n],处于棱上的粒子,同时为4个晶胞共有,每个粒子对晶胞的贡献为1/4,处于面上的粒子,同时为2个晶胞共有,每个粒子对晶胞的贡献为1/2,处于体内的粒子,则完全属于该晶胞,对晶胞的贡献为1。
例1.2001年报道硼和镁形成的化合物刷新了金属化合物超导温度的最高记录。下图是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;6个硼原子位于棱柱内,则该化合物的化学式为( )
A.MgB B.MgB2 C.Mg2B D.Mg3B2
解析:在一个结构单元内,有12个位于正六棱柱顶点的Mg原子和2个面上的Mg原子,每个顶点上的Mg原子均被六个正六棱柱共有,一个Mg原子对一个结构单元的贡献为1/6,面上的一个Mg原子对一个结构单元的贡献为1/2,实有Mg原子为:12x(1/6)+2x(1/2)=3.而B原子均在六棱柱内,实为6个,所以Mg与B原子的个数比为1:2,化学式为Mg2B,答案选B。
二、确定晶体中粒子数、键数以及键能等
例2.金刚石是一种无色透明的固体,每个碳原子被相邻四个碳原子包围,处于四个碳原子中心,以共价键结合成正四面体网状结构,如图所示,在金刚石中,含有共价键形成的碳原子环,其中最小环上的碳原子数为_______个,每个环平均占有____个C,碳原子数和键数之比为____________。
解析:由图可知,C原子构成的最小碳环上共有六个C,但每个C成四个键,每个每一个键为三个环共用,每个成四个键共为12个环共用,所以每个C应为12个环所共有,即每个环应分得该碳的1/12,由此可知每个环占有C数应为6×1/12=0.5。每个C成四个键,一个键连两个C,所以C数和键数之比为1:(4×1/2)=1:2。
三、确定晶体中微粒间夹角
例3.某离子晶体的晶胞结构如下图,X位于立方体的顶点,Y位于立方体的中心。试分析:
(1)晶体中每一个Y同时吸引着____个X,每一个X同时吸引着___个Y,该晶体的化学式为_______。
(2)晶体中每个X周围与它最接近且距离相等的X共有______个.
(3)晶体中距离最近的两个X与一个Y形成的夹角(∠XYX)为__________.
解析: (1)根据晶胞结构可知,每个Y同时吸引着4个X,
每个X同时吸引着8个Y(一个X为8个晶胞所共有,每个晶胞体心有1个Y),故晶体中X与Y个数比为1:2。该晶体的化学式为XY2或Y2X;(2)每个X同时为8个晶胞共有,由此可推知每个X周围与它最接近且距离相等的X共有12个;(3)晶胞中的一个Y与距离相等的4个X相连,且这4个X不在同一个平面上,连接起来正好为一个正四面体,Y在体心位置,夹角为109028’,即∠XYX的角度为109028’。
四.晶体的密度、粒子之间的距离等
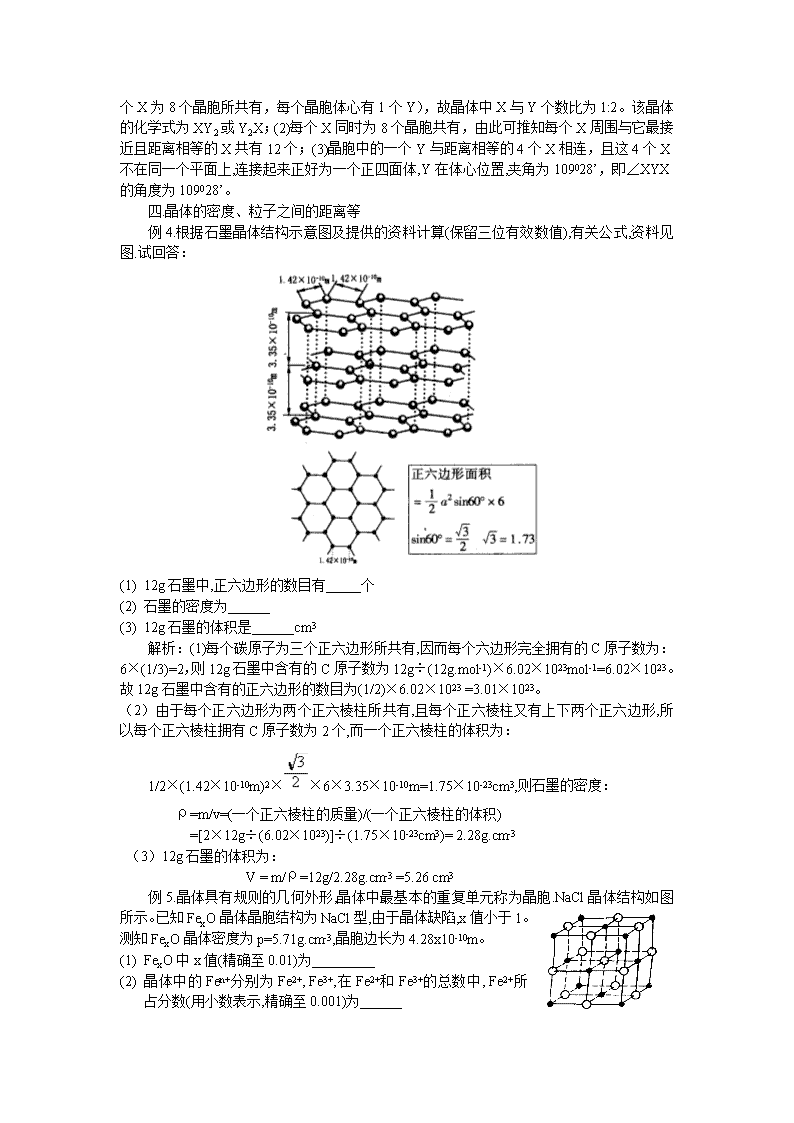
例4.根据石墨晶体结构示意图及提供的资料计算(保留三位有效数值),有关公式,资料见图.试回答:
(1) 12g石墨中,正六边形的数目有_____个
(2) 石墨的密度为______
(3) 12g石墨的体积是______cm3
解析:(1)每个碳原子为三个正六边形所共有,因而每个六边形完全拥有的C原子数为:6×(1/3)=2,则12g石墨中含有的C原子数为12g÷(12g.mol-1)×6.02×1023mol-1=6.02×1023。
故12g石墨中含有的正六边形的数目为(1/2)×6.02×1023 =3.01×1023。
(2)由于每个正六边形为两个正六棱柱所共有,且每个正六棱柱又有上下两个正六边形,所以每个正六棱柱拥有C原子数为2个,而一个正六棱柱的体积为:
1/2×(1.42×10-10m)2××6×3.35×10-10m=1.75×10-23cm3,则石墨的密度:
ρ=m/v=(一个正六棱柱的质量)/(一个正六棱柱的体积)
=[2×12g÷(6.02×1023)]÷(1.75×10-23cm3)= 2.28g.cm-3
(3)12g石墨的体积为:
V = m/ρ=12g/2.28g.cm-3 =5.26 cm3
例5.晶体具有规则的几何外形,晶体中最基本的重复单元称为晶胞.NaCl晶体结构如图所示。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体密度为p=5.71g.cm-3,晶胞边长为4.28x10-10m。
(1) FexO中x值(精确至0.01)为_________
(2) 晶体中的Fen+分别为Fe2+, Fe3+,在Fe2+和Fe3+的总数中, Fe2+所占分数(用小数表示,精确至0.001)为______
(1) 此晶体的化学式______
(2) 与某个Fe2+ (或Fe3+)距离最近且等距离的O2-围成的空间几何形状是______
(3) 晶体中,铁元素的离子间最短距离为_______m。
解析:(1)由NaCl晶体结构可知,1个NaCl晶胞中含有4个NaCl粒子,同理,在FexO晶胞中有4个FexO粒子,故1mol晶胞含有4molFexO粒子,即1mol晶胞的质量等于4molFexO的质量,ρVNA=4×(56x+16)
5.71g.cm-3×(4.28x10-8cm)3×6.02×1023=4×(56x+16),解得:x=0.92。
(2)设含有Fe2+的个数为Y,则Fe3+的个数为(0.92-Y),依正负化合价代数和为零,得:2Y+3(0.92-Y)=2,解得:Y=0.76。故Fe2+所占分数为:0.76/0.92=0.826。
(3)由于Fe2+为0.76,则Fe3+为(0.92-0.76)=0.16,故化学式为:Fe2+0.76Fe3+0.16O。
(4)由NaCl晶体结构可推知,与Fe2+(或Fe3+)距离最近且等距离的O2-有6个,这6个O2-所围成的几何形状为正八面体。
(5) FexO中Fe与Fe间最短的距离为:r=×(4.28×10-10)/2=3.03×10-10m
五、空间想象能力的综合考查
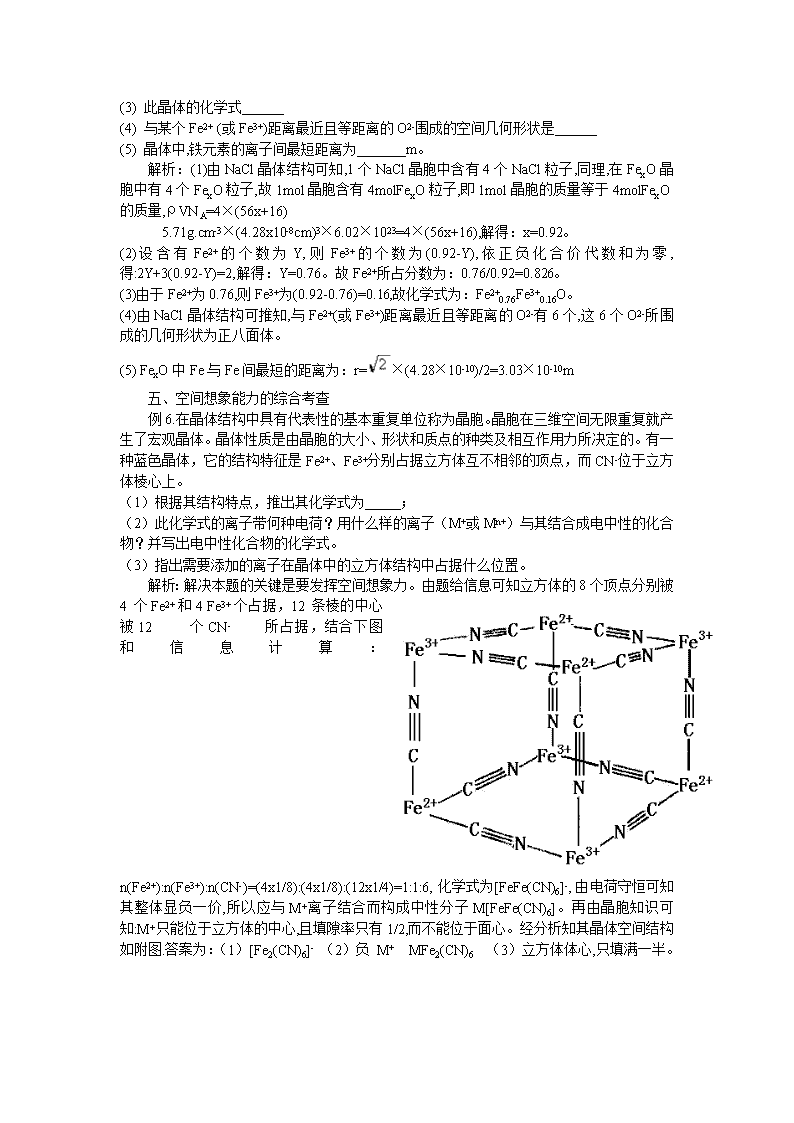
例6.在晶体结构中具有代表性的基本重复单位称为晶胞。晶胞在三维空间无限重复就产生了宏观晶体。晶体性质是由晶胞的大小、形状和质点的种类及相互作用力所决定的。有一种蓝色晶体,它的结构特征是Fe2+、Fe3+分别占据立方体互不相邻的顶点,而CN-位于立方体棱心上。
(1)根据其结构特点,推出其化学式为 ;
(2)此化学式的离子带何种电荷?用什么样的离子(M+或Mn+)与其结合成电中性的化合物?并写出电中性化合物的化学式。
(3)指出需要添加的离子在晶体中的立方体结构中占据什么位置。
解析:解决本题的关键是要发挥空间想象力。由题给信息可知立方体的8个顶点分别被4个Fe2+和4 Fe3+个占据,12条棱的中心被12个CN-所占据,结合下图和信息计算:n(Fe2+):n(Fe3+):n(CN-)=(4x1/8):(4x1/8):(12x1/4)=1:1:6,化学式为[FeFe(CN)6]-,由电荷守恒可知其整体显负一价,所以应与M+离子结合而构成中性分子M[FeFe(CN)6]。再由晶胞知识可知:M+只能位于立方体的中心,且填隙率只有1/2,而不能位于面心。经分析知其晶体空间结构如附图.答案为:(1)[Fe2(CN)6]- (2)负 M+ MFe2(CN)6 (3)立方体体心,只填满一半。