- 4.98 MB
- 2022-03-30 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
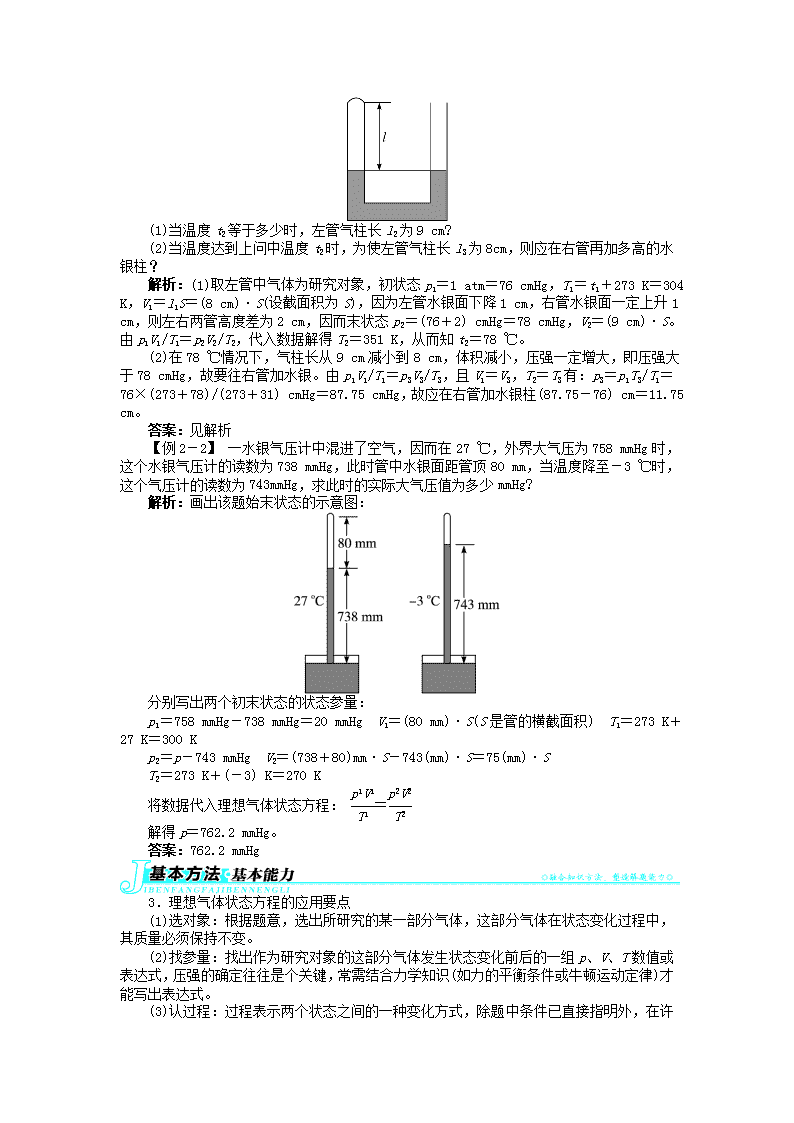
3 理想气体的状态方程1.理想气体(1)概念在任何温度、压强下都严格遵守气体实验定律的气体,理想气体是抽象出来的物理模型,实际中不存在。在温度不太低、压强不太大的情况下,可把实际气体看成是理想气体。(2)对理想气体的理解①理想气体是为了研究问题方便提出的一种理想模型,是实际气体的一种近似,就像力学中质点、电学中点电荷模型一样,突出矛盾的主要方面,忽略次要方面,从而认识物理现象的本质,是物理学中常用的方法。②实际气体,特别是那些不容易液化的气体,如氢气、氧气、氮气、氦气等,在压强不太大(不超过大气压强的几倍)、温度不太低(不低于零下几十摄氏度)时,可以近似地视为理想气体。③在微观意义上,理想气体分子本身大小与分子间的距离相比可以忽略不计,分子除碰撞外,分子间不存在相互作用的引力和斥力,所以理想气体的分子势能为零,理想气体的内能等于分子的总动能。一定质量的理想气体的内能只与气体的温度有关。④严格遵守气体实验定律及理想气体状态方程。【例1】有一定质量的氦气,压强与大气压相等,体积为1m3,温度为0℃。在温度不变的情况下,如果压强增大到大气压的500倍,按玻意耳定律计算,体积应该缩小至m3,但实验的结果是m3。如果压强增大到大气压的1000倍,体积实际减小至m3,而不是按玻意耳定律计算得到的m3。在此过程中可以把氦气看成理想气体吗?解析:理想气体是在任何温度、压强下都严格遵守气体实验定律的气体。一定质量的氦气在上述变化过程中,不符合玻意耳定律,所以不能看成理想气体。答案:不可以析规律:模型的建立理想气体和质点的概念都是应用理想化模型的方法建立起来的。2.理想气体状态方程(1)理想气体遵循的规律一定质量的理想气体的压强、体积的乘积与热力学温度的比值是一个常数。(2)理想气体的状态方程=或=C(常量)常量C仅由气体的种类和质量决定,与其他参量无关。适用条件:该方程是在理想气体质量不变的条件下才适用,是一定质量理想气体三个状态参量的关系,与变化过程无关。(3)理想气体状态方程与气体实验定律的关系:气体实验定律可看成是状态方程的特例。当m不变、T1=T2时 p1V1=p2V2 玻意耳定律当m不变、V1=V2时 = 查理定律当m不变、p1=p2时 = 盖—吕萨克定律【例2-1】如图所示,粗细均匀的、一端封闭一端开口的U形玻璃管,当t1=31℃、大气压强p0=1atm时,两管水银面相平,这时左管被封闭气柱长l1=8cm。求:
(1)当温度t2等于多少时,左管气柱长l2为9cm?(2)当温度达到上问中温度t2时,为使左管气柱长l3为8cm,则应在右管再加多高的水银柱?解析:(1)取左管中气体为研究对象,初状态p1=1atm=76cmHg,T1=t1+273K=304K,V1=l1S=(8cm)·S(设截面积为S),因为左管水银面下降1cm,右管水银面一定上升1cm,则左右两管高度差为2cm,因而末状态p2=(76+2)cmHg=78cmHg,V2=(9cm)·S。由p1V1/T1=p2V2/T2,代入数据解得T2=351K,从而知t2=78℃。(2)在78℃情况下,气柱长从9cm减小到8cm,体积减小,压强一定增大,即压强大于78cmHg,故要往右管加水银。由p1V1/T1=p3V3/T3,且V1=V3,T2=T3有:p3=p1T3/T1=76×(273+78)/(273+31)cmHg=87.75cmHg,故应在右管加水银柱(87.75-76)cm=11.75cm。答案:见解析【例2-2】一水银气压计中混进了空气,因而在27℃,外界大气压为758mmHg时,这个水银气压计的读数为738mmHg,此时管中水银面距管顶80mm,当温度降至-3℃时,这个气压计的读数为743mmHg,求此时的实际大气压值为多少mmHg?解析:画出该题始末状态的示意图:分别写出两个初末状态的状态参量:p1=758mmHg-738mmHg=20mmHg V1=(80mm)·S(S是管的横截面积) T1=273K+27K=300Kp2=p-743mmHg V2=(738+80)mm·S-743(mm)·S=75(mm)·ST2=273K+(-3)K=270K将数据代入理想气体状态方程:=解得p=762.2mmHg。答案:762.2mmHg3.理想气体状态方程的应用要点(1)选对象:根据题意,选出所研究的某一部分气体,这部分气体在状态变化过程中,其质量必须保持不变。(2)找参量:找出作为研究对象的这部分气体发生状态变化前后的一组p、V、T数值或表达式,压强的确定往往是个关键,常需结合力学知识(如力的平衡条件或牛顿运动定律)才能写出表达式。
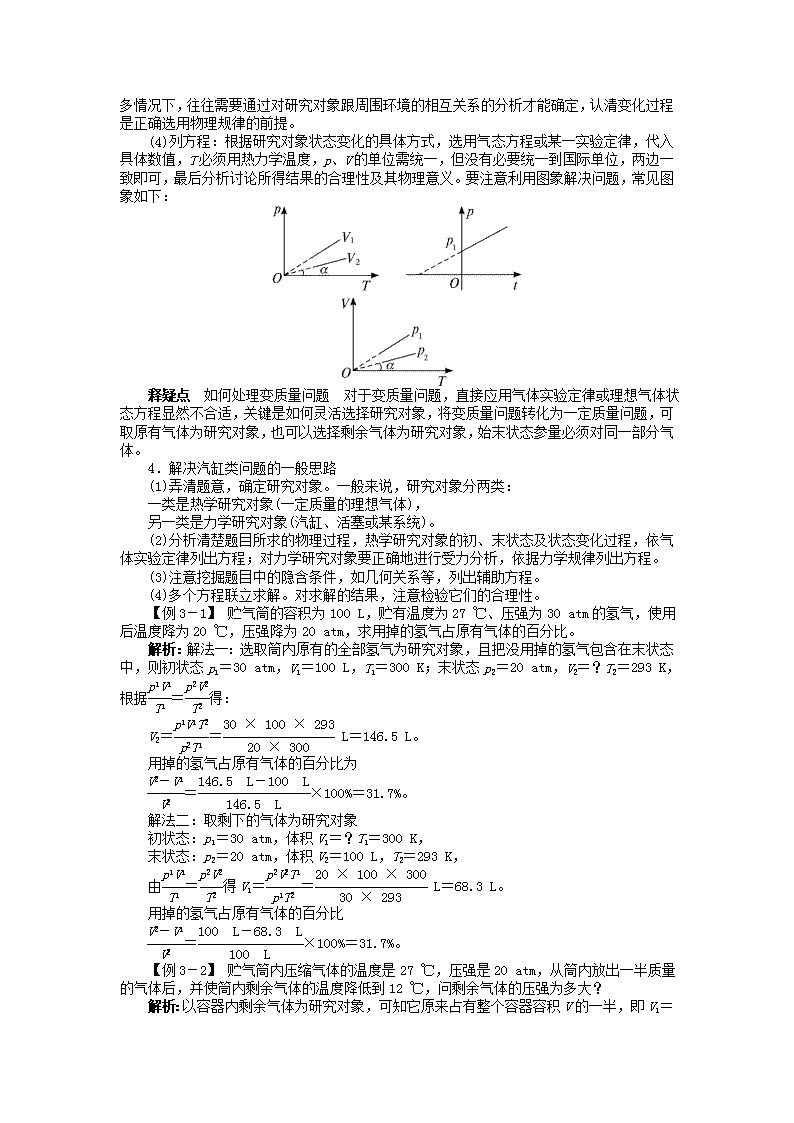
(3)认过程:过程表示两个状态之间的一种变化方式,除题中条件已直接指明外,在许多情况下,往往需要通过对研究对象跟周围环境的相互关系的分析才能确定,认清变化过程是正确选用物理规律的前提。(4)列方程:根据研究对象状态变化的具体方式,选用气态方程或某一实验定律,代入具体数值,T必须用热力学温度,p、V的单位需统一,但没有必要统一到国际单位,两边一致即可,最后分析讨论所得结果的合理性及其物理意义。要注意利用图象解决问题,常见图象如下:释疑点如何处理变质量问题 对于变质量问题,直接应用气体实验定律或理想气体状态方程显然不合适,关键是如何灵活选择研究对象,将变质量问题转化为一定质量问题,可取原有气体为研究对象,也可以选择剩余气体为研究对象,始末状态参量必须对同一部分气体。4.解决汽缸类问题的一般思路(1)弄清题意,确定研究对象。一般来说,研究对象分两类:一类是热学研究对象(一定质量的理想气体),另一类是力学研究对象(汽缸、活塞或某系统)。(2)分析清楚题目所求的物理过程,热学研究对象的初、末状态及状态变化过程,依气体实验定律列出方程;对力学研究对象要正确地进行受力分析,依据力学规律列出方程。(3)注意挖掘题目中的隐含条件,如几何关系等,列出辅助方程。(4)多个方程联立求解。对求解的结果,注意检验它们的合理性。【例3-1】贮气筒的容积为100L,贮有温度为27℃、压强为30atm的氢气,使用后温度降为20℃,压强降为20atm,求用掉的氢气占原有气体的百分比。解析:解法一:选取筒内原有的全部氢气为研究对象,且把没用掉的氢气包含在末状态中,则初状态p1=30atm,V1=100L,T1=300K;末状态p2=20atm,V2=?T2=293K,根据=得:V2==L=146.5L。用掉的氢气占原有气体的百分比为=×100%=31.7%。解法二:取剩下的气体为研究对象初状态:p1=30atm,体积V1=?T1=300K,末状态:p2=20atm,体积V2=100L,T2=293K,由=得V1==L=68.3L。用掉的氢气占原有气体的百分比=×100%=31.7%。【例3-2】贮气筒内压缩气体的温度是27℃,压强是20atm,从筒内放出一半质量的气体后,并使筒内剩余气体的温度降低到12℃,问剩余气体的压强为多大?解析:以容器内剩余气体为研究对象,可知它原来占有整个容器容积V的一半,即V1=
V,后来充满整个容器,即V2=V。初态:p1=20atm,V1=V,T1=(273+27)K=300K;末态:p2=?,V2=V,T2=(273+12)K=285K。依据理想气体状态方程=,有p2==atm=9.5atm。故容器内剩余气体的压强为9.5atm。答案:9.5atm【例4】如图,由U形管和细管连接的玻璃泡A、B和C浸泡在温度均为0℃的水槽中,B的容积是A的3倍。阀门S将A和B两部分隔开。A内为真空,B和C内都充有气体。U形管内左边水银柱比右边的低60mm。打开阀门S,整个系统稳定后,U形管内左右水银柱高度相等。假设U形管和细管中的气体体积远小于玻璃泡的容积。(1)求玻璃泡C中气体的压强(以mmHg为单位);(2)将右侧水槽的水从0℃加热到一定温度时,U形管内左右水银柱高度差又为60mm,求加热后右侧水槽的水温。解析:(1)在打开阀门S前,两水槽水温均为T0=273K。设玻璃泡B中气体的压强为p1、体积为VB,玻璃泡C中气体的压强为pC,依题意有p1=pC+Δp①式中Δp=60mmHg,打开阀门S后,两水槽水温仍为T0,设玻璃泡B中气体的压强为pB。依题意,有pB=pC②玻璃泡A和B中气体的体积为V2=VA+VB③根据玻意耳定律得p1VB=pBV2④联立①②③④式,并代入题给数据得pC=Δp=180mmHg⑤(2)当右侧水槽的水温加热至T′时,U形管左右水银柱高度差为Δp。玻璃泡C中气体的压强为pC′=pB+Δp⑥百度文库-让每个人平等地提升自我玻璃泡C的气体体积不变,根据查理定律得=⑦联立②⑤⑥⑦式,并代入题给数据得T′=364K⑧答案:(1)180mmHg (2)364K5.理想气体状态方程的推广(1)道尔顿定律:如图,设A中气体压强为pA,体积为VA,温度为TA,B容器中气体的压强、体积和温度分别为pB、VB、TB。打开K混合后,稳定时气体的压强为p,体积为V=VA+VB,温度为T,则有pV/T=pAVA/TA+pBVB/TB。
(2)克拉珀龙方程:pV=nRT①推导:对某种理想气体,设摩尔质量为M,质量为m,则该气体的摩尔数为n=,这部分气体在标准状态下占体积V′=nV0,由理想气体状态方程=C可得===nR,pV=nRT即pV=RT。②意义:克拉珀龙方程是任意质量的理想气体的状态方程,它联系着某一确定状态下各物理量的关系,克拉珀龙方程虽然是从气体实验定律逐步推导而得,但它是反映气体性质,联系状态参量更为一般的形式。克拉珀龙方程是任意质量理想气体的状态方程,它联系着某一状态下各物理量间的关系,对实际气体只要温度不太低、压强不太大就可应用克拉珀龙方程解题。③摩尔气体常量R是热学中又一个重要常量,R为一摩尔理想气体在标准状态下的常量,叫做摩尔气体常量。R==≈8.31J/mol·K=≈0.082atm·L/(mol·K)。【例5-1】某医院使用的氧气瓶容积为32L,在温度为27℃时瓶内压强为15atm,按规定当使用到17℃时压强降到1atm,便应重新充气。该医院在22℃时,平均每天用0.1atm的氧气429L,问一瓶氧气能用多少天?解析:据题意,气体初态p0=15atm、V0=32L、T0=300K;n天用掉答案:10【例5-2】某房间的容积为20m3,在温度为7℃、大气压强为9.8×104Pa时,室内空气质量是25kg。当温度升高到27℃、大气压强变为1.0×105Pa时,室内空气的质量是多少?解析:解法一:本题可用密度公式来解决。由于理想气体状态方程变形可得=,又ρ1=,ρ2=,所以m2=ρ2V1=··V1=·m1=kg≈23.8kg。解法二:室内气体的温度、压强均发生了变化,原气体的体积不一定还是20m3,可能增大有气体跑出,可能减小有气体流入,因此仍以原25kg气体为研究对象,通过计算才能确定。气体初态:p1=9.8×104Pa,V1=20m3,T1=280K;气体末态:p2=1.0×105Pa,V2=?,T2=300K。由理想气体状态方程有:=,所以V2=V1=m3=21.0m3,因V2>V1,故有气体从房间内流出。
房间内气体质量m2=m1=×25kg≈23.8kg。辨误区:处理变质量问题 关键是选取恰当的研究对象,可想象“放出”或“漏掉”的气体与剩余气体的状态相同,将变质量问题转化为定质量问题,然后利用理想气体的状态方程,就可以确定剩余气体与“放出”或“漏掉”气体的体积、质量关系,从而确定剩余气体和原有气体间的状态变化关系。
相关文档
- 高中物理选修1-1会考练习及答案2022-03-3012页
- 高中物理新课标版人教版选修1-2课2022-03-3012页
- 高中物理新课标人教版教学课件:第62022-03-3041页
- 高中物理选修3课件-5-1交变电流2022-03-3012页
- 高中物理11-4单摆每课一练新人教版2022-03-305页
- 高中物理选修3课件-10功和内能2022-03-3021页
- 人教版高中物理必修1课件-第4章-补2022-03-309页
- 高中物理人教版必修二第七章第四节2022-03-304页
- 2020高中物理13.2 全反射2022-03-3010页
- 2020高中物理 第二章 匀变速直线运2022-03-305页