- 1.98 MB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题三
氧化还原反应 离子反应
考点一 氧化还原反应
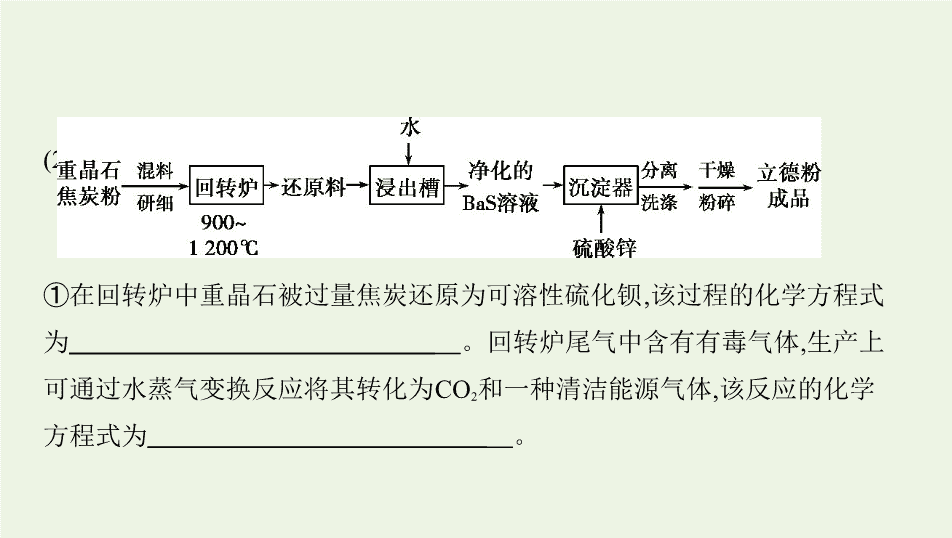
1.(2019课标Ⅱ,26节选)立德粉ZnS·BaSO
4
(也称锌钡白),是一种常用白色颜
料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金
属盐。灼烧立德粉样品时,钡的焰色为
(填标号)。
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO
4
)为原料,可按如下工艺生产立德粉
①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式
为
。回转炉尾气中含有有毒气体,生产上
可通过水蒸气变换反应将其转化为CO
2
和一种清洁能源气体,该反应的化学
方程式为
。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性
变差。其原因是“还原料”表面生成了难溶于水的
(填化学式)。
③沉淀器中反应的离子方程式为
。
答案
(1)D
(2)①BaSO
4
+4C
BaS+4CO↑ CO+H
2
O
CO
2
+H
2
②BaCO
3
③S
2-
+Ba
2+
+Zn
2+
+S
BaSO
4
·ZnS↓
解析
(1)重要金属的焰色反应的颜色平时要注意识记。
(2)①已知反应物有BaSO
4
、C,生成物有BaS,因焦炭过量则生成CO,根据得失
电子守恒、原子守恒写出化学方程式;CO与H
2
O(g)反应生成CO
2
与一种清洁
能源气体,不难推测该气体为H
2
。②“还原料”的主要成分为BaS,长期放置
发生水解生成Ba(OH)
2
与H
2
S,Ba(OH)
2
吸收空气中的CO
2
生成了难溶于水的
BaCO
3
。③沉淀器中溶液的成分为Ba
2+
、S
2-
、Zn
2+
、S
,反应生成了BaSO
4
·
ZnS沉淀,根据电荷守恒、原子守恒写出离子方程式。
2.(2016课标Ⅰ,28节选)NaClO
2
是一种重要的杀菌消毒剂,也常用来漂白织物
等,其一种生产工艺如下:
回答下列问题:
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO
2
。此吸收反应中,氧化
剂与还原剂的物质的量之比为
,该反应中氧化产物是
。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯
消毒剂的氧化能力相当于多少克Cl
2
的氧化能力。NaClO
2
的有效氯含量为
(计算结果保留两位小数)。
答案
(4)2∶1 O
2
(5)1.57
解析
(4)据图示可知“尾气吸收”的反应物有ClO
2
、NaOH、H
2
O
2
,生成物
有NaClO
2
,其中
O
2
→Na
O
2
,Cl的化合价降低,则H
2
O
2
中氧元素的化合价升
高,根据得失电子守恒可得氧化剂ClO
2
与还原剂H
2
O
2
的物质的量之比为2∶1,
该反应中氧化产物是O
2
,还原产物是NaClO
2
。
(5)NaClO
2
、Cl
2
作为消毒剂时,还原产物均为Cl
-
。设NaClO
2
的有效氯含量为
x
,
则
×
4=
×
2,解得
x
≈
1.57。
3. (201
4
山东理综,
7
,
5
分)下表中对应关系正确的是
(
B
)
A
CH
3
CH
3
+Cl
2
CH
3
CH
2
Cl+HCl
CH
2
CH
2
+HCl
CH
3
CH
2
Cl
均为取代反应
B
由油脂得到甘油由淀粉得到葡萄糖
均发生了水解反应
C
Cl
2
+2Br
-
2Cl
-
+Br
2
Zn+Cu
2+
Zn
2+
+Cu
均为单质被还原的置换反应
D
2Na
2
O
2
+2H
2
O
4NaOH+O
2
↑
Cl
2
+H
2
O
HCl+HClO
均为水作还原剂的氧化还原反应
答案
B CH
2
CH
2
+HCl
CH
3
CH
2
Cl是加成反应,A项错误;Zn+Cu
2+
Zn
2+
+Cu中单质Zn被氧化,C项错误;D项两个反应中水既不是氧化剂也不是还
原剂,D项错误。
1.理清两条概念线索
2.掌握氧化还原反应的规律
3.识记常见氧化剂、还原剂及产物预测
(1)常见的氧化剂及产物预测
氧化剂
还原产物
KMnO
4
Mn
2+
(酸性);MnO
2
(中性);Mn
(碱性)
K
2
Cr
2
O
7
(酸性)
Cr
3+
浓硝酸
NO
2
稀硝酸
NO
X
2
(卤素单质)
X
-
H
2
O
2
OH
-
(碱性或中性);H
2
O(酸性)
Na
2
O
2
NaOH(或Na
2
CO
3
)
NaClO(或ClO
-
)
Cl
-
、Cl
2
NaClO
3
Cl
2
、ClO
2
PbO
2
Pb
2+
(2)常见的还原剂及产物预测
还原剂
氧化产物
Fe
2+
Fe
3+
(酸性);Fe(OH)
3
(碱性)
SO
2
(或H
2
SO
3
、S
)
S
S
2-
(或H
2
S)
S、SO
2
(或S
)、S
H
2
C
2
O
4
CO
2
H
2
O
2
O
2
I
-
(或HI)
I
2
、I
CO
CO
2
金属单质(Zn、Fe、Cu等)
Zn
2+
、Fe
2+
(与强氧化剂反应生成Fe
3+
)、Cu
2+
考向一 辨析氧化还原反应概念 感悟氧化还原反应规律
1.(2019北京理综,10,6分)下列除杂试剂选用正确且除杂过程
不涉及
氧化还原
反应的是
(
B
)
物质(括号内为杂质)
除杂试剂
A
FeCl
2
溶液(FeCl
3
)
Fe粉
B
NaCl溶液(MgCl
2
)
NaOH溶液、稀HCl
C
Cl
2
(HCl)
H
2
O、浓H
2
SO
4
D
NO(NO
2
)
H
2
O、无水CaCl
2
答案
B A项,用Fe粉除去FeCl
2
溶液中的Fe
3+
时,发生了氧化还原反应;C项,
除去Cl
2
中的HCl杂质一般用饱和食盐水,用水除会损失部分Cl
2
,同时Cl
2
与H
2
O
的反应是氧化还原反应;D项,NO
2
和H
2
O的反应属于氧化还原反应。
2.(2019山东滨州期末)已知反应:O
3
+2I
-
+H
2
O
O
2
+I
2
+2OH
-
,下列说法错误
的是
(
A
)
A.O
2
为氧化产物
B.氧化性:O
3
>I
2
C.反应生成1 mol I
2
转移2 mol电子
D.产物中的I
2
与OH
-
能发生反应:3I
2
+6OH
-
I
+5I
-
+3H
2
O
答案
A O
3
和O
2
是同素异形体,化合价均为0,A项错误。
3.(2019山东泰安期中)某种类型的心脏起搏器工作时发生下列反应:4Li+
2SOCl
2
4LiCl+S+SO
2
。下列有关判断正确的是
(
D
)
A.反应中被氧化的元素有Li和S
B.SOCl
2
既是氧化剂又是还原剂
C.还原产物包括LiCl和S
D.生成标准状况下1.12 L SO
2
时,反应转移电子0.2 mol
答案
D 在反应中Li元素的化合价由0升高到+1,硫元素的化合价由+4降为
0,即Li元素被氧化,S元素被还原,A项错误;在反应中只有硫元素的化合价降
低,所以SOCl
2
是氧化剂,B项错误;在反应中SOCl
2
被还原生成S,而Li被氧化生
成LiCl,所以反应中还原产物为S,LiCl为氧化产物,C项错误;由题给反应可知,
每生成1 mol SO
2
转移4 mol电子,则标准状况下生成1.12 L SO
2
时,反应转移电
子0.2 mol,D项正确。
考向二 氧化还原反应方程式的配平与书写
4.(2019湖南衡阳期中)用草酸的稀溶液或草酸钠的酸性溶液可以洗涤粘在皮
肤上的高锰酸钾,其离子方程式为(未配平):Mn
+C
2
+H
+
CO
2
↑+Mn
2+
+ 。关于此反应的叙述中正确的是
(
C
)
A.该反应右边方框内的产物是OH
-
B.配平该反应后,H
+
的化学计量数是8
C.该反应中氧化产物是CO
2
D.该反应电子转移总数是5 mol
答案
C 酸性条件下,不可能生成OH
-
,应生成H
2
O,故A错误;反应中Mn
→
Mn
2+
,锰元素的化合价由+7价降低为+2价,C
2
→CO
2
,碳元素的化合价由+3
价升高为+4价,结合得失电子守恒、电荷守恒、原子守恒配平离子方程式:
2Mn
+5C
2
+16H
+
10CO
2
↑+2Mn
2+
+8H
2
O,H
+
的化学计量数是16,故B错
误;未指明参加反应的物质的量,无法判断电子转移总数,故D错误。
5.(2019山东济南期末)CuS、Cu
2
S用于处理酸性废水中的Cr
2
,反应如下:
反应Ⅰ:CuS+Cr
2
+H
+
Cu
2+
+S
+Cr
3+
+H
2
O(未配平)
反应Ⅱ:Cu
2
S+Cr
2
+H
+
Cu
2+
+S
+Cr
3+
+H
2
O(未配平)
下列有关说法正确的是
(
C
)
A.反应Ⅰ和Ⅱ中各有2种元素的化合价发生变化
B.处理1 mol Cr
2
时反应Ⅰ、Ⅱ中消耗H
+
的物质的量相等
C.反应Ⅱ中还原剂与氧化剂的物质的量之比为3∶5
D.质量相同时,Cu
2
S能去除更多的Cr
2
答案
C 在反应Ⅰ中S、Cr元素化合价发生变化,在反应Ⅱ中Cu、S、Cr三
种元素的化合价发生了变化,A项错误;反应Ⅰ配平后的方程式为3CuS+
4Cr
2
+32H
+
3Cu
2+
+3S
+8Cr
3+
+16H
2
O,反应Ⅱ配平后的方程式为3Cu
2
S+
5Cr
2
+46H
+
6Cu
2+
+3S
+10Cr
3+
+23H
2
O,可见处理1 mol Cr
2
时,反应Ⅰ
消耗H
+
的物质的量是8 mol,反应Ⅱ消耗H
+
的物质的量是9.2 mol,B项错误;反
应Ⅱ中还原剂是Cu
2
S,氧化剂是Cr
2
,由上述配平的方程式可知,C项正确;根
据配平的方程式可知3 mol(即3
×
96 g)CuS处理4 mol Cr
2
,每克CuS处理
Cr
2
的物质的量为
mol=
mol;3 mol(即3
×
160 g)Cu
2
S处理5 mol Cr
2
,
每克Cu
2
S处理Cr
2
的物质的量为
mol=
mol,可见质量相同时,CuS
能去除更多的Cr
2
,D项错误。
6.(2019山东潍坊期中)研究人员提出利用含硫物质热化学循环实现太阳能的
转化与存储,过程如下:
请回答下列问题:
(1)反应Ⅰ的化学方程式为
。1 mol H
2
SO
4
(l)分解成气
态物质需要吸收的能量是275.5 kJ,硫的燃烧热为297 kJ·mol
-1
,则反应Ⅱ的热化学方程式为
。
(2)单质硫也可以生成多硫化物实现能量间的转化。
①钠硫电池是一种新型高能电池,总反应为2Na+
x
S
Na
2
S
x
,该电池工作时
的正极反应式为
,给该电池充电时,钠电极应与外电源的
(填“正”或“负”)极相连接。
②多硫化合物H
2
S
2
O
8
中S的化合价为+6,分子中过氧键的数目为
。
③在碱性溶液中,多硫离子
被Br
氧化成S
,Br
被还原成Br
-
。该反应的
离子方程式是
。
答案
(1)2H
2
SO
4
2SO
2
↑+2H
2
O↑+O
2
↑ 3SO
2
(g)+2H
2
O(g)
2H
2
SO
4
(l)+
S(s) Δ
H
=-254 kJ·mol
-1
(2)①
x
S+2e
-
负 ②1 ③3
+6(
x
-1)OH
-
+(3
x
+1)Br
3
x
S
+
(3
x
+1)Br
-
+3(
x
-1)H
2
O
解析
(1)由题图可知,反应Ⅰ为H
2
SO
4
分解为O
2
、SO
2
、H
2
O(g),故该反应的方
程式为2H
2
SO
4
2SO
2
↑+2H
2
O↑+O
2
↑;由题可知,反应Ⅰ的热化学方程式
为2H
2
SO
4
(l)
2SO
2
(g)+2H
2
O(g)+O
2
(g) Δ
H
=+551 kJ·mol
-1
,S燃烧的热化学
方程式为反应Ⅳ:S(s)+O
2
(g)
SO
2
(g) Δ
H
=-297 kJ·mol
-1
,由盖斯定律可知
反应Ⅱ=-(反应Ⅰ+反应Ⅳ),反应Ⅱ的热化学方程式为3SO
2
(g)+2H
2
O(g)
2H
2
SO
4
(l)+S(s) Δ
H
=-254 kJ·mol
-1
。
(2)①由总反应方程式可知,正极为S得到电子,故正极反应式为
x
S+2e
-
;
电池放电时,钠电极为负极,发生氧化反应,充电时应与外接电源的负极连接。
②H
2
S
2
O
8
中S的化合价为+6,H为+1,即8个O的总化合价为-14,故8个O中有2个
O为-1价,因此该分子中过氧键的数目为1。
③
中S的平均化合价为-
,反应后升高到+6,1 mol
反应后化合价变化6
x
+
2,Br
中Br的化合价为+5,反应后降低为-1,1 mol Br
反应后化合价变化6,根
据氧化还原反应过程中得失电子守恒以及溶液为碱性配平可得3
+6(
x
-1)OH
-
+(3
x
+1)Br
3
x
S
+(3
x
+1)Br
-
+3(
x
-1)H
2
O。
方法归纳
氧化还原反应方程式的配平技巧
(1)配平依据:“守恒”三原则(依次运用得失电子守恒、电荷守恒、质量守恒)
(2)配平步骤:
注意:缺项方程式配平时的补项原则
考向三 氧化还原反应方程式的计算
7.(2019安徽皖中名校联盟联考)某强氧化剂XO(OH
被Na
2
SO
3
还原。如果还
原1.2
×
10
-3
mol XO(OH
,需用30 mL 0.1 mol·L
-1
的Na
2
SO
3
溶液,那么X元素被
还原后的物质可能是
(
D
)
A.XO B.X
2
O
3
C.X
2
O D.X
答案
D 由题意可知,S元素由+4价→+6价,假设反应后X元素的化合价为
x
,
根据氧化还原反应中得失电子守恒,则有1.2
×
10
-3
mol
×
(5-
x
)=0.03 L
×
0.1 mol·L
-1
×
(6-4),解得
x
=0,所以X元素被还原后的物质是X。
8.(2019河南洛阳第一次质量预测)将过量H
2
O
2
溶液加入含(NH
4
)
2
CrO
4
的氨水
中,加热后冷却,生成暗棕红色晶体M[化学式为Cr(NH
3
)
3
O
4
],该反应的离子方
程式为:Cr
+3NH
3
+3H
2
O
2
M+2H
2
O+2OH
-
+O
2
↑,测得M中有2个过氧
键。下列叙述正确的是
(
D
)
A.M中Cr的化合价为+3
B.参与反应的H
2
O
2
全部被氧化
C.向FeSO
4
溶液中滴加几滴M的溶液,没有明显现象
D.转移0.2 mol电子时,生成M的质量为16.7 g
答案
D 因M[化学式为Cr(NH
3
)
3
O
4
]中有2个过氧键,则M中Cr的化合价为
+4,A项错误;M中有2个过氧键,所以参与反应的H
2
O
2
没有全部被氧化,B项错误;
向FeSO
4
溶液中滴加几滴M的溶液,亚铁离子会被M中的过氧键氧化为三价
铁离子,溶液由浅绿色变成黄色,C项错误;由方程式可知每生成1 mol O
2
转移
2 mol电子,同时生成1 mol Cr(NH
3
)
3
O
4
,则转移0.2 mol电子时,生成M的质量为
16.7 g,D项正确。
考点二 离子反应
1.(2019课标Ⅰ,10,6分)固体界面上强酸的吸附和离解是多相化学在环境、催
化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰
表面吸附和溶解过程的示意图,下列叙述错误的是
( )
A.冰表面第一层中,HCl以分子形式存在
B.冰表面第二层中,H
+
浓度为5
×
10
-3
mol·L
-1
(设冰的密度为0.9 g·cm
-3
)
C.冰表面第三层中,冰的氢键网络结构保持不变
D.冰表面各层之间,均存在可逆反应HCl
H
+
+Cl
-
答案
D 由图可知,在冰表面第一层氯化氢以分子形式存在,在第二层氯化
氢以离子形式存在,而第三层只有水分子,则在第一、二层之间存在可逆反
应:HCl
H
+
+Cl
-
,A、C项正确,D项错误;1 L冰中水的物质的量为
=50 mol,第二层中,
n
(Cl
-
)∶
n
(H
2
O)=10
-4
∶1,
n
(Cl
-
)=5
×
10
-3
mol,则
c
(H
+
)=
c
(Cl
-
)=
=
=5
×
10
-3
mol·L
-1
,B项正确。
2.
(201
5
山东理综,
12
,
5
分)下列表示对应化学反应的离子方程式正确的是
(
D
)
A.向稀HNO
3
中滴加Na
2
SO
3
溶液:S
+2H
+
SO
2
↑+H
2
O
B.向Na
2
SiO
3
溶液中通入过量SO
2
:Si
+SO
2
+H
2
O
H
2
SiO
3
↓+S
C.向Al
2
(SO
4
)
3
溶液中加入过量NH
3
·H
2
O:Al
3+
+4NH
3
·H
2
O
[Al(OH)
4
]
-
+4N
D.向CuSO
4
溶液中加入Na
2
O
2
:2Na
2
O
2
+2Cu
2+
+2H
2
O
4Na
+
+2Cu(OH)
2
↓+O
2
↑
答案
D 稀硝酸有强氧化性,会将S
氧化,A错误;因通入的SO
2
过量,故生
成的是HS
,不是S
,B错误;Al(OH)
3
不溶于NH
3
·H
2
O,C中正确的离子方程式
应为Al
3+
+3NH
3
·H
2
O
Al(OH)
3
↓+3N
,C错误;向CuSO
4
溶液中加入Na
2
O
2
,
先发生反应的离子方程式为2Na
2
O
2
+2H
2
O
4Na
+
+4OH
-
+O
2
↑,再发生反应
的离子方程式为Cu
2+
+2OH
-
Cu(OH)
2
↓,整理后可得出D中的离子方程式,
D正确。
3. (201
4
山东理综,
12
,
5
分)下列有关溶液组成的描述合理的是
(
C
)
A.无色溶液中可能大量存在Al
3+
、N
、Cl
-
、S
2-
B.酸性溶液中可能大量存在Na
+
、ClO
-
、S
、I
-
C.弱碱性溶液中可能大量存在Na
+
、K
+
、Cl
-
、HC
D.中性溶液中可能大量存在Fe
3+
、K
+
、Cl
-
、S
答案
C Al
3+
和S
2-
能发生相互促进的水解反应,不能大量共存,A项错误;酸
性溶液中ClO
-
能氧化I
-
,且H
+
与ClO
-
不能大量共存,B项错误;中性溶液中Fe
3+
不
能大量存在,D项错误。
1.正确书写离子方程式的两个关键点
化学式拆写
“二注意”
(1)需要拆分的物质:强酸、强碱、可溶性盐;
(2)特殊情况需拆:微溶物的澄清溶液、浓盐酸、浓硝酸(浓硫酸不拆)等
方程式遵循
“三守恒”
原子守恒、电荷守恒、得失电子守恒
2.突破离子共存的四大题设“陷阱”
考向一 离子方程式的正误判断
1.(2019天津理综,2,6分)下列离子方程式能用来解释相应实验现象的是(
A
)
实验现象
离子方程式
A
向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解
Mg(OH)
2
+2N
Mg
2+
+2NH
3
·H
2
O
B
向沸水中滴加饱和氯化铁溶液得到红褐色液体
Fe
3+
+3H
2
O
Fe(OH)
3
↓+3H
+
C
二氧化硫使酸性高锰酸钾溶液褪色
3SO
2
+2Mn
+4H
+
3S
+2Mn
2+
+2H
2
O
D
氧化亚铁溶于稀硝酸
FeO+2H
+
Fe
2+
+H
2
O
答案
A A项,悬浊液中存在平衡:Mg(OH)
2
(s)
Mg
2+
(aq)+2OH
-
(aq),加入
NH
4
Cl溶液后,N
与OH
-
结合成NH
3
·H
2
O,平衡正向移动而使沉淀逐渐溶解,正
确;B项,红褐色液体是Fe(OH)
3
胶体,不是沉淀,错误;C项,得失电子不守恒,电荷
不守恒,错误;D项,稀硝酸具有强氧化性,可将Fe
2+
氧化为Fe
3+
,错误。
2.(2019江苏单科,7,2分)下列指定反应的离子方程式正确的是
(
A
)
A.室温下用稀NaOH溶液吸收Cl
2
:Cl
2
+2OH
-
ClO
-
+Cl
-
+H
2
O
B.用铝粉和NaOH溶液反应制取少量H
2
:Al+2OH
-
Al
+H
2
↑
C.室温下用稀HNO
3
溶解铜:Cu+2N
+2H
+
Cu
2+
+2NO
2
↑+H
2
O
D.向Na
2
SiO
3
溶液中滴加稀盐酸:Na
2
SiO
3
+2H
+
H
2
SiO
3
↓+2Na
+
答案
A A项,Cl
2
能与NaOH溶液反应生成NaCl、NaClO和水,离子方程式
为Cl
2
+2OH
-
ClO
-
+Cl
-
+H
2
O,正确;B项,铝粉能与NaOH溶液反应制取H
2
,离
子方程式为2Al+2OH
-
+2H
2
O
2Al
+3H
2
↑,错误;C项,铜与稀硝酸反应生
成NO,离子方程式为3Cu+8H
+
+2N
3Cu
2+
+2NO↑+4H
2
O,错误;D项,
Na
2
SiO
3
易溶于水,应用离子符号表示,故向Na
2
SiO
3
溶液中滴加稀盐酸发生反
应的离子方程式为Si
+2H
+
H
2
SiO
3
↓,错误。
3.(2019山东济南期末)关于下列反应的离子方程式正确的是(
A
)
A.向溴化亚铁溶液中通入少量氯气:2Fe
2+
+Cl
2
2Fe
3+
+2Cl
-
B.向碳酸钠溶液中滴加少量硫酸:C
+2H
+
CO
2
↑+H
2
O
C.向稀硝酸中滴加少量亚硫酸钠溶液:S
+2H
+
SO
2
↑+H
2
O
D.向碳酸氢铵溶液中加入足量氢氧化钠溶液:N
+OH
-
NH
3
·H
2
O
答案
A 微粒的还原性:Fe
2+
>Br
-
,所以向溴化亚铁溶液中通入少量氯气,发
生反应的离子方程式为2Fe
2+
+Cl
2
2Fe
3+
+2Cl
-
,A项正确;碳酸钠与酸反应分
步进行,先发生反应:H
+
+C
HC
,不放出气体,当溶液中的C
全部变
为HC
,再发生反应:HC
+H
+
H
2
O+CO
2
↑,B项错误;硝酸具有强氧化性,
亚硫酸钠具有还原性,二者发生氧化还原反应,C项错误;向碳酸氢铵溶液中加
入足量氢氧化钠溶液,发生反应生成碳酸钠和一水合氨,反应的离子方程式为
N
+2OH
-
+HC
NH
3
·H
2
O+C
+H
2
O,D项错误。
方法归纳
“四两”破千题——离子方程式的正误判断
考向二 离子共存
4.(2019江苏单科,4,2分)室温下,下列各组离子在指定溶液中能大量共存的是
(
A
)
A.0.1 mol·L
-1
NaOH溶液:Na
+
、K
+
、C
、Al
B.0.1 mol·L
-1
FeCl
2
溶液:K
+
、Mg
2+
、S
、Mn
C.0.1 mol·L
-1
K
2
CO
3
溶液:Na
+
、Ba
2+
、Cl
-
、OH
-
D.0.1 mol·L
-1
H
2
SO
4
溶液:K
+
、N
、N
、HS
答案
A A项,在NaOH溶液中,Na
+
、K
+
、C
、Al
相互之间不发生化学
反应,可以共存,正确;B项,Fe
2+
具有还原性,Mn
具有氧化性,两者之间可发生
氧化还原反应,不能共存,错误;C项,C
和Ba
2+
可以结合成BaCO
3
沉淀,不能大
量共存,错误;D项,在酸性条件下,N
可将HS
氧化,且HS
与H
+
反应,不能大
量共存,错误。
5.(2019山东济南期末)常温下,下列各组离子在指定溶液中一定能大量共存
的是
(
D
)
A.在新制饱和氯水中:N
、Na
+
、S
、S
B.在能使红色石蕊试纸变蓝的溶液中:Cu
2+
、K
+
、HC
、C
C.在加入铝粉能产生H
2
的溶液中:Fe
2+
、Na
+
、S
、N
D.在
c
(H
+
)=1
×
10
-11
mol·L
-1
的溶液中:Na
+
、K
+
、S
2-
、S
答案
D 新制饱和氯水中含有大量的Cl
2
、HClO,它们与还原性微粒S
会
发生氧化还原反应,不能大量共存,A项错误。能使红色石蕊试纸变蓝的溶液
为碱性溶液,溶液中的OH
-
与Cu
2+
、HC
会发生反应,不能大量共存,且Cu
2+
、
C
也会发生相互促进的水解反应,不能大量共存,B项错误。加入铝粉能产
生H
2
的溶液可能显酸性,也可能显碱性。在酸性条件下,Fe
2+
、N
会发生氧
化还原反应,不能大量共存;在碱性条件下,OH
-
与Fe
2+
会反应生成Fe(OH)
2
,不能
大量共存,C项错误。
c
(H
+
)=1
×
10
-11
mol·L
-1
的溶液显碱性,在碱性条件下,选项
中的离子可以大量共存,D项正确。
6.(2019山东德州期末)常温下,下列离子在指定环境中一定能够大量共存的
是
(
D
)
A.通入SO
2
气体:Na
+
、Ca
2+
、Cl
-
、ClO
-
B.中性溶液中:Mg
2+
、Fe
3+
、S
、Cl
-
C.0.1 mol/L的明矾溶液中:K
+
、Ba
2+
、Cl
-
、HC
D.
=1.0
×
10
-12
mol/L的溶液中:N
、Cl
-
、Fe
2+
、I
-
答案
D SO
2
具有还原性,与ClO
-
在溶液中发生氧化还原反应,不能大量共
存,A项错误;中性溶液中,Fe
3+
会形成Fe(OH)
3
沉淀,不能大量存在,B项错误;在
明矾溶液中,Al
3+
与HC
会发生相互促进的水解反应,生成氢氧化铝沉淀和二
氧化碳气体,不能大量共存,C项错误;
=1.0
×
10
-12
mol/L的溶液显酸性,在
酸性溶液中,H
+
与选项离子不能发生任何反应,可以大量共存,D项正确。
方法归纳
离子共存题目中的5大易忽视点
(1)注意判断离子共存的情况:“能、不能”“一定、可能、一定不能”。
(2)注意题干中提示的溶液酸碱性:酸性溶液应考虑H
+
的存在,碱性溶液应考
虑OH
-
的存在。
(3)注意题干中提示的溶液颜色:溶液无色时,Cu
2+
、Fe
2+
、Fe
3+
、Mn
等有色
离子不能存在。
(4)注意正确理解“透明溶液”,如NaCl溶液、KOH溶液为无色透明溶液,
CuSO
4
溶液、FeCl
3
溶液是有色透明溶液,不能认为“有色”就不透明。
(5)注意题干中提示的水的电离程度:当由水电离出的
c
(H
+
)或
c
(OH
-
)小于1
×
10
-7
mol·L
-1
时,溶液可能为酸性溶液,也可能为碱性溶液;当由水电离出的
c
(H
+
)或
c
(OH
-
)大于1
×
10
-7
mol·L
-1
时,溶液可能为强碱弱酸盐溶液或强酸弱碱盐溶液。
考向三 离子推断
7.(2018山东济宁统考)某试液中只可能含有K
+
、N
、Fe
2+
、Al
3+
、Cl
-
、S
C
、Al
中的若干种离子,离子浓度均为0.1 mol·L
-1
,某同学进行了如
下实验:
下列说法正确的是
( )
A.原试液中存在N
、Fe
2+
、Cl
-
、S
B.滤液X中大量存在的阳离子有N
、Fe
2+
和Ba
2+
、
C.无法确定沉淀C的成分
D.无法确定原试液中是否含有Al
3+
、Cl
-
答案
A 加入过量稀硫酸无明显变化,说明不含C
,不含Al
;加入硝酸钡
有气体生成,由于已经加入了硫酸,N
在酸性条件下具有强氧化性,说明有Fe
2+
存在且被氧化,沉淀A为BaSO
4
;加入NaOH有气体,说明存在N
,沉淀B为氢
氧化铁沉淀;通入少量CO
2
产生沉淀,溶液呈碱性,且存在Ba
2+
,沉淀C为BaCO
3
。
因为存在的离子浓度均为0.1 mol·L
-1
,则原试液中只能含有N
、Fe
2+
、Cl
-
、
S
才能保证电荷守恒,K
+
必然不能存在。由上述分析可知,A项正确;滤液
X中大量存在的阳离子有N
、Fe
3+
和Ba
2+
,B项错误;沉淀C为BaCO
3
,C项错误;
原试液中不含Al
3+
,D项错误。
8.(2019广东化州二模)有一包粉末状固体,可能是由Al
2
(SO
4
)
3
、CuCl
2
、KNO
3
、
Na
2
O中的一种或几种组成的。为了探究它的成分,某学习小组做了如下
实验。
①取适量粉末投入蒸馏水中,粉末完全溶解,得到蓝色透明溶液A。
②取A溶液少量,向其中逐滴滴加烧碱溶液直到过量,观察到先有沉淀岀现,而
后沉淀逐渐增多,然后沉淀又逐渐减少,但最终仍有部分蓝色沉淀。
③再取A溶液两份,一份滴加BaCl
2
溶液后,出现白色沉淀;另一份滴加硝酸酸
化的硝酸银溶液后也出现白色沉淀。
请回答下列问题:
(1)原白色粉末中一定含有
,一定不含
,可能含
有
(填化学式)。
(2)写出过程②中涉及的离子方程式:
、
、
。
(3)如果要进一步确定可能存在的物质,进行的实验操作及实验现象和结论是
。
答案
(1)CuCl
2
和Al
2
(SO
4
)
3
Na
2
O KNO
3
(2)Cu
2+
+2OH
-
Cu(OH)
2
↓ Al
3+
+3OH
-
Al(OH)
3
↓ Al(OH)
3
+OH
-
Al
+2H
2
O
(3)用洁净的铂丝蘸取原样品在酒精灯火焰上灼烧,透过蓝色钴玻璃片观察火
焰颜色,若为紫色,则含有KNO
3
,否则不含
解析
①取适量粉末投入蒸馏水中,粉末完全溶解,得到蓝色透明溶液A,说明
含有CuCl
2
,不含Na
2
O;②取A溶液少量,向其中逐滴滴加烧碱溶液直到过量,观
察到先有沉淀出现,而后沉淀逐渐增多,然后沉淀又逐渐减少,但最终仍有部
分蓝色沉淀,说明含有Al
2
(SO
4
)
3
;③再取A溶液两份,一份滴加BaCl
2
溶液后,出
现白色沉淀,另一份滴加硝酸酸化的硝酸银溶液后也出现白色沉淀,说明原溶
液中含有硫酸根离子和氯离子。据此进行解答即可。
方法点拨
解答离子推断题的三大原则:(1)互斥性原则——离子之间发生反
应,不能共存;(2)进出性原则——注意实验过程中引入的离子对后续实验的
干扰;(3)电中性原则——任何电解质溶液都呈电中性,在定量推断中,可以由
此推断最后一种离子是否存在。
素养引领·情境命题
1.高铁酸钾(K
2
FeO
4
)是一种新型、高效的水处理剂,工业上通常用下列反应
先制得高铁酸钠:2FeCl
3
+10NaOH+3NaClO
2Na
2
FeO
4
+9NaCl+5H
2
O,然后
在某低温下,在高铁酸钠溶液中加KOH固体至饱和就可析出高铁酸钾。下列
说法不正确的是
(
B
)
A.NaClO在反应中作氧化剂
B.制取高铁酸钠时,每生成1 mol Na
2
FeO
4
,反应中共有6 mol电子转移
C.高铁酸钾在低温下的溶解度比高铁酸钠的溶解度小
D.
K
2
FeO
4
能消毒杀菌,其还原产物水解生成的Fe(OH)
3
胶体能吸附水中的悬浮杂质
答案
B 由2FeCl
3
+10NaOH+3NaClO
2Na
2
FeO
4
+9NaCl+5H
2
O可知,铁
元素化合价升高,发生氧化反应,FeCl
3
作还原剂;氯元素化合价降低,发生还原
反应,NaClO作氧化剂;根据反应可知,每生成2 mol Na
2
FeO
4
,转移电子6 mol。
由以上分析可知,A项正确,B项错误;根据题中信息可知,C项正确;K
2
FeO
4
具有
强氧化性,能消毒杀菌,其还原产物水解生成的Fe(OH)
3
胶体具有吸附作用,能
吸附水中的悬浮杂质,D项正确。
2.下列对各组粒子的评价正确的是
(
D
)
选项
粒子组
评价
A
无色溶液中:Na
+
、Al
3+
、S
、C
不能大量共存,因为有沉淀和气体生成2Al
3+
+C
+3H
2
O
2Al(OH)
3
↓+CO
2
↑
B
中性溶液中:Fe
3+
、N
、S
2-
、N
不能大量共存,因为有沉淀生成2Fe
3+
+3S
2-
Fe
2
S
3
↓
C
澄清溶液中:K
+
、Cu
2+
、Cl
-
、NH
3
·H
2
O
不能大量共存,因为有沉淀生成Cu
2+
+2OH
-
Cu(OH)
2
↓
D
酸性溶液中:Fe
2+
、Al
3+
、S
、I
-
能大量共存于同一溶液中
答案
D Al
3+
与C
在溶液中相互促进水解,离子方程式为2Al
3+
+3C
+
3H
2
O
2Al(OH)
3
↓+3CO
2
↑,A不正确;Fe
3+
与S
2-
可发生氧化还原反应生成Fe
2+
和S(S
2-
少量)或FeS和S(S
2-
足量),B不正确;NH
3
·H
2
O为弱碱,书写离子方程式时
不可拆,C不正确。
3.从某废催化剂(含ZnO、CuO、Fe
2
O
3
、石墨及MnO
2
等)中回收金属并制取
活性氧化锌的工艺流程如下(已知:Zn及其氧化物、氢氧化物的性质与Al及
其相应化合物性质类似):
(1)废催化剂“破碎”的目的是
。
(2)“氧化”时Mn
2+
被氧化的离子方程式为
。
(3)“中和、沉淀”时,若pH过高,则碱式碳酸锌的产率偏小。写出其反应的
离子方程式(任写一个即可):
。
(4)测得“粗铜粉”中铜的质量分数的实验步骤如下:
Ⅰ.准确称取粗铜粉
m
g,加入足量盐酸和H
2
O
2
溶液使其完全溶解。
Ⅱ.将溶液煮沸1~2 min,除去过量的H
2
O
2
。
Ⅲ.滴入铁掩蔽剂排除Fe
3+
的干扰。然后加入稍过量的KI溶液(反应:2Cu
2+
+4I
-
2CuI↓+I
2
),再加入几滴淀粉溶液作指示剂,用
c
mol·L
-1
Na
2
S
2
O
3
标准溶液
滴定至蓝色消失(I
2
+2S
2
2I
-
+S
4
)且半分钟内不变色,共消耗Na
2
S
2
O
3
标准溶液
V
mL。
①铜的质量分数为
。
②缺少步骤Ⅱ会使测得的铜的质量分数
(填“偏大”“偏小”或
“不变”)。
答案
(1)提高浸取率和浸取速率 (2)Mn
2+
+S
2
+3H
2
O
MnO(OH)
2
↓+
2S
+4H
+
(3)Zn(OH)
2
+2OH
-
Zn
+2H
2
O或Zn
2+
+4OH
-
Zn
+2H
2
O
或ZnCO
3
·2Zn(OH)
2
·H
2
O+4OH
-
ZnCO
3
+2Zn
+5H
2
O (4)①
%
②偏大
解析
(2)“氧化”时S
2
可以将Mn
2+
氧化成MnO(OH)
2
,反应的离子方程式
为Mn
2+
+S
2
+3H
2
O
MnO(OH)
2
↓+2S
+4H
+
。
(3)“中和、沉淀”时,若pH过高,则碱式碳酸锌的产率偏小。发生反应的离
子方程式有Zn(OH)
2
+2OH
-
Zn
+2H
2
O或Zn
2+
+4OH
-
Zn
+2H
2
O或
ZnCO
3
·2Zn(OH)
2
·H
2
O+4OH
-
ZnCO
3
+2Zn
+5H
2
O。
(4)①根据反应:2Cu
2+
+4I
-
2CuI↓+I
2
、I
2
+2S
2
2I
-
+S
4
可知关系2Cu
2+
~
I
2
~2S
2
,铜的质量分数为
×
100%=
%;②缺少步骤Ⅱ,则
被氧化的碘离子的量偏多,滴定时消耗的Na
2
S
2
O
3
标准液体积偏多,会使测得
的铜的质量分数偏大。
相关文档
- 山东版2021高考化学一轮复习专题四2021-07-0242页
- 2020-2021备战高考化学压轴题之氧2021-07-0228页
- 2021新高考化学鲁科版一轮复习同步2021-07-0230页
- 2021届一轮复习鲁科版氧化还原反应2021-07-029页
- 2019届一轮复习苏教版专题2第4讲氧2021-07-0217页
- 2018届二轮复习氧化还原反应课件(332021-07-0233页
- 2021版新高考地区选考化学(人教版)一2021-07-027页
- 2018届一轮复习人教版氧化还原反应2021-07-024页
- 山东版2021高考化学一轮复习专题四2021-07-0218页
- 2020届一轮复习人教版氧化还原反应2021-07-0213页