- 54.00 KB
- 2021-07-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
4.1.2 硫酸的制备和性质 教学设计
一、教学目标
知识与技能:
1、理解工业生产硫酸的基本原理、基本步骤和有关的化学反应;
2、掌握浓硫酸的特殊性:吸水性、脱水性、强氧化性;
3、了解硫酸、硫酸盐的用途。
过程和方法:
1、根据硫酸的用途引出硫酸的制法,根据制得的产品推测硫酸的性质;
2、采用探究法来学习硫酸的制备和浓硫酸的特性。
情感、态度与价值观:
1、认识化学与工业生产的密切联系;
2、逐步树立合理使用化学物质的概念。
二、教学重难点:硫酸的工业制法;浓硫酸的特性。
三、教学用具:
多媒体课件
化学仪器:铁架台(铁夹)、酒精灯、试管、玻璃棒、药匙、
化学试剂:浓硫酸、铜片、品红溶液、NaOH溶液、蔗糖、水、
硫酸铜晶体、硫黄固体。
四、教学方法:讲授法、探究法。
五、教学过程
教 师 活 动
学 生 活 动
设 计 意 图
[展示]:浓H2SO4样品
硫酸用途图片
给出硫黄样品
[问题]:硫经过哪些反应可制得H2SO4
学生观看
得出浓H2SO4的,
交流讨论。O2
H2O
O2
得出S→SO2→SO3→H2SO4
完成相应的化学方程式
了解硫酸物理性质、用途并引出硫酸的制法
探究H2SO4制取的三个步骤
4
教 师 活 动
学 生 活 动
设 计 意 图
[归纳]:目前硫酸工业制取的3个步骤。
[板书]:
一、硫酸的工业制法
步骤:
[介绍]:我国工业制硫酸不用S而用FeS2
高温
4 FeS2+11O2 2Fe2O3+8SO2
[问题]工业制硫酸用到什么原料?什么设备?
学生阅读教材。
学生观看模拟动画。
培养学生自学及观察能力
[过渡]酸有哪五点通性
[板书]二硫酸化学性质
1、酸的通性
[投影]:化学方程式:
①Zn+ H2SO4=ZnSO4+H2↑
②Fe2O3+3 H2SO4= Fe2(SO4)3 +3H2O
③2Fe(OH)3+3 H2SO4=Fe2(SO4)3+6H2O
④BaCl2+ H2SO4=BaSO4+2HCl
[问题]
上述四个反应中属于氧化还原反应的有,该反应中什么元素被还原?
学生个别回答:
①指示剂反应;
②与H前的金属发生置换反应
③与金属氧化物反应
④与碱反应
⑤与盐反应
学生集体回答
温故引新
[实验]:铜与浓H2SO4、常温、加热条件的情形
学生观察
实验现象:品红溶液褪色(SO2)
学会知识的对比
4
教 师 活 动
学 生 活 动
设 计 意 图
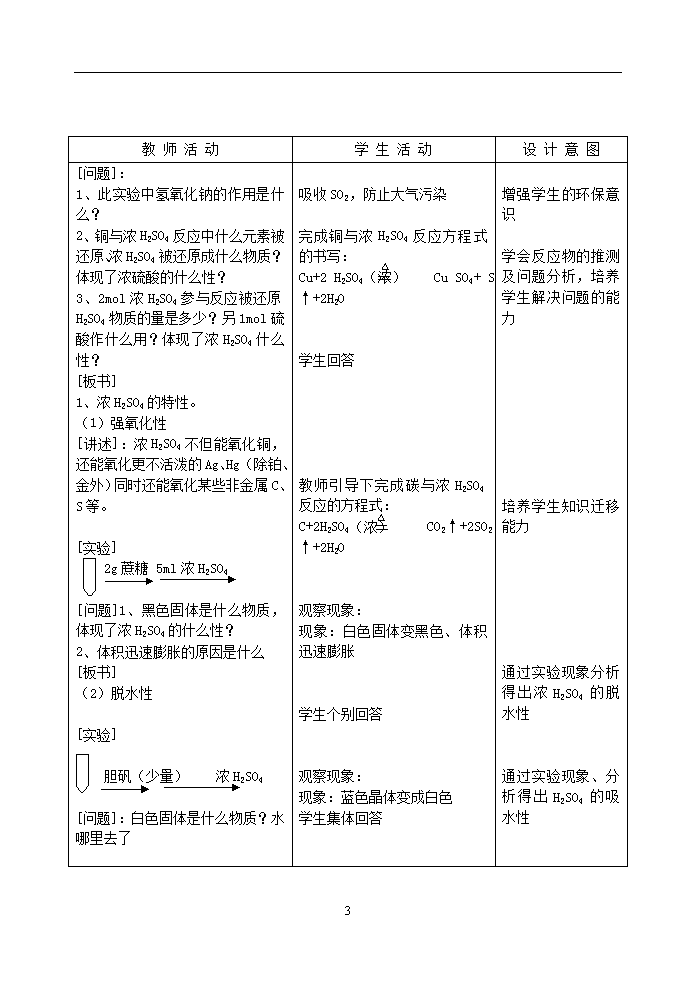
[问题]:
1、此实验中氢氧化钠的作用是什么?
2、铜与浓H2SO4反应中什么元素被还原、浓H2SO4被还原成什么物质?体现了浓硫酸的什么性?
3、2mol浓H2SO4参与反应被还原H2SO4物质的量是多少?另1mol硫酸作什么用?体现了浓H2SO4什么性?
[板书]
1、浓H2SO4的特性。
(1)强氧化性
[讲述]:浓H2SO4不但能氧化铜,还能氧化更不活泼的Ag、Hg(除铂、金外)同时还能氧化某些非金属C、S等。
[实验]
2g蔗糖 5ml浓H2SO4
[问题]1、黑色固体是什么物质,体现了浓H2SO4的什么性?
2、体积迅速膨胀的原因是什么
[板书]
(2)脱水性
[实验]
胆矾(少量) 浓H2SO4
[问题]:白色固体是什么物质?水哪里去了
吸收SO2,防止大气污染
△
完成铜与浓H2SO4反应方程式的书写:
Cu+2 H2SO4(浓) Cu SO4+ SO2↑+2H2O
学生回答
△
教师引导下完成碳与浓H2SO4反应的方程式:
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
观察现象:
现象:白色固体变黑色、体积迅速膨胀
学生个别回答
观察现象:
现象:蓝色晶体变成白色
学生集体回答
增强学生的环保意识
学会反应物的推测及问题分析,培养学生解决问题的能力
培养学生知识迁移能力
通过实验现象分析得出浓H2SO4的脱水性
通过实验现象、分析得出H2SO4的吸水性
4
教 师 活 动
学 生 活 动
设 计 意 图
[小结]:
浓、稀硫酸的比较
[知识小结]:
本节课内容
学生回答:
浓、稀H2SO4的比较
Zn
(气体)
氧化性及对应元素
Fe、Al
(常温)
吸水性
脱水性
浓硫酸
SO2
强、+6价的S
钝化
无
稀硫酸
H2
弱、+1价的H
反应
有
自学、资料卡片
掌握浓、稀硫酸的区别
培养学生自主学习习惯
六、板书设计:
点燃
一、硫酸的工业制法
步骤:S+O2 SO2
催化剂
△
2SO2+O2 2SO3
SO3+H2O=H2SO4
2、硫酸的性质
(一)物理性质
(二)化学性质
1、 酸的通性
2、 浓H2SO4的特性
强氧化性
脱水性
吸水性
4
相关文档
- 高中化学必修一全册课后优化训练:3-2021-07-026页
- 2019-2020学年高中化学人教版必修22021-07-0213页
- 2020_2021学年新教材高中化学第一2021-07-028页
- 高2021届高2018级高中化学一轮复习2021-07-0224页
- 高一化学教案:第5讲-硫、氮的相关计2021-07-0218页
- 2020_2021学年新教材高中化学第3章2021-07-0214页
- 高中化学第三章烃的含氧衍生物1醇2021-07-025页
- 2020高中化学 第一章 认识化学科学2021-07-024页
- 2019高中化学 第二章 化学反应速率2021-07-027页
- 2019-2020学年新教材高中化学课后2021-07-027页