- 353.50 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2012届高考化学二轮专题复习:实验专题训练(四)
1.(16分)某兴趣小组在实验室用铜和硫酸为原料多种方法制取硫酸铜。制备方法如下:
方法一:
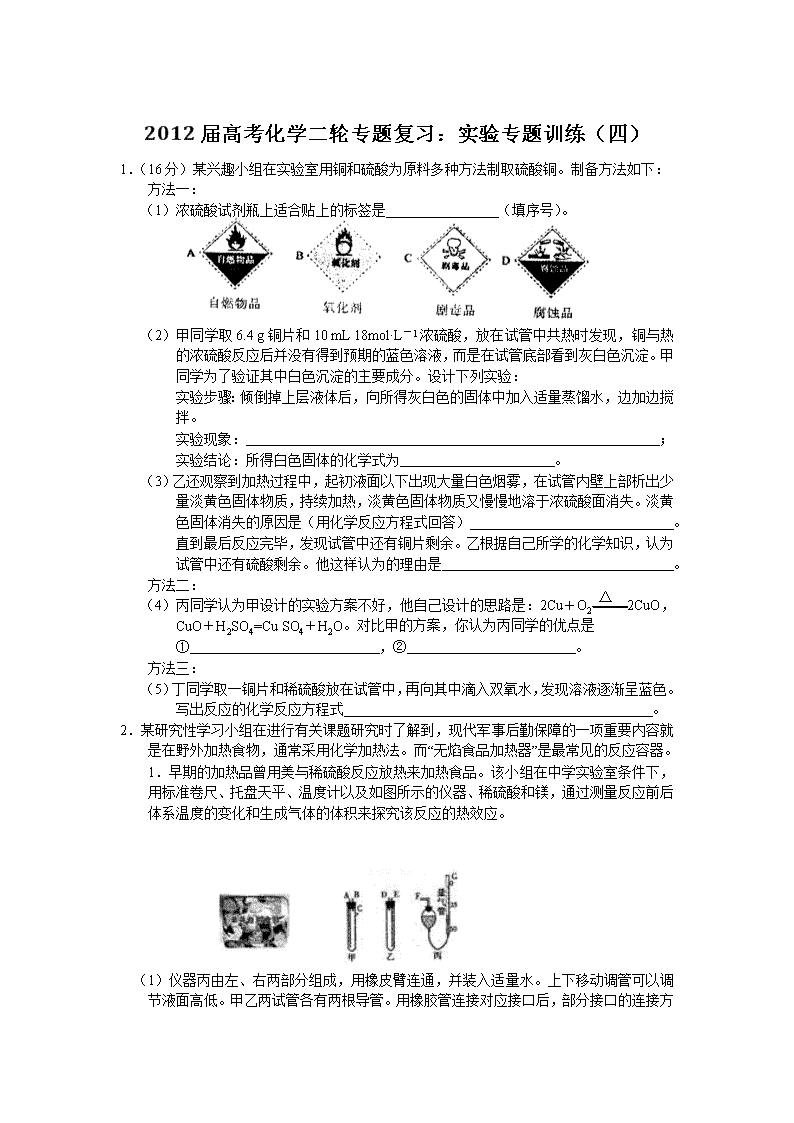
(1)浓硫酸试剂瓶上适合贴上的标签是 (填序号)。
(2)甲同学取6.4 g铜片和10 mL 18mol·L-1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀。甲同学为了验证其中白色沉淀的主要成分。设计下列实验:
实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌。
实验现象: ;
实验结论:所得白色固体的化学式为 。
(3)乙还观察到加热过程中,起初液面以下出现大量白色烟雾,在试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体物质又慢慢地溶于浓硫酸面消失。淡黄色固体消失的原因是(用化学反应方程式回答) 。直到最后反应完毕,发现试管中还有铜片剩余。乙根据自己所学的化学知识,认为试管中还有硫酸剩余。他这样认为的理由是 。
△
方法二:
(4)丙同学认为甲设计的实验方案不好,他自己设计的思路是:2Cu+O2 2CuO,CuO+H2SO4=Cu SO4+H2O。对比甲的方案,你认为丙同学的优点是
① ,② 。
方法三:
(5)丁同学取一铜片和稀硫酸放在试管中,再向其中滴入双氧水,发现溶液逐渐呈蓝色。写出反应的化学反应方程式 。
2.某研究性学习小组在进行有关课题研究时了解到,现代军事后勤保障的一项重要内容就是在野外加热食物,通常采用化学加热法。而“无焰食品加热器”是最常见的反应容器。
1.早期的加热品曾用美与稀硫酸反应放热来加热食品。该小组在中学实验室条件下,用标准卷尺、托盘天平、温度计以及如图所示的仪器、稀硫酸和镁,通过测量反应前后体系温度的变化和生成气体的体积来探究该反应的热效应。
(1
)仪器丙由左、右两部分组成,用橡皮臂连通,并装入适量水。上下移动调管可以调节液面高低。甲乙两试管各有两根导管。用橡胶管连接对应接口后,部分接口的连接方式如下:A接连 ,C接连 (填写各接口的编号)。实验开始时,只要倒置盛有稀硫酸的试管 (填仪器编号),即可引发反应,故出气体。
(2)检查该装置的气密性的方法是:将仪器丙的右管上移,
。
II.由于稀硫西安不便携带。带代各国基本上都改用新的配方,该小组通过查阅资料得知。新配方的主要化学成分为镁粉、铁粉、氧化钠,使用时加入水与其中的镁反应放出热量。下面是某资料中记载的20℃下对该产品的两个探究实验:
[实验1]向加有等量水的隔热容器中分别加入下列各组物质,结果参见图1。
①1.0mol镁条、0.10mol铁粉、0.10mol氯化钠粉末;
②将1.0mol镁条剪成100份、0.10mol铁粉、0.10mol氯化钠粉末;
③1.0mol镁粉、0.10mol铁粉、0.10mol氯化钠粉末
[实验2]向如有100mL水的隔热容器中分别加入0.10mol镁粉,0.50mol铁粉及不同量的氯化钠粉末,不断搅拌,分别记录温度升高的最大值如图2.
请回答下列问题:
(1)实验1是证实影响镁与水反应速率的主要因素为 。
(2)实验2中NaCl的用量不必大于0.125mol,原因是
。
(3)实验2中若加入0.060mol NaCl,则实验达到的最高温度接近于 。
A.34℃ B.42℃ C.50℃ D.62℃
(4)铁粉、NaCl能使反应速率增加的原因是 。
3.(15分)
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为两者反应生成只有CuCO3一种沉淀;
乙同学认为这两者相互促进水解反应,生成Cu(OH)2一种沉淀;
丙同学认为生成CuCO3和Cu(OH)2两种沉淀。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照乙同学的理解Na2CO3溶液和CuSO4溶液反应的化学反应方程式为
;在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为①过滤②洗涤③干燥。
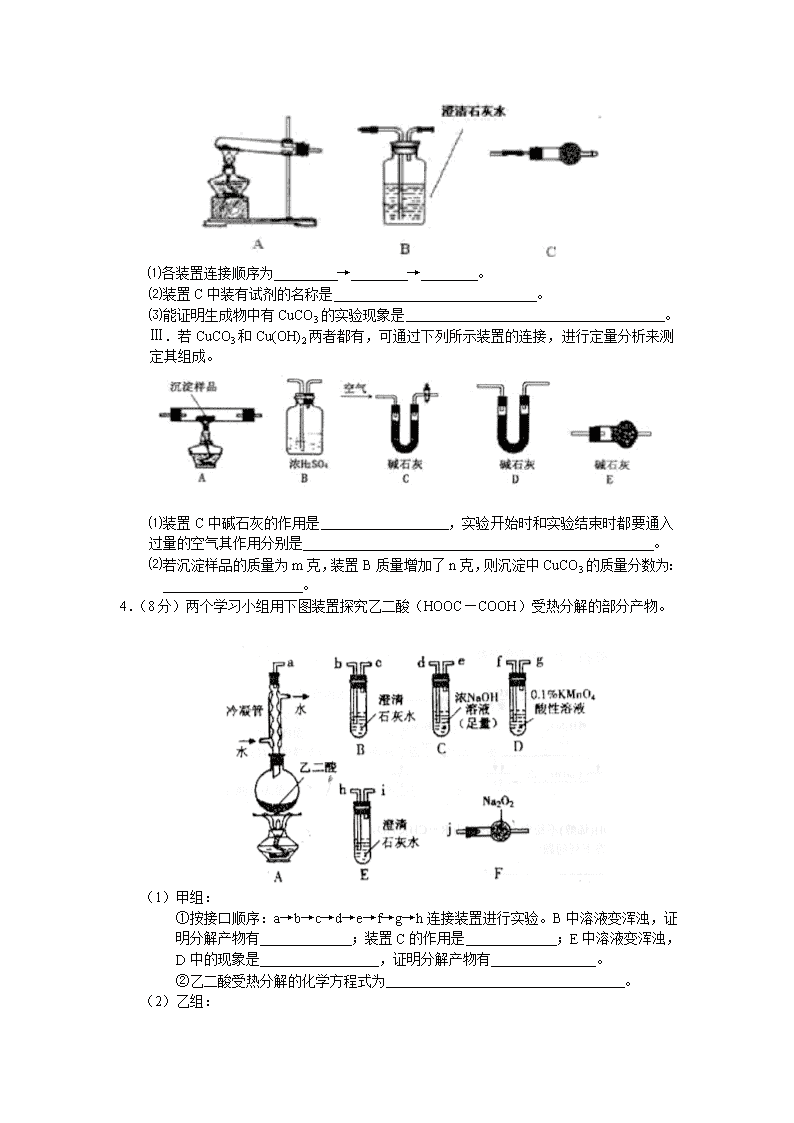
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
⑴各装置连接顺序为 → → 。
⑵装置C中装有试剂的名称是 。
⑶能证明生成物中有CuCO3的实验现象是 。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可通过下列所示装置的连接,进行定量分析来测定其组成。
⑴装置C中碱石灰的作用是 ,实验开始时和实验结束时都要通入过量的空气其作用分别是 。
⑵若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为:
。
4.(8分)两个学习小组用下图装置探究乙二酸(HOOC—COOH)受热分解的部分产物。
(1)甲组:
①按接口顺序:a→b→c→d→e→f→g→h连接装置进行实验。B中溶液变浑浊,证明分解产物有 ;装置C的作用是 ;E中溶液变浑浊,D中的现象是 ,证明分解产物有 。
②乙二酸受热分解的化学方程式为 。
(2)乙组:
①将接口a与j连接进行实验,观察到F中生成的气体可使带火星的木条复燃,则F中最主要反应的化学方程式为 。
②从A—F中选用装置进行实验,证明甲组通入D的气体能否与Na2O2反应。
最简单的装置接口连接顺序是 ;实验后验证F中的固体可采用的方法是 (可另选试剂)。
5.(15分)新型材料纳米粉具有超强的磁性能,可用作高密度磁记录的介质以及高效催化剂等。在不同温度下,粉与水蒸气反应的固体产物不同:温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4。某校化学小组学生利用下图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去)。
(1)在高温下,装置B中发生反应的化学方程式是 。
(2)请在下列装置中选择满足虚线框图C的气体收集装置 。
(3)该小组同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
【查阅资料】该小组同学通过资料得知,固体产物中一般不会同时出现三种形态混合物组合。
【提出假设】
假设1:全部为氧化亚铁;
假设2:全部为四氧化三铁;
假设3:铁和氧化亚铁混合物;
假设4:铁和四氧化三儿混合物;
假设5: 。
【设计方案】小组成员讨论后对假设4提出实验方案(不要在答题卡上作答)
【实验过程】
根据上述设计的方案进行实验。在答题卡上按下表的格式写出实验步骤、预期现象与结论。
实验步骤
实验操作
实验现象
Ⅰ
将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入适量盐酸,微热
黑色粉末全部溶解,溶液呈 ,有少量气泡产生
Ⅱ
向实验Ⅰ中得到的溶液加几滴KSCN溶液,振荡
溶液不显血红色
【交流讨论】①实验步骤Ⅱ加入 KSCN后溶液不显血红色的原因 。
②继续向Ⅱ溶液中加稀硝酸,立即出现血色,写出该过程中发生变化的离子方程式 。
参考答案
1.(16分)
(1)BD 2分
△
(2)沉淀中白色物质溶解,溶液变蓝色;CuSO4 4分
(3)S+2H2SO4(浓) 3SO2↑+2H2O 3分
随着反应的进行,浓硫酸的浓度逐渐变小,由浓变稀,稀硫酸不能与铜发生反应;2分
(4)产生等量的硫酸铜,乙消耗的硫酸更少,而且不产生污染物SO2。 2 分
(5)H2SO4+Cu+H2O2 CuSO4+2H2O2 3分
2.(16分)(每空2分)
I.(1)D、F;乙
(2)如果看到丙的两端液面形成了一段稳定的高度差,则说明气密性良好。
II.(1)(1)镁的表面积 (2)乙达到沸点不会再有湿度变化
(3)D (4)镁粉、铁粉与NaCl的水溶液构成了原电池
3.(15分)
Ⅰ.Na2CO3 +CuSO4 +H2O=Cu(OH)2↓+Na2SO4+CO2↑(2分);
Ⅱ.(1)A→C→B(2分)(2)无水硫酸铜(2分)
(3)装置B中澄清石灰水变浑浊(2 分)
Ⅲ.(1)吸收空气中的H2O 蒸汽和CO2(2分),开始时通入处理过的空气可以将装置中原有含H2O 蒸汽和CO2的空气排出;结束时通入处理过的空气可以将装置中滞留的H2O 蒸汽和CO2排出。(2分)
(2)1-(49n/9m)(3分)
4.(8分)
△
(1)①CO2;充他除去CO2;溶液褪色或变浅,CO
②HOOC—COOH CO2↑+CO↑+H2O
(2)①Na2O2+2CO2=2Na2CO3+O2
②a—d—e—j;取F中的固体,滴加稀硫酸,将生成的气体通入澄清石灰水中,若变浑浊,则发生了反应;若不变浑浊,则未发生反应。
5.(15分)(1)3Fe+4H2O(g) Fe3O4+4H2 3分
(2)bd 2分
(3)氧化亚铁和四氧化三铁}昆合物 2分
浅绿色 2分
【实验讨论】①无Fe3+ 2分
②Fe3++4H++NO3- 3Fe3++NO↑+2H2O
Fe3++3SCN- Fe(SCN)3(合理也给分) 4分
相关文档
- 2018届高考化学二轮专题复习微观结2021-07-033页
- 2012届高考化学二轮专题复习:实验专2021-07-025页
- 2012届高考化学二轮专题复习:实验专2021-07-025页
- 2012届高考化学二轮专题复习:实验专2021-07-026页
- 高考化学二轮专题复习资料汇总题型2021-05-1426页
- 高考化学二轮专题复习精选——电化2021-05-138页
- 高考化学二轮专题复习选考模块化学2021-05-1314页
- 高考化学二轮专题复习汇编试卷G单2021-05-1339页
- 高考化学二轮专题复习化学流程图专2021-05-1313页
- 高考化学二轮专题复习十六综合实验2021-05-135页