- 306.50 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
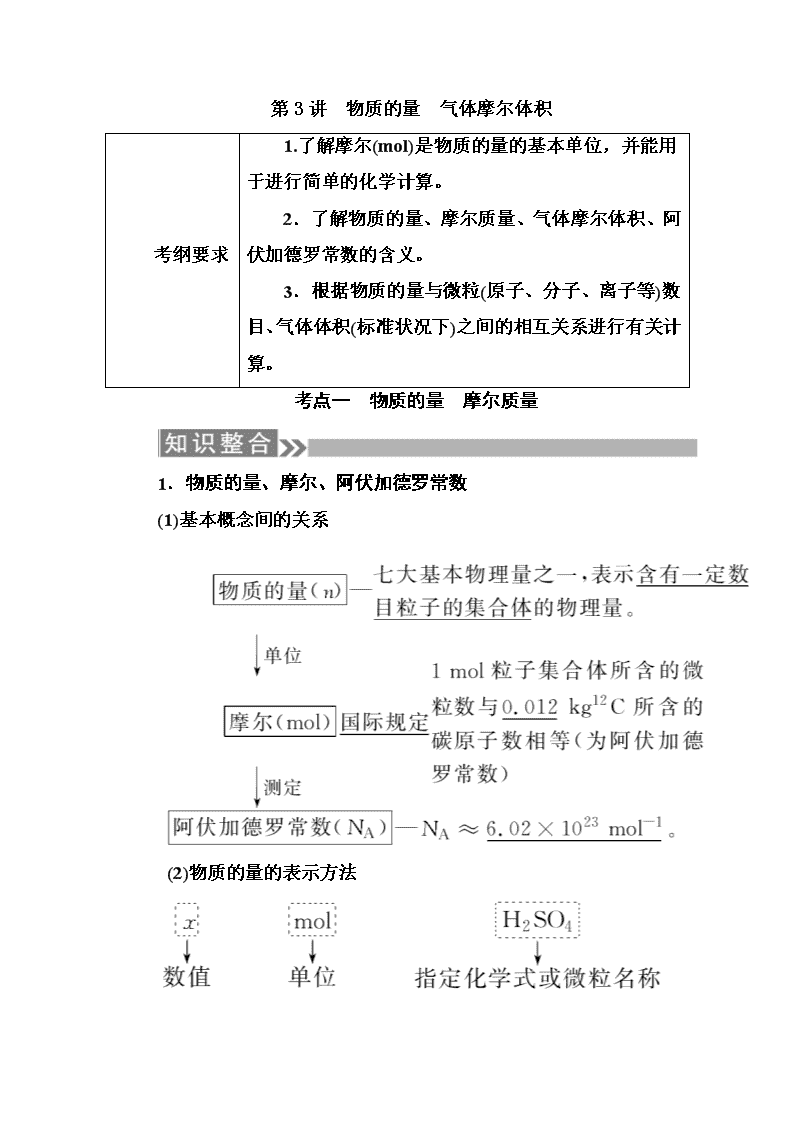
第3讲 物质的量 气体摩尔体积
考纲要求
1.了解摩尔(mol)是物质的量的基本单位,并能用于进行简单的化学计算。
2.了解物质的量、摩尔质量、气体摩尔体积、阿伏加德罗常数的含义。
3.根据物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系进行有关计算。
考点一 物质的量 摩尔质量
1.物质的量、摩尔、阿伏加德罗常数
(1)基本概念间的关系
(2)物质的量的表示方法
(3)物质的量与微粒数、阿伏加德罗常数之间的关系为:n=。
2.摩尔质量
(1)摩尔质量是单位物质的量的物质所具有的质量。常用单位是g/mol或g·mol-1。
公式:M=。
(2)数值:以g/mol为单位时,任何粒子的摩尔质量在数值上都等于该粒子的相对原子质量或相对分子质量_。
【感悟测评】
判断正误(正确的打“√”,错误的打“×”)
(1)1 mol任何物质都含有6.02×1023个分子。( )
(2)1 mol水中含有2 mol氢和1 mol 氧。( )
(3)NaOH的摩尔质量为40 g。( )
(4)1 mol O2的质量与它的相对分子质量相等。( )
(5)阿伏加德罗常数与6.02×1023完全相同,是指每摩尔物质所含微粒数。( )
答案:(1)× (2)× (3)× (4)× (5)×
阿伏加德罗常数的判断——七种设陷方式
陷阱一 气体摩尔体积适用条件
22.4 L·mol-1指在标准状况下(0 ℃、101 kPa)的气体摩尔体积。若题中给出气体的体积,需考虑气体所处状况是否为标准状况。
陷阱二 物质的聚集状态
气体摩尔体积适用的对象是气体(包括混合气体)。一些在标准状况下是液体或固体的物质,如CCl4、水、液溴、SO3
、己烷、苯等常作为命题的干扰因素。
陷阱三 物质的微观结构
清楚认识微粒中相关粒子数(质子数、中子数、电子数、原子数、离子数、电荷数、化学键)之间的关系。常涉及稀有气体He、Ne等单原子分子,Cl2、N2、O2、H2等双原子分子及O3、P4、18O2、D2O、SiO2等特殊物质。
陷阱四 电解质溶液
注重对弱电解质的电离和盐类水解等知识点的正确理解,关键是要弄清电离和水解的实质,以及相对强弱。如1 L 1 mol·L-1的NH4Cl溶液中NH的数目小于NA。
陷阱五 氧化还原反应中电子转移的数目
较复杂的氧化还原反应中,求算电子转移的数目时,要清楚认识哪种元素的原子间发生电子转移。如Na2O2与H2O、CO2,Cl2与NaOH溶液反应等。
陷阱六 分散系的变化导致微粒数目的变化
如FeCl3溶液转化为Fe(OH)3胶体,因为胶体粒子是分子的集合体,所以胶粒的数目小于原溶液中Fe3+的数目。
陷阱七 可逆反应不能进行到底
如2NO2??N2O4,Cl2+H2OHCl+HClO等。
考向一 有关概念的理解与应用
1.(2018·安徽太和检测)根据甲和乙两个对应的物理量,不能求出物质的量的是( )
选项
甲
乙
A
物质中的粒子数
阿伏加德罗常数
B
固体的体积
固体的密度
C
纯净物的质量
纯净物的组成
D
标准状况下的气体摩尔体积
标准状况下的气体体积
解析:A项,n=;B项只能求出此固体的质量,不能求其物质的量;C项,根据组成确定摩尔质量,n=;D项,n=。
答案:B
2.下列说法中正确的是( )
A.H2的摩尔质量是2 g
B.1 mol氧的质量是16 g
C.氧气的摩尔质量是32 g·mol-1
D.2 g H2含1 mol H
解析:摩尔质量的单位是g·mol-1,A错;1 mol氧,没指明微粒种类,B错;C正确;2 g H2物质的量为1 mol,含2 mol H,D错。
答案:C
考向二 微粒数与相关物理量的计算
3.下列数量的各物质所含原子个数由大到小顺序排列的是( )
①0.5 mol氨气 ②4 g 氦气 ③4 ℃时9 mL水 ④0.2 mol 磷酸钠
A.①④③② B.④③②①
C.②③④① D.①④②③
解析:①中原子物质的量为0.5 mol×4=2 mol;②中原子物质的量为1 mol;③中原子物质的量为×3=1.5 mol;④
中原子物质的量为0.2 mol×8=1.6 mol,故原子数由大到小为①④③②。
答案:A
4.某硫原子的质量是a g,12C原子的质量是b g,若NA只表示阿伏加德罗常数的数值,则下列说法中正确的是( )
①该硫原子的相对原子质量为 ②m g该硫原子的物质的量为 mol ③该硫原子的摩尔质量是aNA g ④a g该硫原子所含的电子数为16NA
A.①③ B.②④
C.①② D.②③
解析:该硫原子的相对原子质量Mr(S)==,①对;该硫原子的摩尔质量M(S)=a g×NA mol-1=a NA g·mol-1,③错;m g该硫原子的物质的量n(S)== mol,②对;a g硫原子即1个硫原子,其中所含电子数为16,④错。
答案:C
【技法归纳】 原子数目比较的思路方法
(1)正确计算组成微粒的物质的量。
(2)正确判断原子数与微粒间的倍数关系,如氦气是单原子分子。
考点二 气体摩尔体积、阿伏加德罗定律
1.影响物质体积的因素
2.气体摩尔体积
3.阿伏加德罗定律
(1)内容:同温同压下:相同体积的任何气体含有相同数目的分子(或气体的物质的量相同),即:T1=T2,p1=p2,V1=V2⇒N1=N2。
(2)适用范围:单一气体或相互不反应的混合气体。
(3)推论
类型
条件
结论
类型一
同温同压
V1/V2=n1/n2
V1/V2=n1/n2
类型二
同温同容
p1/p2=n1/n2
注:以上用到的符号ρ为密度、p为压强、n为物质的量、M为摩尔质量、V为气体体积
【感悟测评】
1.判断正误(正确的打“√”,错误的打“×”)
(1)标准状况下,6.02×1023个分子所占的体积约是22.4 L( )
(2)0.5 mol H2所占体积为11.2 L( )
(3)标准状况下,1 mol H2O的体积为22.4 L( )
(4)标准状况下,28 g CO与N2的混合气体的体积约为22.4 L( )
(5)气体的摩尔体积为22.4 L·mol-1时的状况一定为标准状况( )
(6)在同温同压下,体积相同的任何气体或混合气体的分子总数相同 ( )
(7)在常温常压下,1 mol气体的体积大于22.4 L( )
(8)在温度和压强一定时,气体的体积主要由物质所含微粒数目决定 ( )
答案:(1)× (2)× (3)× (4)√ (5)× (6)√
(7)√ (8)√
1.决定气体体积大小的因素是气体分子数和温度、压强。因此,在使用特定条件下气体摩尔体积进行计算时,必须注明气体所处的温度、压强。
2.阿伏加德罗定律
:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。理解阿伏加德罗定律可以记住四同:同温、同压、同体积、同分子数或物质的量。即:
T1=T2、p1=p2、V1=V2⇒n1=n2。
3.阿伏加德罗定律的推论
描述气体状态的四个参数:温度(T)、压强(p)、所占体积(V)和物质的量(n)之间满足如下关系:①pV=nRT,称为理想气体状态方程。从方程①还可导出②pV=RT或③pM=ρRT(m为气体的质量,M为气体的摩尔质量,ρ为气体的密度)。利用①②③方程可导出一系列的关系,即阿伏加德罗定律的推论为:
相同条件
结论
公式
语言叙述
T、p相同
=
同温同压下,气体的体积与其物质的量成正比
T、p相同
=
同温同压下,气体的密度与其摩尔质量成正比
T、V相同
=
温度、体积相同的气体,压强与其物质的量成正比
T、p、V
相同
=
同温同压下,体积相同的气体质量与摩尔质量成正比
T、p、m相同
=
同温同压下,等质量的气体,摩尔质量与其体积成反比
考向一 气体体积与其他物理量间的换算
1.在标准状况下,对下列四种气体的描述正确的是( )
①6.72 L CH4 ②3.01×1023个HCl分子 ③13.6 g H2S ④0.2
mol NH3
a.体积②>③>①>④
b.密度②>③>④>①
c.质量②>③>①>④
d.氢原子个数①>③>④>②
A.仅abc B.仅bcd
C.仅abd D.abcd
解析:先把题中提供的量都分别转化为各物质的物质的量,然后再比较它们的体积、密度等。标准状况下6.72 L CH4的物质的量为0.3 mol,3.01×1023个 HCl分子的物质的量为0.5 mol,13.6 g H2S的物质的量为0.4 mol,然后进行比较即可得出结论。
答案:D
2.设NA为阿伏加德罗常数的值,如果a g某双原子分子气体的分子数为p,则b g该气体在标准状况下的体积V (L)是( )
A. B.
C. D.
解析:a g该双原子分子气体的分子数为p,则b g该气体的分子数为,可得b g该气体的物质的量为(mol),则b g该气体在标准状况下的体积为(L)。
答案:D
考向二 阿伏加德罗定律及推论的应用
3.在体积相同的两个密闭容器中分别充满O2和O3,当这两个容器内的温度和气体密度相等时,下列说法正确的是 ( )
A.两种气体的压强相等
B.O2比O3的质量小
C.两种气体的分子数目相等
D.两种气体的氧原子数目相等
解析:体积和密度相等时,两容器内气体的质量相等,且O2和O3都由O元素组成,则O原子的质量、个数以及物质的量相等,因O原子个数相等,则两种气体的物质的量之比n(O2)∶n(O3)=3∶2。由pV=nRT可知,两种气体的压强之比为3∶2,故A、B错误,D正确;因二者的质量相等,但相对分子质量不同,所以二者的分子数不相等,故C错误。
答案:D
4.下列条件中,两种气体所含原子数一定相等的是 ( )
A.同质量、不同密度的N2和CO
B.同温度、同体积的N2和H2
C.同体积、同密度的C2H6和NO
D.同压强、同体积的N2O和CO2
解析:A选项N2和CO摩尔质量均为28 g·mol-1,同质量的N2和CO物质的量相同,一个分子均含有2个原子,正确;B选项没有注明压强、D没有注明温度,均不符合;C选项C2H6和NO质量相同,物质的量相同,所以原子个数C2H6是NO的4倍,不符合。
答案:A
考向三 气体摩尔质量的计算
5.在一定条件下,m g NH4HCO3完全分解生成NH3、CO2、H2O(g),按要求填空。
(1)若所得混合气体对H2的相对密度为d
,则混合气体的物质的量为________。NH4HCO3的摩尔质量为________: (用含m、d的代数式表示)。
(2)所得混合气体的密度折合成标准状况为ρ g·L-1,则混合气体的平均摩尔质量为________。
(3)在该条件下,所得NH3、CO2、H2O(g)的体积分数分别为a%、b%、c%,则混合气体的平均相对分子质量为________________。
答案:(1) mol 6d g·mol-1
(2)22.4ρ g·mol-1
(3)17a%+44b%+18c%
考点三 与NA有关的正误判断
NA正误判断的七大陷阱
考查方向
注意问题
气体摩尔体积的适用条件
若题中出现物质的体积,先考虑是否是气体,如是气体再考虑条件是否为标准状况
物质的聚集状态
熟悉在标准状况下是液体或固体的物质,如CCl4、H2O、SO3、己烷、苯、酒精、CHCl3等
氧化还原反应中的电子转移
如Na2O2、NO2与H2O反应,电解AgNO3溶液,Fe、Cu与S反应,Cl2与H2O、NaOH反应,Fe与稀HNO3反应等
FeCl3溶液转化为Fe(OH)3
分散系中的微粒数目
胶体,因为胶体微粒是分子的集合体,所以胶粒的数目小于原溶液中Fe3+的数目
隐含的可逆反应
可逆反应不能进行到底,如2NO2N2O4、Cl2+H2OHClO+HCl、合成氨反应、二氧化硫的催化氧化等
物质的微观结构
①某些物质分子中的原子个数,如Ne、O3、P4等;②特殊物质的摩尔质量或分子中的中子数,如D2O、T2O、18O2、H37Cl等;③一些物质中的化学键数目,如SiO2、晶体Si、金刚石、CH4、P4、CO2、C60、烃中碳碳键数等
电解质的电离与水解
弱电解质的电离及某些离子的水解,如1 mol CH3COOH或1 mol FeCl3溶于水时,溶液中CH3COO-或Fe3+的物质的量均小于1 mol
【感悟测评】
判断正误(正确的打“√”,错误的打“×”)
(1)常温常压下,22 g CO2气体所含的分子数大于0.5NA。( )
(2)18 g D2O所含的电子数为10NA。( )
(3)5.6 g铁与足量的稀硫酸反应失去电子数为0.3NA。( )
(4)2 mol SO2和1 mol O2在一定条件下充分反应后,混合物的分子数为2NA。( )
(5)1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA。( )
答案:(1)× (2)× (3)× (4)× (5)×
考向一 考查气体摩尔体积的适用条件及物质的聚集状态
1.判断正误(正确的打“√”,错误的打“×”)
(1)2.24 L CO2中含有的原子数为0.3NA( )
(2)常温下,11.2 L甲烷气体含有的甲烷分子数为0.5NA( )
(3)标准状况下,18 g H2O所含的氧原子数目为NA( )
答案:(1)× (2)× (3)√
考向二 考查物质的组成和结构
2.判断正误(正确的打“√”,错误的打“×”)
(1)18 g D2O所含的电子数为10NA( )
(2)1 mol Na2O2固体中含离子总数为4NA( )
(3)4.5 g SiO2晶体中含有的硅氧键的数目为0.3NA( )
(4)12 g金刚石中含有的共价键数为2NA
(5)12 g石墨中含有的共价键数为1.5NA( )
(6)31 g白磷中含有的共价键数为1.5NA( )
答案:(1)× (2)× (3)√ (4)√ (5)√ (6)√
【速记卡片】 记“组成”突破
(1)记特殊物质中所含微粒的数目,如Ne、D2O、18O2、-OH、OH-等。
(2)记最简式相同的物质,如NO2和N2O4、乙烯(C2H4)和丙烯(C3H6)等。
(3)记摩尔质量相同的物质,如N2、CO、C2H4等。
(4)记物质中所含化学键的数目,如H2O2、CnH2n+2中化学键的数目分别为3、3n+1。
考向三 考查电解质溶液中粒子的数目
3.判断正误(正确的打“√”,错误的打“×”)
(1)将0.1 mol氯化铁溶于1 L水中,所得溶液中含有0.1NA个Fe3+( )
(2)25 ℃时,1 L pH=12的氨水中,含有OH-的数目为0.01NA( )
(3)25 ℃时,1 L 0.1 mol·L-1FeCl3溶液中含有0.1NA个Fe(OH)3胶体粒子( )
(4)0.1 mol·L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA( )
答案:(1)× (2)√ (3)× (4)×
【速记卡片】 审准“题目”突破
(1)是否有弱离子的水解;
(2)是否指明了溶液的体积;
(3)所给条件是否与电解质的组成有关,如pH=1的H2SO4溶液c(H+)=0.1 mol·L-1,与电解质的组成无关;0.05 mol·L-1的Ba(OH)2溶液,c(OH-)=0.1 mol·L-1,与电解质的组成有关。
考向四 考查氧化还原反应中电子转移的数目
4.判断正误(正确的打“√”,错误的打“×”)
(1)1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA( )
(2)1 mol Na2O2与足量CO2充分反应转移的电子数为2NA( )
(3)1 mol Fe与少量的稀硝酸反应,转移3NA个电子( )
(4)在反应KIO3+6HI===3I2+KI+3H2O中,每生成1 mol I2转移电子数为2NA( )
(5)向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子数目为NA( )
答案:(1)√ (2)× (3)× (4)× (5)×
考向五 考查“隐含反应”
5.判断正误(正确的打“√”,错误的打“×”)
(1)2 mol SO2和1 mol O2在一定条件下充分反应后,混合物的分子数为2NA( )
(2)标准状况下,22.4 L NO2气体中所含分子数目为NA( )
(3)100 g 17%的氨水,溶液中含有的NH3分子数为NA( )
(4)标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA( )
答案:(1)× (2)× (3)× (4)×
1.(2017·高考全国卷Ⅱ)阿伏加德罗常数的值为NA。下列说法正确的是( )
A.1 L 0.1 mol· L-1NH4Cl溶液中,NH的数量为0.1NA
B.2.4 g Mg与H2SO4完全反应,转移的电子数为0.1NA
C.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
D.0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2NA
解析:A.因铵根离子水解,其数量小于0.1NA,A错误;B.2.4 g Mg为0.1 mol,与硫酸完全反应后转移的电子数为0.2NA,B错误;C.标准状况下,2.24 L任何气体所含有的分子数都为0.1NA,C错误;D正确。
答案:D
2.(2017·高考全国卷Ⅲ)NA为阿伏加德罗常数的值。下列说法正确的是( )
A.0.1 mol的11B中,含有0.6NA个中子
B.pH=1的H3PO4溶液中,含有0.1NA个H+
C.2.24 L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2
分子
D.密闭容器中1 mol PCl3与1 mol Cl2反应制备PCl5(g),增加2NA个P-Cl键
解析:A.1个11B中含有6个中子,0.1 mol 11B含有0.6NA个中子,A正确;B.溶液体积未定,不能计算氢离子个数,B错误;C.标准状况下苯是液体,不能利用气体摩尔体积计算22.4 L苯完全燃烧产生的CO2分子数目,C错误;D.PCl3与Cl2反应生成PCl5的反应是可逆反应,所以1 mol PCl3与1 mol Cl2反应制备PCl5,增加的P—Cl键的数目小于2NA个,D错误。
答案:A
3.(2016·高考全国卷Ⅰ)设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A.14 g乙烯和丙烯混合气体中的氢原子数为2NA
B.1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.1 mol Fe溶于过量硝酸,电子转移数为2NA
D.标准状况下,2.24 LCCl4含有的共价键数为0.4NA
解析:A.乙烯和丙烯的最简式相同,均是CH2,14 g乙烯和丙烯混合气体中的氢原子数为×2×NA=2NA,正确;B.N2与H2反应生成的NH3的反应是可逆反应,反应物不能完全转化为生成物。 1 mol N2与4 mol H2反应生成的NH3分子数小于2NA,B错误;C.1 mol Fe溶于过量硝酸生成硝酸铁,电子转移数为3NA,错误;D.标准状况下四氯化碳是液态,不能利用气体摩尔体积计算物质的量,错误。
答案:A
4.(2016·高考四川卷)NA为阿伏加德罗常数的值。下列说法正确的是( )
A.2.4g Mg在足量O2中燃烧,转移的电子数为0.1NA
B.标准状况下,5.6L CO2气体中含有的氧原子数为0.5NA
C.氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA
D.0.1 L 0.5 mol/L CH3COOH溶液中含有的H+数为0.05NA
解析:A.2.4 g镁的物质的量为0.1 mol,反应中失去0.2 mol电子,故错误;B.标准状况下5.6 L二氧化碳的物质的量为0.25 mol,含有的氧原子为0.5 mol,故正确;C.氢原子数为0.4NA的甲醇分子为0.1 mol,含有5 mol σ键,故错误;D.醋酸是弱酸,不能完全电离,故错误。
答案:B
相关文档
- 2021届高考化学一轮复习化学实验基2021-07-056页
- 2020届高考化学一轮复习化学平衡状2021-07-0518页
- 2020届高考化学一轮复习化学平衡状2021-07-0530页
- 2020届高考化学一轮复习化学与STSE2021-07-057页
- 2020届高考化学一轮复习化学实验方2021-07-0510页
- 2020届高考化学一轮复习化学与可持2021-07-0513页
- 2020届高考化学一轮复习化学实验基2021-07-059页
- 2020届高考化学一轮复习化学反应与2021-07-058页
- 2021届高考化学一轮复习化学平衡常2021-07-0516页
- 2020届高考化学一轮复习化学计量在2021-07-058页