- 501.77 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
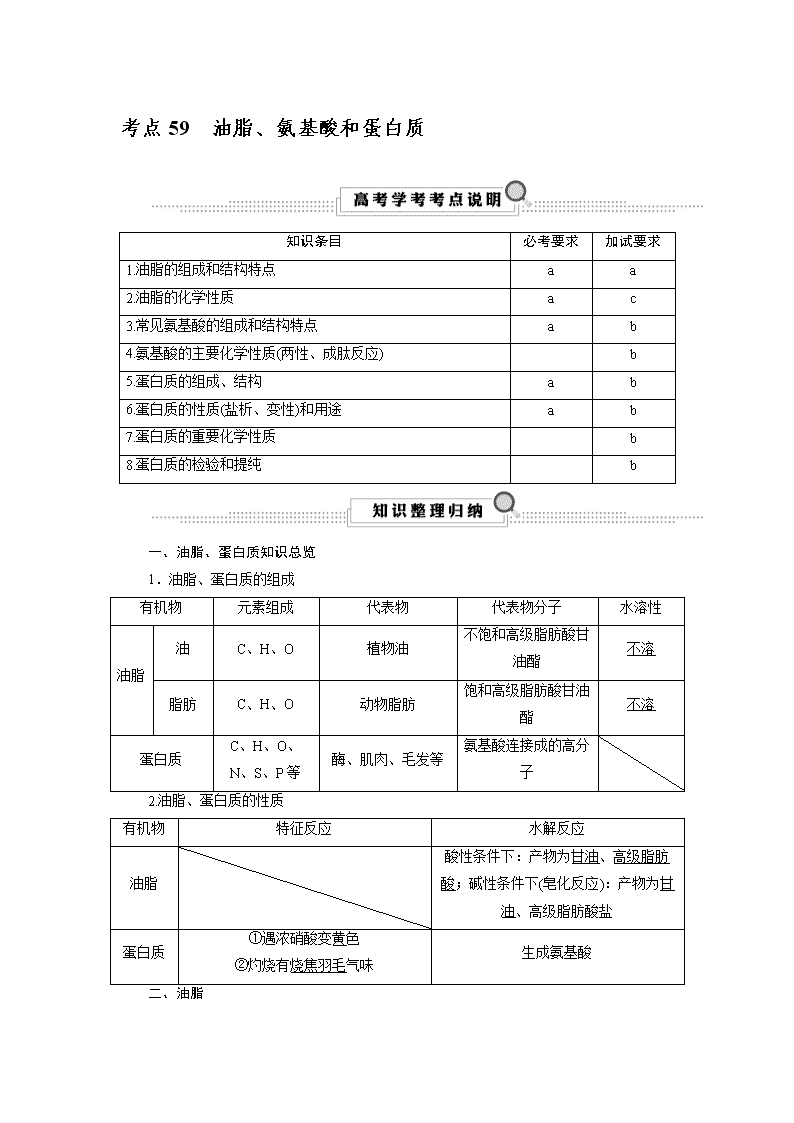
考点59 油脂、氨基酸和蛋白质
知识条目
必考要求
加试要求
1.油脂的组成和结构特点
a
a
2.油脂的化学性质
a
c
3.常见氨基酸的组成和结构特点
a
b
4.氨基酸的主要化学性质(两性、成肽反应)
b
5.蛋白质的组成、结构
a
b
6.蛋白质的性质(盐析、变性)和用途
a
b
7.蛋白质的重要化学性质
b
8.蛋白质的检验和提纯
b
一、油脂、蛋白质知识总览
1.油脂、蛋白质的组成
有机物
元素组成
代表物
代表物分子
水溶性
油脂
油
C、H、O
植物油
不饱和高级脂肪酸甘油酯
不溶
脂肪
C、H、O
动物脂肪
饱和高级脂肪酸甘油酯
不溶
蛋白质
C、H、O、N、S、P等
酶、肌肉、毛发等
氨基酸连接成的高分子
2.油脂、蛋白质的性质
有机物
特征反应
水解反应
油脂
酸性条件下:产物为甘油、高级脂肪酸;碱性条件下(皂化反应):产物为甘油、高级脂肪酸盐
蛋白质
①遇浓硝酸变黄色
②灼烧有烧焦羽毛气味
生成氨基酸
二、油脂
1.组成和结构
油脂是高级脂肪酸与甘油反应所生成的酯,由C、H、O三种元素组成,其结构可表示为
2.性质
(1)油脂的水解(以硬脂酸甘油酯为例)
①酸性条件下
三、氨基酸、蛋白质
1.氨基酸的结构与性质
(1)氨基酸的组成和结构:氨基酸是羧酸分子烃基上的氢原子被氨基取代的化合物。官能团为—COOH和—NH2。
α氨基酸结构简式可表示为
(2)几种重要的α氨基酸
(3)氨基酸的化学性质
与NaOH溶液反应的化学方程式:
②成肽反应
两分子氨基酸脱水形成二肽
多种氨基酸分子间脱水以肽键相互结合,可形成蛋白质。
2.蛋白质的性质
(1)组成
蛋白质由C、H、O、N等元素组成,蛋白质分子是由氨基酸分子连接成的高分子化合物。
(2)性质
四、油脂、蛋白质的用途
1.油脂提供人体所需要的能量,等质量的糖类、油脂、蛋白质完全氧化时,油脂放出的热量最多。油脂用于生产高级脂肪酸和甘油。
2.蛋白质是人体必需的营养物质,在工业上有很多用途,动物的毛、皮、蚕丝可制作服装,酶是一类特殊的蛋白质,是生物体内重要的催化剂。
五、对比明确油脂“三化”
油脂中的“三化”是指氢化、硬化、皂化。氢化是指不饱和油脂与氢气发生加成反应生成饱和油脂的反应;通过氢化反应后,不饱和的液态油转化为常温下为固态的脂肪的过程称为硬化;皂化是指油脂在碱性条件下发生水解生成高级脂肪酸盐与甘油的反应。
六、聚焦盐析、变性异同
盐析:在轻金属盐或铵盐作用下,蛋白质从溶液中凝聚成固体析出,其实质是溶解度降低,是物理变化,此过程可逆,加水后仍可溶解,蛋白质仍保持原有的生理活性。
变性:在重金属盐、受热、紫外线、甲醛、酒精等作用下蛋白质凝聚成固体析出,其实质是结构性质发生变化,是化学变化,此过程不可逆,蛋白质失去原有的生理活性。
二者均是一定条件下,蛋白质凝聚成固体的过程。
【例1】 下列说法正确的是( )
A.用于纺织的棉花和蚕丝的主要成分是纤维素
B.75%的乙醇溶液可用于医疗消毒,福尔马林可用于浸制动物标本,二者所含原理一样
C.食物中的淀粉类物质,通过人体中酶的催化作用转化为酒精
D.向鸡蛋清的溶液中加入浓硫酸铜溶液,可观察到蛋白质发生凝聚,再加入蒸馏水,振荡后蛋白质又发生溶解
【解析】 用于纺织的棉花的主要成分是纤维素,蚕丝的主要成分是蛋白质,A项错误;食物中的淀粉类物质,通过人体中酶的催化作用转化为葡萄糖,葡萄糖再转化为酒精,C项
错误;向鸡蛋清的溶液中加入浓硫酸铜溶液,可观察到蛋白质凝聚,发生变性,再加入蒸馏水,不能再溶解,D项错误。
【答案】 B
【提炼】 在油脂、蛋白质部分,概念类考查是很重要的考查形式,平时复习时,应该关注教材,适当识记一部分知识。
【例2】 在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下:
下列叙述错误的是( )
A.生物柴油由可再生资源制得 B.生物柴油是不同酯组成的混合物
C.动植物油脂是高分子化合物 D.“地沟油”可用于制备生物柴油
【解析】 动植物油脂与短链醇属于可再生资源,A项正确;生物柴油的组成是不同的酯,属于混合物,B项正确;油脂的相对分子质量小于10 000,不是高分子化合物,C项错误;“地沟油”是油脂,可用于制备生物柴油,D项正确。
【答案】 C
【提炼】 油脂属于酯类,但是酯类不一定是油脂,注意油脂不是高分子。
【例3】 下列对氨基酸和蛋白质的描述正确的是( )
A.蛋白质水解的最终产物是氨基酸
B.氨基酸和蛋白质遇重金属离子均会变性
C.α氨基丙酸与α氨基苯丙酸混合物脱水成肽,只生成2种二肽
D.氨基酸溶于过量氢氧化钠溶液中生成的离子,在电场作用下向负极移动
【解析】 蛋白质通过发生水解反应生成氨基酸,所以蛋白质最终水解产物是氨基酸,故A正确;重金属盐能使蛋白质发生变性,但不能使氨基酸发生变性,故B错误;氨基酸生成二肽,是两个氨基酸分子脱去一个水分子,当同种氨基酸脱水,生成2种二肽;当异种氨基酸脱水,可以是α氨基丙酸脱羟基、α氨基苯丙酸脱氢;也可以是α氨基丙酸脱氢、α氨基苯丙酸脱羟基,生成2种二肽,所以共有4种,故C错误;氨基酸中—COOH和NaOH反应生成羧酸根离子,带负电荷,应该向正极移动,故D错误。
【答案】 A
【提炼】 蛋白质水解的最终产物是多种氨基酸的混合物,而氨基酸由于同时有胺基和羧基而显两性。只有蛋白质遇重金属盐才会变性。
【例4】 氨基酸分子之间通过氨基与羧基间的取代反应可生成多肽与水,现有两种氨基酸间的反应:
aCH3—CH(NH2)COOH+bH2N—(CH2)4CH(NH2)COOH―→C30H58O8N10+dH2O,则a∶b等于( )
A.4∶3 B.2∶3 C.3∶2 D.3∶4
【解析】 两氨基酸分子中碳原子数分别是3和6,形成的肽分子中碳原子数是30,题给条件中只有4∶3符合要求,故选A。
【答案】 A
【提炼】 氨基酸分子间可以脱水生成多肽,但是由于氨基酸分子内同时有胺基和羧基,有多种成肽的方式。
【例5】 以淀粉和油脂为原料,制备生活中的某些物质。
已知:反应⑤生成D、E、F的物质的量之比为2∶1∶1,E与等物质的量的H2反应生成D。请回答:
(1)葡萄糖的分子式是________;C分子中官能团的名称是________。
(2)下列说法中正确的是________。
A.淀粉、油脂都是高分子化合物,都能发生水解反应
B.C、D是同系物;M、N也是同系物
C.上述①~⑥中属于取代反应的有③⑤⑥
D.B、E含不同的官能团,但都能使酸性高锰酸钾溶液褪色
(3)写出N的一种结构简式:________;C与F按不同的比例,还可以生成另外两种物质X、Y,且相对分子质量X<N<Y,则Y的分子式为________。
(4)写出反应③(A+D→M)的化学方程式:________________________________________________________________________。
【解析】 淀粉水解生成葡萄糖,葡萄糖的分子式为C6H12O6,葡萄糖在酒化酶的作用下转化成A,则A为CH3CH2OH;乙醇催化氧化得到B,B氧化生成C,则B为CH3CHO、C为CH3COOH;C与F反应生成N,根据N、F的分子式可知F为;油脂甲在酸性条件下水解生成D、
E、F的物质的量之比为2∶1∶1,且E能够与等物质的量的氢气发生加成反应生成D,则D、E中含有的碳原子数相同,根据甲、F的分子式可知D、E中含有的碳原子数为=18,甲的不饱和度为=4,除了含有3个酯基外,还含有1个碳碳双键,则D为硬脂酸(C17H35COOH)、E为油酸(C17H33COOH)。(2)油脂不是高分子化合物,A错;M、N不是同系物,B错;⑤是水解反应,③⑥是酯化反应,均属于取代反应;①②属于氧化反应,④属于加成或还原反应,C正确;B是CH3CHO,官能团是—CHO,E中官能团是碳碳双键和—COOH,两者均能使酸性高锰酸钾溶液褪色,D项正确。(3)依题意,相对分子质量X<N<Y,故Y是3 mol CH3COOH与1 mol CH2(OH)CH(OH)CH2OH发生酯化反应的产物,其分子式为C9H14O6。
【答案】 (1)C6H12O6 羧基 (2)CD
(3)
(4)CH3CH2OH+C17H35COOHC17H35COOCH2CH3+H2O
【提炼】 能水解的有机物小结
类别
条件
水解通式
卤代烃
NaOH的水溶液,加热
酯
在酸溶液或碱溶液中,
加热
二糖
无机酸或酶
多糖
酸或酶
(C6H10O5)n+nH2OnC6H12O6
淀粉(或纤维素) 葡萄糖
油脂
酸、碱或酶
蛋白质
或多肽
酸、碱或酶
相关文档
- 2021届高考化学一轮复习化学实验基2021-07-056页
- 2020届高考化学一轮复习化学平衡状2021-07-0518页
- 2020届高考化学一轮复习化学平衡状2021-07-0530页
- 2020届高考化学一轮复习化学与STSE2021-07-057页
- 2020届高考化学一轮复习化学实验方2021-07-0510页
- 2020届高考化学一轮复习化学与可持2021-07-0513页
- 2020届高考化学一轮复习化学实验基2021-07-059页
- 2020届高考化学一轮复习化学反应与2021-07-058页
- 2021届高考化学一轮复习化学平衡常2021-07-0516页
- 2020届高考化学一轮复习化学计量在2021-07-058页