- 85.50 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
考点13 碳族元素、无机非金属材料
【考纲解析】
1、 掌握碳、一氧化碳、二氧化碳、碳酸、碳酸盐的性质
2、 了解常见的无机非金属材料
【学生整理】
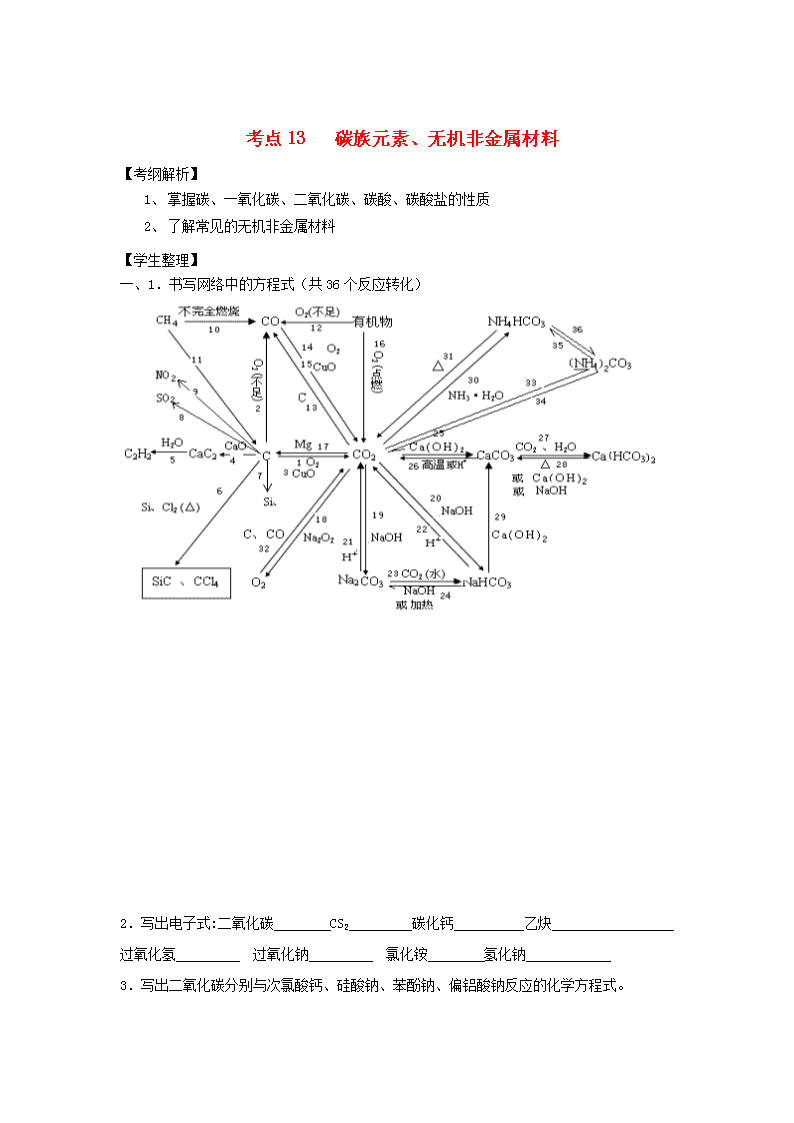
一、1.书写网络中的方程式(共36个反应转化)
2.写出电子式:二氧化碳 CS2 碳化钙 乙炔
过氧化氢 过氧化钠 氯化铵 氢化钠
3.写出二氧化碳分别与次氯酸钙、硅酸钠、苯酚钠、偏铝酸钠反应的化学方程式。
二、硅酸盐工业:水泥、玻璃和陶瓷
水泥是重要的建筑材料,因为水泥有水硬性,所以也是水下工程的必备材料。加入石膏的作用:调节水泥的硬化速度。
玻璃属于玻璃态物质。不同的玻璃有不同的用途。普通玻璃(门窗玻璃)、光学玻璃(光学仪器)、石英玻璃(化学仪器)、钢化玻璃(运动器材)、玻璃纤维(太空飞行员衣服等)。
陶瓷生产的主要原料是粘土。其生产过程经过混合―成型―干燥―烧结―冷却等。陶瓷具有耐腐蚀、耐高温、绝缘、易成型等特性。
水泥和玻璃的比较:
水泥
玻璃
陶瓷
主要原料
、 、石膏
、 、
主要
反应
复杂物理化学变化
Na2CO3+SiO2
CaCO3+SiO2
----------
主要成分
3CaO·2SiO2、2CaO·2SiO2
3CaO·Al2O3
Na2SiO3、CaSiO3、SiO2
硅酸盐
主要设备
水泥回转窑
玻璃熔炉
陶瓷窑
【自主检测】
1.除杂质:
(1)CO中混有CO2,通过盛有 溶液的洗气瓶。
(2)CO2中混有CO,通过装有灼热的 的硬质玻璃管。
(3)CO2中混有SO2、HCl,通过盛有 溶液的洗气瓶。
2、胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8.nH2O)等化合物。
(1)三硅酸镁的氧化物形式为
,某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为 。
(2)铝元素的原子核外共有 种不同运动状态的电子、 种不同能级的电子。
(3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径 (填“大”或“小”),该元素的最高价氧化物的水化物与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:
(4) Al2O3、MgO和SiO2都可以制耐火材料,其原因是 。
a.Al2O3、MgO和SiO2都不溶于水
b.Al2O3、MgO和SiO2都是白色固体
c.Al2O3、MgO和SiO2都是氧化物
d.Al2O3、MgO和SiO2都有很高的熔点
【课堂点拨】
一、CO2气体通入NaOH溶质溶液中,产物的判断(守恒思想)。
例1:将1.5 mol CO2气体通入含2 mol NaOH溶质的溶液中,充分反应后,将溶液小心蒸干,得到固体是什么物质?物质的量是多少?
解析:CO2气体通入NaOH溶液中,可能发生的反应:
CO2+2NaOH= Na2CO3+H2O CO2+NaOH= NaHCO3
NaOH和Na2CO3
Na2CO3和NaHCO3
只有NaHCO3
1/1
1/2
n(CO2):n(NaOH)=1.5:2 所以产物既有Na2CO3,又有NaHCO3。
2x +y=2(Na原子守恒)
x +y= 1.5 (C原子守恒)
x=0.5 mol
y=1 mol
设Na2CO3的物质的量为x mol,NaHCO3为y mol。
答:得到的固体物质为Na2CO30.5. mol,NaHCO3为1 mol。
2、向100g8%的NaOH溶液中通入一定量的CO2,然后将溶液在低温下蒸干,所得固体的可能成分填入下表:
(1)
(2)
(3)
(4)
如果得到的固体质量是13.7g,则标况下通入的CO2的质量为多少?
3、(双选)“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。
下列有关该方法的叙述中正确的是
A.能耗大是该方法的一大缺点
B.整个过程中,只有一种物质可以循环利用
C.“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤
D.该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品
相关文档
- 2021届(鲁科版)高考化学一轮复习化学2021-07-0513页
- 2021届高考化学一轮复习化学实验基2021-07-056页
- 2020届高考化学一轮复习化学平衡状2021-07-0518页
- 2020届高考化学一轮复习化学平衡状2021-07-0530页
- 2020届高考化学一轮复习化学与STSE2021-07-057页
- 2020届高考化学一轮复习化学实验方2021-07-0510页
- 2020届高考化学一轮复习化学与可持2021-07-0513页
- 2020届高考化学一轮复习化学实验基2021-07-059页
- 2020届高考化学一轮复习化学反应与2021-07-058页
- 2021届高考化学一轮复习化学平衡常2021-07-0516页