- 917.00 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
年 级
高三
学 科
化学
版 本
山东科技版
内容标题
高考第一轮复习:饮食中的有机化合物
【本讲教育信息】
一. 教学内容:
高考第一轮复习《化学必修2》
第3章 重要的有机化合物
第3节 饮食中的有机化合物
1、烃的衍生物
2、乙醇的结构和性质及用途
3、乙酸的结构和性质及用途
4、酯的结构特点和性质及用途
5、糖类、油脂、蛋白质
二. 教学目的
1、认识乙醇、乙酸、酯、油脂、糖类、蛋白质等重要有机物的组成、性质和主要应用。
2、了解与人类生命、营养、健康密切相关的知识。
三. 重点和难点
1、乙醇、乙酸、酯的组成、结构、性质和应用。
2、糖类、油脂、蛋白质的组成、性质和应用。
四. 考点分析
本节内容在高考中主要的考查点是:
1、乙醇、乙酸、酯类物质的结构特点、性质和重要用途。
2、糖类、油脂、蛋白质的组成、性质和重要用途。
五. 知识要点
食品中的糖类、蛋白质、油脂、维生素,饮品中的乙醇,调味品中的乙酸、酯类物质等都是有机化合物。它们都可以看成是由烃衍生而来的,都属于烃的衍生物。本节内容是以饮食中的有机化合物为例介绍几种重要的烃的衍生物。重点是介绍它们的性质、结构、官能团之间的衍生关系,以及它们回归人体中的作用。
(一)烃的衍生物
烃的衍生物:烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。
官能团:取代氢原子的其他原子或原子团,使烃的衍生物具有不同于相应烃的特殊性质,这些原子或原子团称为官能团。
(二)乙醇
1. 物理性质
(1)乙醇俗名酒精,是一种无色、透明、有特殊香味的液体,密度比水小,沸点为78.5℃,易溶于多种无机物和有机物,跟水混溶。
(2)常用酒精
①工业酒精
工业酒精含乙醇约96%(体积分数)。
②无水酒精
含乙醇99.5%以上的酒精叫无水酒精,用工业酒精和生石灰混合蒸馏制取无水酒精。
③医用酒精
医疗上常用体积分数为70%~75%的乙醇作消毒剂。
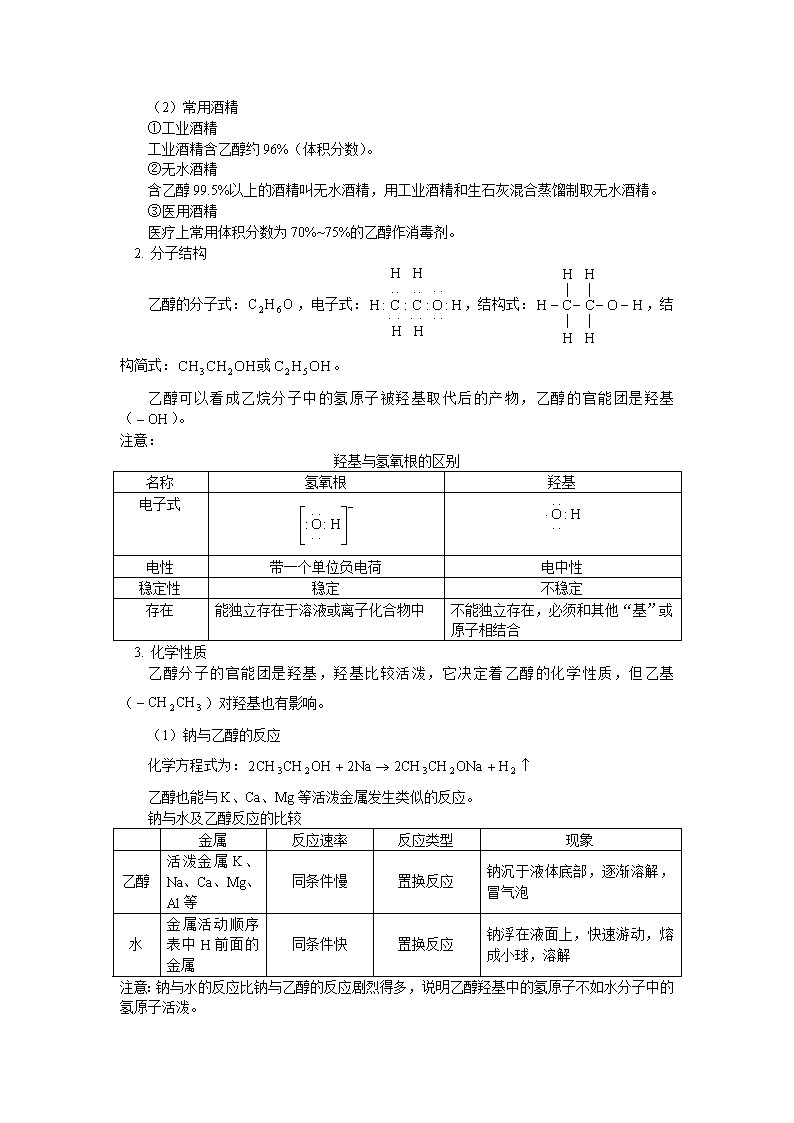
2. 分子结构
乙醇的分子式:,电子式:,结构式:,结构简式:或。
乙醇可以看成乙烷分子中的氢原子被羟基取代后的产物,乙醇的官能团是羟基()。
注意:
羟基与氢氧根的区别
名称
氢氧根
羟基
电子式
电性
带一个单位负电荷
电中性
稳定性
稳定
不稳定
存在
能独立存在于溶液或离子化合物中
不能独立存在,必须和其他“基”或原子相结合
3. 化学性质
乙醇分子的官能团是羟基,羟基比较活泼,它决定着乙醇的化学性质,但乙基()对羟基也有影响。
(1)钠与乙醇的反应
化学方程式为:
乙醇也能与K、Ca、Mg等活泼金属发生类似的反应。
钠与水及乙醇反应的比较
金属
反应速率
反应类型
现象
乙醇
活泼金属K、Na、Ca、Mg、Al等
同条件慢
置换反应
钠沉于液体底部,逐渐溶解,冒气泡
水
金属活动顺序表中H前面的金属
同条件快
置换反应
钠浮在液面上,快速游动,熔成小球,溶解
注意:钠与水的反应比钠与乙醇的反应剧烈得多,说明乙醇羟基中的氢原子不如水分子中的氢原子活泼。
(2)氧化反应
①乙醇的燃烧:化学方程式为:
②催化氧化:乙醇在加热和催化剂(Cu或Ag)存在的条件下,能够被氧化成乙醛。
化学方程式为:
(3)乙醇还可以与酸性高锰酸钾或酸性重铬酸钾溶液反应,被直接氧化为乙酸。
乙醇有相当广泛的用途,除作燃料,制造饮料外,也是一种重要的有机化工原料。例如,用乙醇制造乙酸,乙醇也是一种重要的有机溶剂。
(三)乙酸
1. 物理性质
乙酸俗称醋酸,是食醋的主要成分,普通食醋中含有3%~5%的乙酸。
乙酸是有强烈刺激性气味的无色液体,纯净的乙酸在温度低于16.6℃时凝结成似冰一样的晶体,所以纯净的乙酸又称为冰醋酸,乙酸易溶于水和乙醇。
2. 分子结构
分子式:,结构式:
结构简式:,可以看作是由甲基和羧基结合而成,官能团为。
3. 化学性质
(1)乙酸的酸性
乙酸在水中可以电离:,乙酸是弱酸但酸性比碳酸强。
乙酸具有酸的通性:
①使酸碱指示剂变色。
②与活泼金属反应:
③与碱性氧化物反应
④与碱反应:
⑤与盐反应:
(2)乙酸的酯化反应
①酸和醇起作用,生成酯和水的反应叫酯化反应。
②乙酸和乙醇发生酯化反应的化学方程式为:
注意:酯化反应的原理是乙酸和乙醇分子间脱去一分子水,其余部分相互结合生成酯,据生成的乙酸乙酯的结构可知有如下两种断键方式:
可用示踪原子法确定酯化反应的断键方式:即用含氧的同位素的乙醇与乙酸作用,通过实验检测原子处于哪种产物中,由此确定断键方式属于①或②。
实验检测到生成的乙酸乙酯中含有,而水中没有,由此证明断键方式为①,即酯化反应的实质是酸脱羟基,醇脱羟基氢。
(四)酯
1. 酯
酸和醇起反应生成的一类有机化合物叫做酯。
其结构式可用(,可代表不同的烃基)。
酯的官能团是“”,饱和—元醇和饱和—元羧酸形成的酯,命名为“某酸某酯”。例如:为乙酸乙酯。
2. 酯的物理性质
酯类大多数不溶于水,密度比水小,低级酯具有一定的芳香气味。
3. 酯的化学性质——水解反应
(1)酸性条件下的水解
乙酸乙酯在无机酸存在的条件下,水解生成乙酸和乙醇。酯的水解反应是酯化反应的逆反应,也是取代反应的一种。
(2)碱性条件下的水解——不可逆反应
由于水解生成的乙酸和NaOH发生中和反应,促进了水解反应的进行。所以,碱性条件下的水解趋于完全。
注意:水解反应中乙酸乙酯分子中断裂的是中的键。由于在酯化反应中,乙酸乙酯分子中新形成的化学键也是中的键,也就是说,酯化反应时,形成的是哪个键,则水解时断裂的就是哪个键,这个规律在有机物中是普遍存在的。
(五)糖类
1. 糖的组成、分类及分子组成
(1)组成:糖类是由C、H、O三种元素组成的一类有机化合物,可以用通式表示,所以糖类又称碳水化合物。
注意:①糖类的通式只表明元素的组成,并不反映糖类的结构——糖类分子中并不存在水分子。
②通式的使用有一定限度。有些糖不符合该通式,如鼠李糖();而符合该通式的并不都属于糖类,如甲醛()、乙酸等。
(2)分类: 糖类根据其能否水解,以及水解产物的多少,分为单糖、二糖和多糖。
类别
单糖
二糖
多糖
特点
不能再水解成更小的糖分子
一分子二糖能水解成两分子单糖
一分子多糖能水解成多分子单糖
化学式
常见物质
葡萄糖、果糖
蔗糖、麦芽糖
淀粉、纤维素
(3)结构特点
糖类分子中一般含有长链状结构,包含多个“”,含有“”及“”的结构,是一种多官能团化合物。
2. 糖的性质
(1)葡萄糖和果糖
①分子式和结构式:分子式同为。
葡萄糖的结构式:
可简写为:
官能团是和。
果糖的结构式:
可简写为:
官能团是和。
②葡萄糖和果糖是同分异构体。
(2)葡萄糖的性质
①物理性质:葡萄糖是一种白色晶体,有甜味,能溶于水。
②化学性质:由于葡萄糖分子中既有醇羟基,又有醛基,故葡萄糖既具有醇的性质又具有醛的性质。
a. 在新制的反应
在新制的中加入葡萄糖溶液并加热至沸腾,可以看到蓝色的沉淀变成红色。
该反应常用于医疗上检验糖尿病患者尿中葡萄糖的含量。
b. 银镜反应
葡萄糖在碱性、加热条件下,能从银氨溶液中析出银
c. 葡萄糖发酵成乙醇
d. 葡萄糖的氧化反应——燃烧或缓慢氧化
葡萄糖
(3)蔗糖和麦芽糖
分子式都是,但分子结构不同,它们的水解产物也不同,是同分异构体。
(4)淀粉和纤维素
①分子组成
淀粉和纤维素的分子式通式为:。
②水解反应:
③淀粉的特征反应:淀粉遇碘变为蓝色。可用于验证淀粉的存在。
(5)糖类物质的重要应用
分子式(或通式)
颜色状态
存在
重要用途
单糖
葡萄糖
C6H12O6
白色晶体
葡萄及其他甜味水果中
食品加工、制药制镜等
果糖
C6H12O6
无色晶体
水果及蔬菜中
食品加工
双糖
蔗糖
C12H22O11
无色晶体
甘蔗、甜菜等
甜味食物
麦芽糖
C12H22O11
白色晶体
淀粉水解产物中
甜味食物
多糖
淀粉
(C6H10O5)n
白色粉末
植物的种子、块茎及根块谷物中含量高
食物的重要成分:制葡萄糖、酒精等
纤维素
(C6H10O5)n
白色纤维状物质
存在于一切植物、木材中,约一半是纤维素,棉花含纤维素92%~95%
造纸,制黏胶纤维、纤维素硝酸酯、纤维素乙酸酯
思考与联想:生活中食用的各种陈醋(醋酸)品种繁多,但都是以含淀粉的物质为原料制备的,请用化学方程式表示其主要反应过程。
提示:①
②
③
(五)油脂和蛋白质
1. 油脂
(1)油脂
油脂是一类特殊的酯,可以看作是高级脂肪酸(如硬脂酸;软脂酸等)与甘油(丙三醇:)经酯化反应生成的。
(2)油脂的组成、分类、存在
组成
物质分类
油脂分类及性质
存在
重要用途
油脂
R1、R2、R3是烃基,可相同可不同
属酯类(高级脂肪酸甘油酯)
油
含碳碳双键,能使溴水、酸性KMnO4溶液褪色
植物种子、果实
食物
脂肪
几乎不含碳碳双键
动物的组织和器官
食物、制肥皂等
(3)皂化反应
当用碱作催化剂时,生成的高级脂肪酸和碱作用生成高级脂肪酸盐(一般是钠盐),高级脂肪酸钠是肥皂的主要成分,所以油脂在碱性条件下的水解反应称皂化反应。
化学方程式:
2. 蛋白质
(1)蛋白质的存在和组成
①天然蛋白质广泛存在于生物体内,是组成细胞的基础物质,动物的皮、毛、发、指(趾)甲,鸟类的羽毛,鸡蛋清,血液等均含大量的蛋白质。
②蛋白质的组成元素为C、H、O、N、S等。
(2)蛋白质的性质
①水解反应:天然蛋白质在酸、碱或酶的作用下,最终水解成氨基酸。
以下为常见的几种氨基酸:
名称
结构简式
甘氨酸
丙氨酸
谷氨酸
②蛋白质的特征反应
a. 颜色反应
某些蛋白质跟浓HNO 3作用会显黄色,可用于鉴别蛋白质。
b. 灼烧
蛋白质在灼烧时有烧焦羽毛的气味,用于区别合成纤维与蛋白质(如真丝、纯毛毛线等)。
③盐析
在蛋白质溶液中加入浓溶液或浓溶液,蛋白质会因溶解度下降而析出,这一现象称为盐析。
注意:
①盐析时加入的盐必须为轻金属盐(性质似)
②盐析没有改变蛋白质的化学性质,只改变蛋白质的溶解度,析出的蛋白质还可溶解在水中,因而盐析是一可逆的物理变化过程。可用多次盐析的方法来分离、提纯蛋白质。
③少量的盐能促进蛋白质的溶解。
④变性
加热、紫外线、X射线、强酸、强碱、重金属盐(如铅、铜、汞盐等)、一些有机物(如甲醛、乙醇、苯甲酸等)等都能使蛋白质变性(产生凝结现象)。变性是不可逆的,利用此性质可以进行消毒,同时又会引起中毒。
(3)蛋白质的用途
①动物的毛和蚕丝是重要的天然纺织原料。
②动物的皮制皮革、胶黏剂、中药材等。
(4)酶
酶是一类具有催化作用的蛋白质。
酶的特点:
①具有高度的专一性。如蛋白酶只能催化蛋白质的水解反应,淀粉酶只对淀粉起催化作用。
②具有高效催化作用。酶催化的化学反应速率比普通催化剂高107~1013倍。
③条件温和、不需加热。在接近体温和接近中性的条件下,酶就可以起催化作用。在30℃~50℃之间酶的活性最强,超过适宜的温度时,酶将逐渐失去活性。
【典型例题】
例1. 把一端弯成螺旋状的铜丝放在酒精灯火焰上加热,看到铜丝表面生成黑色的______________,再迅速把铜丝插入盛有乙醇的试管里,看到铜丝表面_______________,反复多次,试管内有_________________气味的___________________生成。其反应的化学方程式为__________________;反应中乙醇被___________________(填“氧化”“还原”)。
分析:根据Cu与O2反应及CuO与乙醇的反应可得出答案。
答案:CuO 变红 刺激性 乙醛
氧化
例2. 当乙酸分子中的O都是,乙醇分子中的O都是,二者在一定条件下反应,生成物中水的相对分子质量为( )
A. 16 B. 18 C. 20 D. 22
分析:乙酸与乙醇反应方程式为:
,生成的水为,故水的相对分子质量为20。
答案:C
例3. A是一种酯,分子式是,A可以由醇B跟羧酸C发生酯化反应得到。A不能使溴的溶液褪色,氧化B可得到C。
(1)写出A、B、C的结构简式:A___________,B___________,C___________。
(2)写出B的三种同分异构体的结构简式,(它们都可以跟NaOH反应):__________、___________和___________。
分析:此题所给已知条件很少,所以充分领会题意,使用好有限条件。由酯分子可知为不饱和酯,又不能使溴褪色可知为芳香酯。芳香醇、芳香酸、芳香酯在有机合成、推断试题中的应用是十分广泛的。
答案:(1)
(2)
例4. 下列物质中,在一定条件下既能发生银镜反应,又能发生水解反应的是( )
A. 甲酸甲酯 B. 蔗糖 C. 葡萄糖 D. 麦芽糖
分析:能发生银镜反应,则有机物中应含还原性基团:醛基。目前学习的有机物发生水解反应的有卤代烃、酯、二糖等。符合上述两种情况的物质有:甲酸甲酯、麦芽糖。
答案:A、D
例5. 下列有关蛋白质的叙述中,不正确的是( )
A. 蛋白质溶液加入饱和溶液,蛋白质析出,再加入水不溶解
B. 人工合成的具有生命活力的蛋白质——结晶牛胰岛素,是1965年我国科学家在世界上第一次合成的
C. 重金属盐能使蛋白质变性,所以误食重金属盐会中毒
D. 浓HNO3溅在皮肤上,使皮肤呈黄色,是由于浓HNO3和蛋白质发生颜色反应
分析:能使蛋白质发生盐析,不发生变性,重金属盐可使蛋白质变性,使人中毒。
答案:A
相关文档
- 2020届高考化学一轮复习化学反应与2021-07-056页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-0513页
- 2021届高考化学一轮复习化学实验基2021-07-056页
- 2020届高考化学一轮复习化学平衡状2021-07-0518页
- 2020届高考化学一轮复习化学平衡状2021-07-0530页
- 2020届高考化学一轮复习化学与STSE2021-07-057页
- 2020届高考化学一轮复习化学实验方2021-07-0510页
- 2020届高考化学一轮复习化学与可持2021-07-0513页
- 2020届高考化学一轮复习化学实验基2021-07-059页
- 2020届高考化学一轮复习化学反应与2021-07-058页