- 500.37 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
本溪县高中高二下学期期未考试试题
化 学
考生注意:
1. 本试卷分选择题和非选择题两部分。 满分 100 分,考试时间 90 分钟。
2. 答题前,考生务必用直径 0. 5 毫米黑色墨水签字笔将密封线内项目填写清楚。
3. 考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径 0. 5 毫米黑色墨 水签字笔在答题卡上各题的答题区域内作答 ,超出答题区域书写的答案无效 ,在试题卷、草稿纸上作
答无效。
4. 本卷命题范围:高考范围。
5. 可能用到的相对原子质量: H 1 C 12 N 14 O 16 Al 27 S32 Mn 55 Fe 56 Cu 64 Ba 137
一、选择题(本 题共 20 小题,第1~10 题,每小 题 2 分,第 11 ~20 题,每小题 3 分,共50 分。在每小题列出的四个选项中,只有一项是最符合题目要求的)
1.化学与生活密切相关。下列叙述错误的是
A. 干冰可用于人工降雨 B. 硅单质可用于制造计算机芯片
C. 氯水可用于杀菌消毒 D. 纯碱可用作口服制酸剂
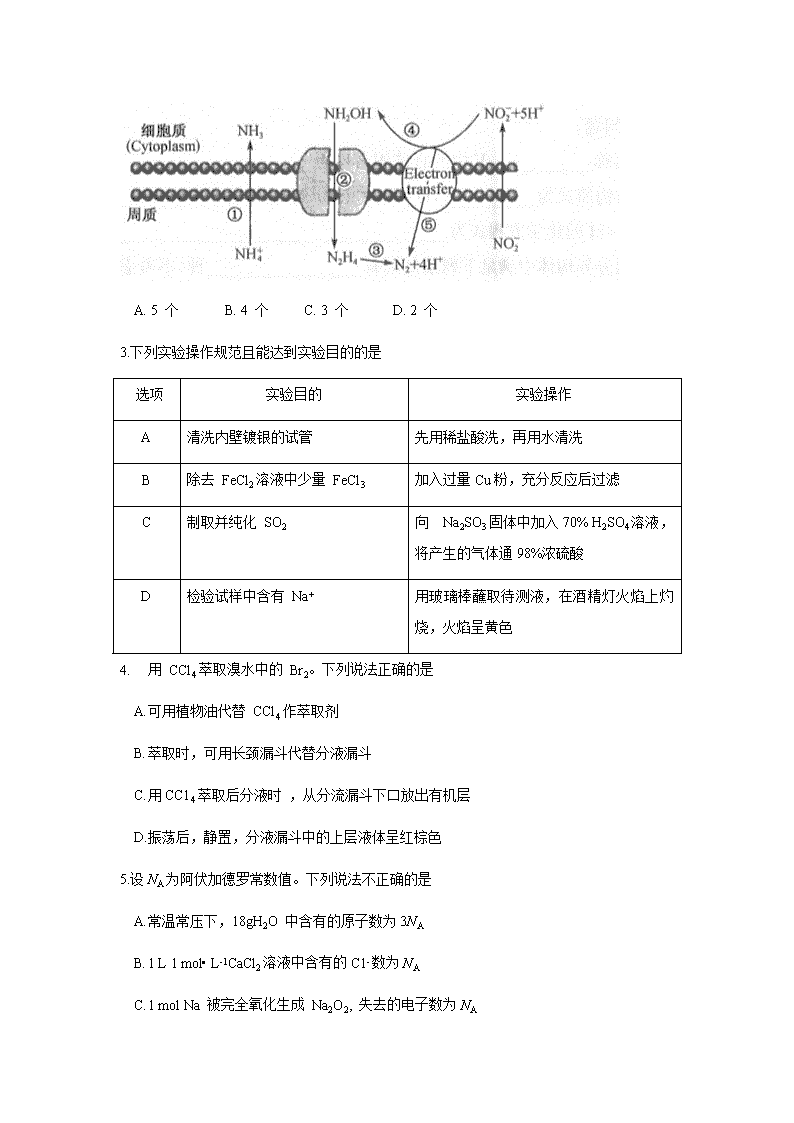
2.海水中的氮循环如图所示,其中反应①~⑤中属于氧化还原反应的有
A. 5 个 B. 4 个 C. 3 个 D. 2 个
3.下列实验操作规范且能达到实验目的的是
选项
实验目的
实验操作
A
清洗内壁镀银的试管
先用稀盐酸洗,再用水清洗
B
除去 FeCl2溶液中少量 FeCl3
加入过量Cu粉,充分反应后过滤
C
制取并纯化 SO2
向 Na2SO3固体中加入70% H2SO4溶液,将产生的气体通98%浓硫酸
D
检验试样中含有 Na+
用玻璃棒蘸取待测液,在酒精灯火焰上灼烧,火焰呈黄色
4. 用 CCl4萃取溴水中的 Br2。下列说法正确的是
A. 可用植物油代替 CCl4作萃取剂
B. 萃取时,可用长颈漏斗代替分液漏斗
C. 用CC14萃取后分液时 ,从分流漏斗下口放出有机层
D. 振荡后,静置,分液漏斗中的上层液体呈红棕色
5.设NA为阿伏加德罗常数值。下列说法不正确的是
A. 常温常压下,18gH2O 中含有的原子数为3NA
B. 1 L 1 mol• L-1CaCl2溶液中含有的C1- 数为NA
C. 1 mol Na 被完全氧化生成 Na2O 2, 失去的电子数为NA
D. 2. 7 g Al 与足量 NaOH 溶液反应,生成 H2的分子数为 0. 15NA
6.下列各组物质的转化关系中不能全部通过一步反应完成的是
A. Na NaOH Na2CO3 NaCl
B. Mg MgCl2 Mg( OH)2 MgSO4
C. Al Al2O3Al(OH)3 NaA1O2
D. Fe FeCl2Fe ( OH )2 Fe(OH)3
7.下列操作或叙述正确的是
A. 配制 NaOH 溶液时,将称量后的NaOH 加入容量瓶中,再加水溶解 、定容
B. 将吸有 NaOH 溶液的长胶头滴管伸入硫酸亚铁溶液中挤出溶液,可制得Fe(OH )2
C. 向某溶液中加入 BaCl2溶液产生白色沉淀,说明原溶液中一定含有SO42-
D. 向沸水中逐滴滴加 FeCl3的稀溶液并用玻璃棒搅拌,可制得 Fe(OH)3胶体
8.纳米二硫化钼 (MoS2难溶于水)是氢化反应和异构化反应的催化剂,将纳米二硫化钼与水 混合制得的分散系不具有的性质是
A. 分散质的直径为 l nm~100 nm
B. 激光笔照射时,有一条光亮的通路
C. 使用半透膜过滤时,分散质能透过半透膜
D. 澄清透明 、较均匀 、较稳定的混合物
9.下列离子的检验方法合理的是
A. 向某溶液中滴入KSCN 溶液呈红色,说明溶液中一定不含 Fe2+
B. 向某溶液中加入NaOH 溶液,有红褐色沉淀生成,说明溶液中一定含有 Fe3+
C. 向某溶液中通入Cl2 , 然后再加入KSCN溶液变红色,说明原溶液中一定含有 Fe2+
D. 向某溶液中加入NaOH 溶液得白色沉淀,迅速变为灰绿色,最终变为红褐色,说明该溶液中只含有 Fe2+, 不含有 Mg2+
10. 若x g C3H6中含有的氢原子数为 y , 则 w g CO中的分子数为
A. B. C. D.
11. 我国科学家合成了一种全新的环[ 18] 碳分子(C18 , 如图),下列说法正确的是
A.C18属于一种新型化合物
B.C18与C60 的摩尔质量相等
C.等质量的C18与C60所含的原子个数比为 1 : 1
D.等质量的C18与C60所含的分子个数比为 1:1
12. 将 5. 6 g 铁粉加到 50 mL 2 mol• L-1 FeCl3溶液中 ,完全反应后(假设溶液的体积不 变 ),下列结论不正确的是
A. 溶液中 n ( Fe2+)为0. 3 mol
B向溶液中滴加无色 KSCN 溶液,不变色
C 铁有剩余,溶液呈浅绿色 ,c( Cl-) 基本不变
D氧化产物与还原产物的物质的量之比为 1:2
13. 某实验小组设计的测定 Na2SO4 和 Na2CO3混合物中各组分含量的实验如下:
下列判断不正确的是
A. 沉淀a 的主要成分为 BaSO4 和BaCO3
B. 滤液 b 中 Na+ 的物质的量为 0. 08 mol
C .气体d在标准状况下的体积为 224 mL
D.原混合物中Na2SO4 和 Na2CO3 的物质的量之比为 1: 3
14. 下列反应的离子方程式书写正确的是
A. 小苏打溶液中加入醋酸: H CO3- + H+ =CO2 +H2O↑
B铁锈溶于稀硫酸:Fe2O3+6 H+= 2Fe3++ 3 H2O
C. 铝溶于氢氧化钠溶液: Al+ OH- + H2O = AlO2-+ H2 ↑
D. 0. 1 mol• L-1的 NaAlO2 溶液和 0. 15 mol• L-1 的H2SO4溶液等体积混合:
AlO2- + 4H+ =A l3+ +2 H2O
15. 工业上提取碲(Te) 的反应之一为 3Te+ l 6 H NO3=3Te( NO3)4 + 4NO ↑ 十8 H2O, 下列说法不正确的是
A. Te( NO3)4是氧化产物,NO 是还原产物
B. 氧化剂与还原剂的物质的量之比为 16 : 3
C. 氧化性由强到弱的顺序为 HNO3>Te( NO3)4
D. 生成标准状况下 11. 2 LNO, 转移的电子数为 1. 5NA
16. 一 定条件下,密闭容器内 SO2 氧化成SO3的热化学方程式为2SO2 (g ) + O2( g) 2SO3(g) ΔH = —a kJ• mol -1,该温度下反应的平衡常数为 K。反应达到平衡后,保持温度不变 ,再通入一定量O2 ,下列说法正确的是(不考虑物质状态变化 )
A. a 增大,K 不变 B. a 不变,K 增大
C. a 增大,K 增大 D. a 不变,K 不变
17. 巳知下列热化学方程式:
Fe2O3(s ) +3CO(g ) =2Fe( s) + 3CO2( g ) ΔH =-24. 8 kJ• mol-1
3Fe2O3 (s) + CO ( g) =2Fe3O4( s ) + CO2( g ) ΔH = -47. 2 kJ•mol-1
Fe3O4(s) + CO( g)= 3FeO ( s ) + CO2 ( g ) ΔH =+ 640. 5 kJ•mol-1
则1 4gCO气体 与足量FeO充分反应得到Fe 单质和CO2气体时的热量变化为
A. 放出 218 kJ B. 放出 109 kJ
C. 吸收 218 kJ D. 吸收 109 kJ
18. 常温下,在下列给定条件的溶液中,一定能大量共存的离子组是
A. 能使 pH 试纸呈红色的溶液:Na+ 、NH4+ 、I-、NO3-
B. c( Fe3+ ) =0. 1 mol• L-1的溶液:H+ 、Al+3、I- 、SCN
C. 加入铝粉生成H2的溶液: K+、Mg2+ 、SO42- 、HCO3-
D.=0. 1 mol• L-1的溶液:Na+、K+、SiO32-、NO3-
19. 下列说法正确的是
A. 将 AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是 AlCl3
B. 加热 Fe2( SO4)3溶液 ,Fe3+的水解程度和溶液的 pH 均增大
C. 锅炉中沉积的 CaSO4可用饱和碳酸钠溶液浸泡 ,再用盐酸溶解而除去
D. 在合成氨工业中,将 NH3液化并及时分离可增大正反应速率 ,提高原料转化率
20. “水煤气( CO、H2)—空气”燃料电池的工作原理如图所示,其中 a 、b 均 为惰性电极。下列叙述正确的是
A. 甲处通入的是空气,乙处通入的是水煤气
B. a 电极发生还原反应,b 电极发生氧化反应
C. a 电极的反应式包括 :CO +4OH-+ 2 e- =CO32-+2H2O
D. 用该电池电镀铜,若待镀金属增重 6. 4 g, 则至少消耗标准状况下的水煤气 2. 24 L
二、非选择题(本题共 4 小题,共50 分)
21. (10 分)铁铵矾常用作测定卤素的指示剂,化学式为 ( NH4)aFeb ( SO4) c •dH2O, 为测定其组成,某化学兴趣小组进行了以下实验:
I . 称取 144. 6 g 样品,灼烧至恒重时(假如只失去结晶水 ,不发生其他反应),得蒸馏水 的质量为 64. 8 g。
II. 将上述剩余固体完全溶于水,并将所得溶液分成三等份:
①往其中一份中加入足量的NaOH 浓溶液并加热,最终得到标准状况下 2. 24 L 气体。
②往第二份中加入稀硫酸,然后向此混合溶液中逐滴加入 0.1 mol•L-1NaOH 溶液,滴加 过程中产生红褐色沉淀的质量与加入 NaO H 溶液的体积的关系如图所示:
③往第三份中加入足量的 0. 1 mol•L-1BaCl2 溶液 ,生成不溶于稀硝酸的白色沉淀 46. 6 g。
回答下列问题:
( 1 ) 操作①生成气体的离子方程式为 。
( 2) 操作②中 OX 段反应的离子方程式为 ; XY 段反应的离子方程式为 。
( 3) 操作③中生成的沉淀为 ,其物质的量为 。
( 4) 铁铵矾的化学式为 。
22. ( 10 分)四氧化三锰既是磁性材料锰锌铁氧体( ZnaMnbFecO4 , Fe 元素为+3 价 ,Zn、Mn 元素化合价相同)的重要生产原料,也常被用作氮氧化物分解的催化剂。近年来对制备高品质四氧化三锰的研究越来越受到重视。以硫酸锰为原料制备四氧化三锰的工艺流程如下:
回答下列问题:
( 1 ) “溶解”时需用玻璃棒,其作用为 。
( 2 ) “碱化”时反应离子方程式为 。
( 3 ) 滤液X 中含有的溶质为 (填化学式)。
( 4 ) 简述“碱化”得到的沉淀是否洗涤干净的方法 :
。
( 5 ) “ 氧化”时发生的化学反应方程式为 。
( 6) 取 30. 2 g MnSO4经上述工艺过程后,生成 g Mn3O4(假设 Mn 元素不损失)。
23. (15 分)亚微米级 Cu0/ Fe3O4 复合物多相催化过 一 硫酸盐降解有机污染物的过程如 图所示 :
回答下列问题:
(1) 基态铜原子的价层电子排布式为 ,其位于元素周期表的 区。
(2) O 、S、H 的电负性由大到小的顺序为 。
(3) SO42-的中心原子的价层电子对数为 ,其空间构型为 。
(4) 冰的晶体结构如图 1 所示,则1mol 冰中含有 mol 氢键。
( 5 ) Cu0/ Fe3O4 复合物也是有机反应中的催化剂,如:
+ NH3+H2O2 +2H2O
①l mol中含有σ建的数目为 NA(NA为阿伏加德罗常数的值)。
② NH3 的键角 (填“大于”“小于”或“等于” ) NF3的键角;理由是 。
( 6) 铜的晶胞结构如图 2, 则铜的配位数为 ,若铜原子的半径为a pm, 则铜晶胞的密度为 g• cm-3(列出计算式)。
24. (15 分)吗氯贝胺(H) 临床上为单胺氧化酶抑制剂类药物,由芳香烃 A 合成 H 的路线如图所示:
回答下列问题:
( l ) A 的名称 , E 中的官能团名称为 。
(2) C的结构简式为 ,D→F 的反应反应类型为 。
(3) ) F + G→ H的化学方程式为 。
( 4) C 的同分异构体中满足下列条件的有 种(不考虑立体异构)。
①属于芳香族化合物 ②能发生银镜反应
其中核磁共振氢谱有 3 组峰且峰面积比为 2 :2 : 1 的结构简式为 。
(5)参照上述合成路线,写出以 和 CH3NH2为原料合成
的路线: (无机试剂任选)。
本溪县高中高二下学期期末考试试题•化学
参考答案、提示及评分细则
1. D 2. B 3.C 4.C 5. B 6. C 7.B 8.C 9 . B l 0. B 11. C 12. A 13.C 14.B 15.B 16.D l7. B 18. D 19. C 20. D
21.
(l ) NH4++OH- NH3 ↑ +H2O (1分)
(2) H+ + OH- = H2O; Fe3++3 OH-=Fe(OH)3↓(各 2 分)
(3)BaSO4 (2 分); 0.2mol (1分)
(4)NH4Fe(SO4)2·12H2O( 2 分)
22.
(1 ) 搅拌,加快MnSO4溶解速率 (1 分)
( 2) Mn2+ + 2NH3 • H2O=Mn(OH )2↓+ 2NH4+ (2 分)
(3) ( NH4)2SO4 (1分)
(4) 取最后一次洗涤液少许于试管中,滴加几滴盐酸酸化的 BaCl2溶液,若无白色沉淀生成说 明沉淀洗涤干净( 2 分)
(5) 3Mn(OH )2 + H2O2 =Mn3O4 + 4H2O ( 2 分)
(6)15. 3( 2 分)
23.
(1) 3d104s1; ds (各 1 分)
(2)O > S> H (1分)
(3) 4; 正四面体(各1 分)
(4) 2 ( 2 分)
(5) ①19( 2 分)
②大于(1 分);NH3中成键电子偏向 N, 斥力大,键角大. NF3中成键电子偏向F, 斥力小,键角小(2 分)
(6) 12(1 分); ( 2 分)
24.
(1) 甲苯(1分);溴原 子 、氨基( 2 分)
(2) ( 2 分),取代反应(1 分)
(3)+ +HBr(2分)
(4)3;(各 2 分)
(5)
(3 分 )
相关文档
- 2017-2018学年江西省南昌市第十中2021-07-059页
- 2018-2019学年重庆市大足区高二下2021-07-058页
- 【化学】江西省南昌市八一中学20192021-07-0510页
- 2018-2019学年黑龙江省哈尔滨市第2021-07-0523页
- 【化学】福建省南平市2019-2020学2021-07-0512页
- 【化学】内蒙古自治区赤峰市2019-22021-07-0519页
- 河北省石家庄市元氏县2019-2020学2021-07-0512页
- 【化学】吉林省长春市第二实验中学2021-07-0510页
- 2018-2019学年云南省保山市第一中2021-07-0521页
- 【化学】安徽省滁州市民办高中20192021-07-059页