- 128.00 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第三课时 酸碱中和滴定
课后提能 层级练
1.下列叙述,仪器“0”刻度位置正确的是( )
A.在量筒的上端
B.在滴定管的上端
C.在托盘天平标尺的正中
D.在托盘天平标尺的右端
解析:选B 量筒无“0”刻度,托盘天平的“0”刻度在左端,滴定管的“0”刻度在上端。
2.准确量取25.00 mL高锰酸钾溶液,可选用的仪器是( )
A.500 mL量筒 B.10 mL量筒
C.50 mL酸式滴定管 D.50 mL碱式滴定管
解析:选C 准确量取25.00 mL溶液,应用50 mL滴定管。又因为碱式滴定管的下端有一段橡皮管可被高锰酸钾溶液氧化,故量取高锰酸钾溶液时要用酸式滴定管。
3.用0.102 6 mol·L-1的盐酸滴定25.00 mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为( )
A.22.30 mL B.22.35 mL
C.23.65 mL D.23.70 mL
解析:选B 滴定管是一种精确度较高的仪器,每一小格为0.10 mL,零刻度在上,刻度自上而下逐渐增大。读数时视线要与凹液面的最低点相切,故读数为22.35 mL。
4.下列有关滴定操作的顺序正确的是( )
①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤
A.⑤①②③④ B.③⑤①②④
C.⑤②③①④ D.②①③⑤④
解析:选B 中和滴定的顺序一般为:查漏、洗涤、润洗、注液、滴定。
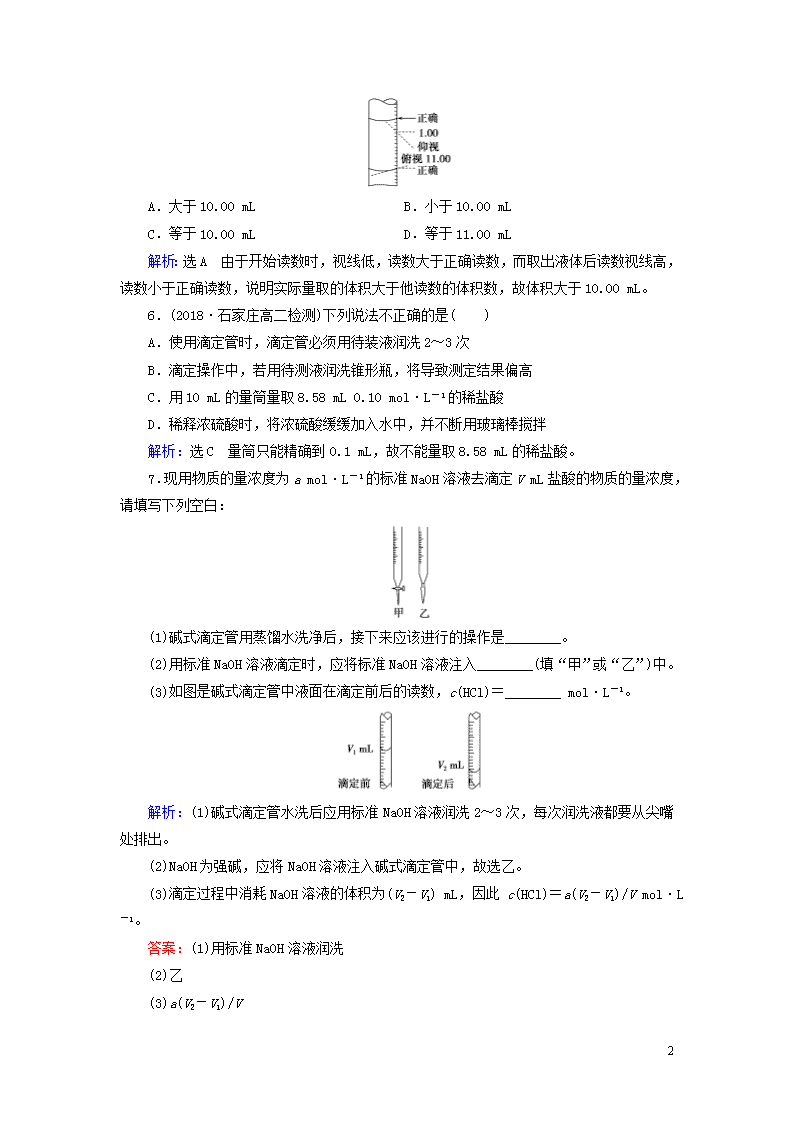
5.某学生用碱式滴定管量取0.1 mol·L-1的NaOH溶液,开始时仰视液面,读数为1.00 mL。取出部分溶液后,俯视液面,读数为11.00 mL,该同学在操作中实际取出的液体为( )
7
A.大于10.00 mL B.小于10.00 mL
C.等于10.00 mL D.等于11.00 mL
解析:选A 由于开始读数时,视线低,读数大于正确读数,而取出液体后读数视线高,读数小于正确读数,说明实际量取的体积大于他读数的体积数,故体积大于10.00 mL。
6.(2018·石家庄高二检测)下列说法不正确的是( )
A.使用滴定管时,滴定管必须用待装液润洗2~3次
B.滴定操作中,若用待测液润洗锥形瓶,将导致测定结果偏高
C.用10 mL的量筒量取8.58 mL 0.10 mol·L-1的稀盐酸
D.稀释浓硫酸时,将浓硫酸缓缓加入水中,并不断用玻璃棒搅拌
解析:选C 量筒只能精确到0.1 mL,故不能量取8.58 mL的稀盐酸。
7.现用物质的量浓度为a mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是________。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入________(填“甲”或“乙”)中。
(3)如图是碱式滴定管中液面在滴定前后的读数,c(HCl)=________ mol·L-1。
解析:(1)碱式滴定管水洗后应用标准NaOH溶液润洗2~3次,每次润洗液都要从尖嘴处排出。
(2)NaOH为强碱,应将NaOH溶液注入碱式滴定管中,故选乙。
(3)滴定过程中消耗NaOH溶液的体积为(V2-V1) mL,因此 c(HCl)=a(V2-V1)/V mol·L-1。
答案:(1)用标准NaOH溶液润洗
(2)乙
(3)a(V2-V1)/V
7
8.(2019·东北师大附中高二检测)某学生用物质的量浓度为a mol/L的标准NaOH溶液去测定V mL HCl溶液的物质的量浓度,回答下列问题:
(1)实验前应先检查滴定管________,实验过程中眼睛注视锥形瓶内溶液颜色变化,直至滴定终点。
(2)若在滴定前碱式滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的盐酸的物质的量浓度会________(填“偏大”“偏小”或“不变”,下同)。
(3)实验前先用待测液润洗锥形瓶,则测定结果会________。
解析:(1)使用滴定管之前要先检查是否漏水。
(2)若碱式滴定管尖嘴部分有气泡,滴定后气泡消失,则会使V(NaOH)偏大,计算出c(HCl)偏大。
(3)锥形瓶不能润洗,否则会使消耗NaOH的量偏多,从而计算出c(HCl)偏大。
答案:(1)是否漏水(2)偏大(3)偏大
1.下列有关化学实验的叙述正确的是( )
A.用待测液润洗滴定用的锥形瓶
B.一定不能用标准液润洗滴定用的滴定管
C.用稀盐酸洗涤盛放过石灰水的试剂瓶
D.NaOH溶液保存在带玻璃塞的试剂瓶中
解析:选C 用待测液润洗锥形瓶相当于增加待测液,会引起滴定误差,A错;未用标准液润洗滴定管,则标准液被稀释,会引起滴定误差,B错;NaOH溶液呈碱性,易使瓶塞和瓶口粘在一起,D错,应选C。
2.下列与滴定实验有关的说法中正确的是( )
A.用NaOH滴定盐酸时,只能用酚酞作指示剂
B.用KMnO4滴定亚硫酸钠溶液的实验中不需要另外加入指示剂
C.用滴定管准确量取20.0 mL盐酸
D.用NaOH滴定盐酸时,若滴定结束时俯视刻度,会导致测定结果偏高
解析:选B 氢氧化钠滴定盐酸时,还可以借助甲基橙,pH计等确定滴定终点,A错误;高锰酸钾溶液本身有颜色且消耗完后为无色,B正确;使用滴定管量取溶液时,数字记录应精确到0.01 mL,C错误;俯视刻度会导致读数偏小,结果偏低,D错误。
3.用滴定法测定Na2CO3(含NaCl杂质)的质量分数,下列操作会引起测定值偏高的是( )
A.试样中加入酚酞作指示剂,用标准酸液进行滴定
B.滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定
C.锥形瓶用蒸馏水洗涤后,直接加入待测溶液进行滴定
7
D.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00 mL进行滴定
解析:选B 试样中加入酚酞作指示剂,用标准酸液进行滴定,对V(标)无影响,根据c(待)=可知c(待)不变,故A错误;滴定管用蒸馏水洗涤后,直接注入标准酸液进行滴定,标准液浓度降低,造成V(标)偏大,根据c(待)=可知c(待)偏大,故B正确;锥形瓶用蒸馏水洗涤后,直接加入待测溶液进行滴定,待测液的物质的量不变,对V(标)无影响,根据c(待)=可知c(待)不变,故C错误;滴定管用蒸馏水洗涤后,直接注入待测液,取20.00 mL进行滴定,待测液浓度降低,待测液的物质的量减小,造成V(标)偏小,根据c(待)=可知c(待)减小,故D错误。故选B。
4.(双选)用标准的KOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是( )
A.配制标准溶液的固体KOH中混有NaOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
解析:选AB A项将会使标准碱液的c(OH-)偏大,滴定时耗用的V(OH-)偏小,导致结果偏低,A项正确;终点时俯视读数,将使读取碱液的体积偏小,测定结果偏低,B项正确;用未知液润洗锥形瓶将使测定结果偏高,C项错;尖嘴处悬挂溶液将使读取的标准液体积偏大,测定结果偏高,D项错。
5.用1.0 mol·L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积V关系如图所示。原硫酸溶液的物质的量浓度和反应后溶液的总体积是( )
A.1 mol·L-1 60 mL B.0.5 mol·L-1 80 mL
C.0.5 mol·L-1 60 mL D.1 mol·L-1 80 mL
解析:选B 由图可知起始pH=0,c(H+)=1 mol·L-1,c(H2SO4)=0.5 mol·L-1,完全中和消耗NaOH溶液40 mL;
2NaOH + H2SO4===Na2SO4+2H2O
1×0.04 0.02
7
V(H2SO4)==0.04 L=40 mL,总体积(40+40)mL=80 mL。
6.(2019·洛阳模拟)如图曲线a和b是盐酸与氢氧化钠相互滴定的滴定曲线,下列叙述正确的是( )
A.盐酸的物质的量浓度为1 mol/L
B.P点时恰好完全反应,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用作本实验的指示剂
解析:选B 由滴定起始时pH=1可知盐酸的浓度为0.1 mol/L,A错;曲线a起始时溶液pH=1,可知是NaOH溶液滴定盐酸的曲线,C错;酸碱中和滴定操作中可选用酚酞或甲基橙作为指示剂,D错。
7.(1)取体积相同(0.025 L)的两份0.10 mol/L NaOH溶液,把其中一份放在空气中一段时间后,溶液的pH________(填“增大”“减小”或“不变”),其原因是______________________________________。
(2)用已知浓度的硫酸溶液中和上述两份NaOH溶液,若中和第一份(在空气中放置一段时间)所消耗硫酸溶液的体积为VA,另一份消耗硫酸溶液的体积为VB,则:
①以甲基橙为指示剂时,VA与VB的关系是________;
②以酚酞为指示剂时,VA与VB的关系是________。
解析:NaOH溶液放置于空气中,因NaOH与空气中CO2反应,使NaOH减少,故溶液的pH减小。
用H2SO4滴定Na2CO3溶液,反应分两个阶段进行:
①H++CO===HCO(此时溶液呈弱碱性)
②H++HCO===CO2↑+H2O(此时溶液呈弱酸性)
滴定过程按哪种反应进行,取决于选择的指示剂。
①若选用甲基橙作指示剂,因其变色范围为pH=3.1~4.4,滴定反应按①②进行完全,由关系式2NaOHNa2CO3~2H+~CO2知,消耗的H2SO4的量不变,故答案为VA=VB。
②若选用酚酞作指示剂,酚酞的变色范围为pH=8.2~10,滴定反应按①进行,消耗H2SO4的量减少,故答案为VA
相关文档
- 高中化学第3章水溶液中的离子平衡2021-07-057页
- 高中化学水溶液中的离子平衡第节水2021-07-0534页
- 高中化学第三章水溶液中的离子平衡2021-07-055页
- 高中化学第三章水溶液中的离子平衡2021-07-059页
- 高中化学第三章水溶液中的离子平衡2021-07-054页
- 高中化学第三章水溶液中的离子平衡2021-07-0515页
- 高考化学图像专题题复习:水溶液中的2021-07-057页
- 2020年高中化学 第03章 水溶液中的2021-07-058页
- 2020年高中化学 第03章 水溶液中的2021-07-058页
- 2020届二轮复习水溶液中的离子平衡2021-07-05135页