- 666.98 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学试题 第 1 页(共 7 页)
武威一中 2019 年秋学期第二次阶段性考试
高三化学试题
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Mg-24 S-32 C1-35.5 Co-59 Fe-56 Ba-137
第 I 卷(选择题,共 50 分)
一、选择题(本题共 25 个小题,每小题 2 分。在每小题给出的四个选项中,只有一个符合题目要求)
1.2019 年世界环境日我国确定的主题为“蓝天保卫战,我是行动者”。下列做法不应提倡的是( )
A.选择乘公共交通、步行和自行车等低碳绿色方式出行
B.积极响应滴水必珍、全民节水行动,建设节水型社会
C.日常生活中使用一次性筷子、纸杯、快餐盒和塑料袋
D.生活垃圾分类投放、分类收集、分类运输和分类处理
2.下列有关“化学与生活”的描述中正确的是( )
A.绚丽缤纷的烟花中加了含铁、铂、钾、钙、铜等金属化合物
B.“玉兔二号”钛合金筛网轮是金属材料,其强度高、耐蚀性好、耐热性高
C.根据反应 Na + KCl══K + NaCl 可知,钠的金属性强于钾
D.铁盐可作净水剂,因此用于制造白纸的水可先加铁盐净化
3.下列我国科技成果所涉及物质的应用中,发生的不是..化学变化的是( )
A.甲醇低温所制氢
气用于新能源汽车
B.氘、氚用作“人造太阳”
核聚变燃料
C.偏二甲肼用作发射
“天宫二号”的火箭燃料
D.开采可燃冰,将
其作为能源使用
4.我国古代典籍中有“石胆……浅碧色,烧之变白色者真”的记载,其中石胆是指( )
A. CuSO4·5H2O B. FeSO4·7H2O C. ZnSO4·7H2O D. KAl(SO4)2·12H2O
5.下列说法正确的是( )
A. MgO 和 Al2O3 都属于两性氧化物 B. 悬浊液和乳浊液的分散质均为液态
C. Fe3O4 和 Pb3O4 中的金属都呈现两种价态 D. 葡萄糖溶液和淀粉溶液都具有丁达尔效应
6.下列关于金属及其化合物的说法中正确的是( )
A.碳酸钠溶液中的碳酸氢钠可以用加热的方法除去
B.由于 Mg、Al 比较活泼,工业上常用电解其熔融的氯化物来制备 Mg、Al 单质
熔融
化学试题 第 2 页(共 7 页)
C.Li 在空气中燃烧可得到氧化锂和过氧化锂两种氧化物
D.CuCl2 溶液中混有少量的 FeCl2,可以先加入 H2O2,再加入 CuO 充分反应后过滤除去
7.常温常压下,取四只完全一样的针筒,分别充入等质量的 CH4、O2、 CO2、SO2 四种气体,其中
充装 CH4 的是( )
A. B. C. D.
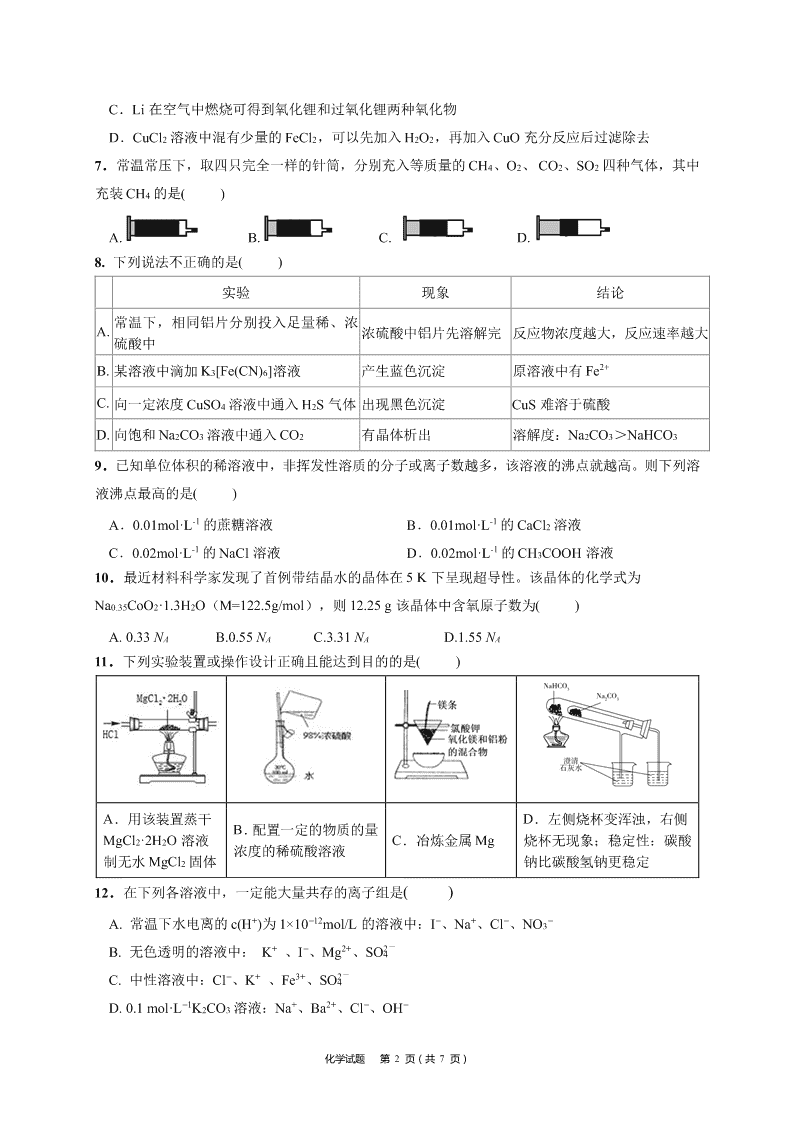
8. 下列说法不正确的是( )
实验 现象 结论
A. 常温下,相同铝片分别投入足量稀、浓
硫酸中
浓硫酸中铝片先溶解完 反应物浓度越大,反应速率越大
B. 某溶液中滴加 K3[Fe(CN)6]溶液 产生蓝色沉淀 原溶液中有 Fe2+
C. 向一定浓度 CuSO4 溶液中通入 H2S 气体 出现黑色沉淀 CuS 难溶于硫酸
D. 向饱和 Na2CO3 溶液中通入 CO2 有晶体析出 溶解度:Na2CO3>NaHCO3
9.已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高。则下列溶
液沸点最高的是( )
A.0.01mol·L-1 的蔗糖溶液 B.0.01mol·L-1 的 CaCl2 溶液
C.0.02mol·L-1 的 NaCl 溶液 D.0.02mol·L-1 的 CH3COOH 溶液
10.最近材料科学家发现了首例带结晶水的晶体在 5 K 下呈现超导性。该晶体的化学式为
Na0.35CoO2·1.3H2O(M=122.5g/mol),则 12.25 g 该晶体中含氧原子数为( )
A. 0.33 NA B.0.55 NA C.3.31 NA D.1.55 NA
11.下列实验装置或操作设计正确且能达到目的的是( )
A.用该装置蒸干
MgCl2·2H2O 溶液
制无水 MgCl2 固体
B.配置一定的物质的量
浓度的稀硫酸溶液 C.冶炼金属 Mg
D.左侧烧杯变浑浊,右侧
烧杯无现象;稳定性:碳酸
钠比碳酸氢钠更稳定
12.在下列各溶液中,一定能大量共存的离子组是( )
A. 常温下水电离的 c(H+)为 1×10−12mol/L 的溶液中:I−、Na+、Cl−、NO3−
B. 无色透明的溶液中: K+ 、I−、Mg2+、SO2-
4
C. 中性溶液中:Cl−、K+ 、Fe3+、SO2-
4
D. 0.1 mol·L −1K2CO3 溶液:Na+、Ba2+、Cl−、OH−
化学试题 第 3 页(共 7 页)
13.下列指定反应的离子方程式正确的是( )
A. 向 Mg(HCO3)溶液中加入少量澄清石灰水:
Mg2+ +2HCO3− +2Ca2+ +4OH− = Mg(OH)2↓+2CaCO3 ↓+ 2H2O
B. 用铝粉和 NaOH 溶液反应制取少量 H2:Al+2OH− AlO2−+H2↑
C. 少量的 CO2 通入 NaClO 溶液:2ClO−+ H2O + CO2 =2HClO + CO32-
D. 向明矾溶液中加入 Ba(OH)2 溶液至 Al3+刚好沉淀完全:
2Al3+ + 3SO2-
4 + 3Ba2+ + 6OH- = 3BaSO4↓+ 2Al(OH)3↓
14.已知 15.5gCO、HCOOCH3、HCHO、CH3COOH 的混合物在 O2 中完全燃烧,将其产物通过足量
的 Na2O2 后,则 Na2O2 固体增重为( )
A.14.7g B.16.1g C.15.5g D.无法确定
15.向 Na2CO3、NaHCO3,混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如
图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
A.a 点对应的溶液中:Na+、OH-、SO42- 、NO3-
B.b 点对应的溶液中:Al3+、Fe3+、MnO4-、Cl−
C.c 点对应的溶液中:Na+.Ca2+.NO3-、Cl-
D.d 点对应的溶液中:F−、NO3-、Fe2+、Ag+
16.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在.该白色粉末可能为( )
A.NaHCO3、 A1(OH)3 B.AgCl、 NaHCO3 C.Na2SO4、BaCO3 D.Na2CO3、CuSO4
17.下列各组物质充分反应后,最终既有沉淀生成又有气体生成的是 ( )
①少量 Na2O2 投入 Ca(HCO3)2 溶液中 ②过量 Ba(OH)2 溶液和 NH4HSO4 溶液混合加热
③NaAlO2 溶液与 NaHCO3 溶液混合 ④FeCl3 溶液与 Na2SO3 溶液混合
⑤钠投入到饱和 NaCl 溶液中
A.②③④ B.①②⑤ C.①③④ D.①②③
18.探究 Na2O2 与水的反应,实验如图:(已知:H2O2 H+ + HO2-、HO2- H+ + O22-)下列分
析不正确...的是( )
A.①、⑤中产生的气体能使带火星的木条复燃
化学试题 第 4 页(共 7 页)
B.①、④中均发生了氧化还原反应和复分解反应
C.②、⑤中 KMnO4 与 MnO2 的作用不同,产生气体的量也不同
D.通过③能比较酸性:HCl>H2O2
19.在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分。当左边充入 1molN2,右
边充入 8gCO 和 CO2 的混合气体时,隔板处于如右图所示位置(两侧温度、压强均相同)。则混合
气体中 CO 和 CO2 的分子个数比为
A.1:1 B.1:3 C.3:1 D.2:1
20.NA 是阿伏伽德罗常数的值,下列相关说法正确..的是( )
①常温常压下,30gNO 和 16gO2 组成的混合气体中所含分子数为 1.5NA
②2.4g 镁在空气中完全燃烧生成 MgO 和 Mg3N2,转移的电子数为 0.2NA
③65gNaN3 中阴离子含有的电子数为 16NA
④0.1mol FeCl3 完全水解生成的 Fe(OH)3 胶体粒子数为 0.1NA
⑤标准状况下,11.2LHF 中所含分子数为 0.5NA
⑥固体 B(硼)的结构单元如图 ,则 11g 固体 B 含有 0.6 NA 个三角形(相邻原子构成)
⑦等物质的量的甲基(-CH3)和羟基(-OH)所含电子数均为 9NA
⑧8.0gCu2S 和 CuO 的混合物中含有铜原子数为 0.1 NA
A.②③⑤⑧ B.①④⑥ C. ①⑥⑦ D. ②⑧
21.下列各组物质之间通过一步反应能实现如图所示转化关系,且与表中条件也匹配的是( )
选项 X Y Z 箭头上为反应条件或试剂
A Fe FeCl2 FeCl3 ①通入少量 Cl2
B Na2CO3 NaCl NaHCO3 ②先通 CO2,再通过量 NH3
C MgO MgCl2 Mg(OH)2 ③加热
D NaAlO2 Al(OH)3 Al2O3 ④加水
22.对于 3BrF3+5H2O=HBrO3+Br2+9HF+O2 反应,若有 5mol 水充当还原剂,则被水还原的 BrF3 的
物质的量为( )
A. 2/3 mol B.10/3 mol C.2 mol D.4/3 mol
23.已知 H2S+I2═2HI+S↓,现向含 S2-、Fe2+、Br-、I-各 0.1mol 的溶液中通入 Cl2,通入 Cl2 的体积(标
准状况)和溶液中相关离子的物质的量关系图正确的是( )
A. B. C. D.
化学试题 第 5 页(共 7 页)
24.右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的
是( )
A.该硫酸的物质的量浓度为 9.2 mol·L-1
B.该硫酸与等体积的水混合所得溶液的质量分数小于 49%
C.配制 200mL 4.6 mol·L-1 的稀硫酸需取该硫酸 50.0mL
D.该硫酸 50.0mL 与足量的铜反应可得到标准状况下 SO2 气体 10.304 L
25.向 18.4g 铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成 NO2、NO 混合气
体,再向所得溶液中加入足量的 NaOH 溶液,生成 30.3g 沉淀.另取等质量的合金,使其与一定量
的氯气恰好完全反应,则氯气的体积在标准状况下为( )
A.7.84L B.6.72L C.4.48L D.无法计算[来源:Zxxk.Com]
第Ⅱ卷(非选择题,共 50 分)
二、非选择题(本题共包括 4 个大题,共 50 分)
26.(10 分)常温下,二氧化氯(ClO2)是一种黄绿色气体,具有强氧化性,已被联合国世界卫生
组织(WHO)列为 AI 级高效安全消毒剂。常温下,它可用氯酸钠固体与浓盐酸反应制备得到,该反应
体系中的物质有 NaCl 、H2O、ClO2、NaClO3、Cl2、HCl。
(1)写出并配平该反应的化学方程式 _____________________________________。
(2)该反应的还原产物是_____________。
(3)在标准状况下,如果反应中生成 11.2L 氯气,则被氧化的 HCl 的物质的量为______,转移电
子数目为 ___________。
(4)二氧化氯可迅速氧化硫化物(其中还原产物中氯元素为负一价),以除去水中硫化物产生的
臭味。取适量 ClO2 通入到含有 H2S(二元弱酸)的水中,再向其中加入少量氯化钡溶液,发现有白
色沉淀生成。写出 ClO2 与 H2S 水溶液反应的离子方程式______________________________。
27.(14 分)2019 年 3 月 22 日是第二十七届“世界水日”, 保护水资源,合理利用废水节省水资源,
加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有 H+、NH4+、Fe3+、
Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品 100 mL,进行了
三组实验,其操作和有关图像如下所示:
请回答下列问题:
化学试题 第 6 页(共 7 页)
(1)根据上述 3 组实验可以分析废水中一定不存在的阴离子是______________________,一定存
在的阳离子是____________________________________。
(2)写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子反应方程式:
______________________________________________________________________________。
(3)分析图像,在原溶液中 c(NH4+)与 c(Al3+)的比值为___________,所得沉淀的最大质量是
_________g。
(4)若通过实验确定原废水中 c(Na+)=0.14 mol·L-1,试判断原废水中 NO3-是否存在?_______(填
“存在”“不存在”或“不确定”)。若存在,c(NO3-)=____ mol·L-1。(若不存在或不确定则此空不填)
28.(16 分)乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O,相对分子质量为 288}易溶于水,是一种
很好的补铁剂,可由乳酸[CH3 CH(OH)COOH]与 FeCO3 反应制得。
I.碳酸亚铁的制备(装置如下图所示)
(1)仪器 A 的名称是_______________;实验操作
如下:打开 kl、k2,加入适量稀硫酸,关闭 kl,使
反应进行一段时间,其目的是__________。
(2)接下来要使仪器 C 中的制备反应发生,需要进
行的操作是____________,该反应产生一种常见气
体,写出反应的离子方程式_______________________。
(3)仪器 C 中混合物经过滤、洗涤得到 FeCO3 沉淀,检验其是否洗净的方法是__________。
Ⅱ.乳酸亚铁的制备及铁元素含量测定
(4)向纯净 FeCO3 固体中加入足量乳酸溶液,在 75℃下搅拌使之充分反应,经过滤,在____________
的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
(5)铁元素含量测定:某同学经查阅资料后用碘量法测定铁元素的含量并计算样品纯度。称取 3.000
g 样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶+物配成 l00mL 溶液。吸取 25.00 rnL 该溶液
加入过量 KI 溶液充分反应,然后加入几滴淀粉溶液,用 0. 100 mol·L-1 硫代硫酸钠溶液滴定(已知:
I2+2S2O32-=S4O62-+2I-),当溶液_____________________,即为滴定终点;平行滴定 3 次,硫代硫酸
钠溶液的平均用量为 24.80 mL,则样品纯度为_________%(保留 1 位小数)。
29.(10 分)硫酸铜在工农业生产中有着广泛的应用,用某种氧化铜矿制备硫酸铜的工艺流程如下,
回答下列问题:
(1)浸出过程中反应的化学方程式是____________________________________________ 。
化学试题 第 7 页(共 7 页)
(2)萃取“相比”是表示萃取效果的参数之一,指的是有机
相(O)与水相(A)的体积比。采用一定浓度的铜萃取剂萃
取硫酸浸出液中的铜离子,测得当萃取时间为 120s 时,“相比”
(O/A)对铜萃取率的影响如上图所示。在实际操作中“相比”
应选择___________。(填序号)
A.1:1 B.1:3 C.1:5
(3)已知铜萃取剂可用 HR(O)表示,萃取过程可表示为:Cu2++2HR(O) CuR2(O)+2H+,反萃
取加入 400 g·L-1 硫酸的理由是_________________________________。
(4)热重分析法是程序控制温度下,测量物质的质量与温度关系的一种实验技术。现取 2.50 g 胆
矾样品,逐渐升温加热分解,分解过程的热重曲线(样品质量随温度变化的曲线)如图所示。
①a 点时固体物质的化学式为________________________。
②1 000 ℃时发生反应的化学方程式为______________________。
武威一中 2019 年秋季学期阶段性考试
高三化学试题参考答案
一、选择题(本题共 25 个小题,每小题 2 分,共 50 分)
1 2 3 4 5 6 7 8 9 10
C B B A C D D A C A
11 12 13 14 15 16 17 18 19 20
A B D C C A B D C D
21 22 23 24 25
C B D C A
二、非选择题(本题共包括 4 个大题,每空 2 分,共 50 分)
26. (10 分)2NaClO3 + 4HCl(浓)= 2ClO2↑ + Cl2↑ + 2H2O + 2NaCl (2 分) ClO2 (2 分)
1mol(2 分) 6.02×1023 或 NA (2 分) 5H2S + 8ClO2 + 4H2O = 5SO42- + 8Cl- + 18H+(2 分)
27. (14 分)(1)CO32- (2 分) Na+、H+、Al3+、NH4+ (全对 2 分,不全 1 分,有错 0 分)
(2)NH4+ + OH﹣ = NH3·H 2O (2 分) (3)1:1(2 分) 0.546g(2 分)
(4)存在(2 分) 0.36 mol·L-1(2 分)
28. (16 分)(1) 分液漏斗(2 分) 用产生的 H2 排尽装置内的空气、生成 FeSO4 溶液 (2 分)
(2) 关闭 k2 (2 分) Fe2++2HCO3
-==FeCO3↓+CO2↑+H2O (2 分)
(3) 取最后一次洗涤液,加入过量稀盐酸,再加入一定量 BaCl2 溶液,若无白色沉淀,则洗涤干净(2 分)
(4) 隔绝空气(2 分) (5) 蓝色褪去且半分钟不恢复 (2 分) 95.2%(2 分)
29. (10 分)(1) CuO+H2SO4=CuSO4+H2O (2 分) (2)B (2 分)
(3)增大 c(H+) 使平衡逆向移动,有利于铜离子反萃取(或其它合理答案) (2 分)
(4)①CuSO4·3H2O (2 分)
②4CuO ====== 2Cu2O+O2↑ (2 分)
1000℃
相关文档
- 江西省宜春市宜丰中学2019-2020学2021-07-057页
- 全国卷I2020届高考化学模拟试卷精2021-07-0511页
- 江西省宜春市靖安中学2019-2020学2021-07-058页
- 化学卷·2018届贵州省遵义市湄潭县2021-07-0512页
- 2020-2021学年高一(上)第一次月考2021-07-0514页
- 黑龙江省安达市第七中学2019-20202021-07-0513页
- 山西省大同市云冈区实验中学2019-22021-07-052页
- 贵州省贵阳市第二中学2018-2019学2021-07-0519页
- 安徽省皖江2021届高三8月份月考化2021-07-0513页
- 化学卷·2018届山东省临沂市蒙阴一2021-07-0530页