- 413.00 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
一、单项选择题
1.某晶体中含有极性键,关于该晶体的说法错误的是( )
A.不可能有很高的熔、沸点
B.不可能是单质
C.可能是有机物
D.可能是离子晶体
解析:选A。A.在SiO2晶体中含有极性共价键Si—O键,由于该晶体是原子晶体,原子之间通过共价键结合,断裂需要吸收很高的能量,因此该物质的熔、沸点很高,错误。B.同种元素的原子形成的共价键是非极性共价键,不同种元素的原子形成的共价键是极性共价键,因此含有极性键的物质不可能是单质,正确。C.若该极性键存在于含有C元素的化合物中,如CH4、CH3CH2OH等,则相应的物质是有机物,正确。D.离子化合物中一定含有离子键,可能含有极性共价键,如NaOH,也可能含有非极性共价键,如Na2O2,因此含有极性键的化合物可能是离子晶体,正确。
2.下列性质适合于某种原子晶体的是( )
A.熔点1 070 ℃,易溶于水,水溶液导电
B.熔点10.32 ℃,液态不导电,水溶液导电
C.能溶于CS2,熔点112 ℃,沸点444.6 ℃
D.熔点3 550 ℃,很硬,不溶于水,不导电
解析:选D。由原子晶体所具有的一般特点:熔、沸点高,硬度大,不溶于水等性质,可以推断D项描述的晶体是原子晶体。
3.下面有关晶体的叙述中,不正确的是( )
A.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.氯化钠晶体中,每个Na+周围等距且紧邻的Na+共有6个
C.氯化铯晶体中,每个Cs+周围等距且紧邻8个Cl-
D.干冰晶体中,每个CO2分子周围等距且紧邻12个CO2分子
解析:选B。氯化钠晶体中,每个Na+周围等距且紧邻的Na+共有12个,等距且紧邻的Cl-共有6个。
4.下列说法正确的是( )
A.原子晶体中只存在非极性共价键
B.因为HCl的相对分子质量大于HF,所以HCl的沸点高于HF
C.液氮汽化时,分子内共价键不会发生断裂
D.凡有规则外形的固体一定是晶体
解析:选C。A项SiO2中存在极性键;B项HF分子间存在氢键,故HF的沸点高。
5.下列有关化学键与晶体结构的说法正确的是( )
A.两种元素组成的分子中一定只有极性键
B.CO2与SiO2晶体类型相同
C.非金属元素组成的化合物一定是共价化合物
D.只要含有离子键的晶体就是离子晶体
解析:选D。本题可用举例法判断,选项A中如H2O2和C2H6分子中既含有极性键又含有非极性键,A错。CO2属于分子晶体,SiO2属于原子晶体,B错。对于选项C可考虑铵盐,常见的铵盐如NH4NO3只由非金属元素组成,但属于离子化合物,C错。
6.下面的排序不正确的是( )
A.晶体熔点由低到高:CF4碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.离子键强弱:NaF>NaCl>NaBr>NaI
解析:选C。选项A中晶体熔点与分子间作用力有关,相对分子质量越大,分子间作用力越大,选项A正确;选项B中硬度与共价键的键能有关,由于Si—Si 键的键长>C—Si 键的键长>C—C键的键长,键长越长,键能越小,选项B正确;选项C中熔点与金属键的强弱有关,金属性越强,金属键越弱,因此正确的顺序为Al>Mg>Na,选项C错误;选项D中离子键强弱与离子半径和离子所带电荷数有关,选项D正确。
二、不定项选择题
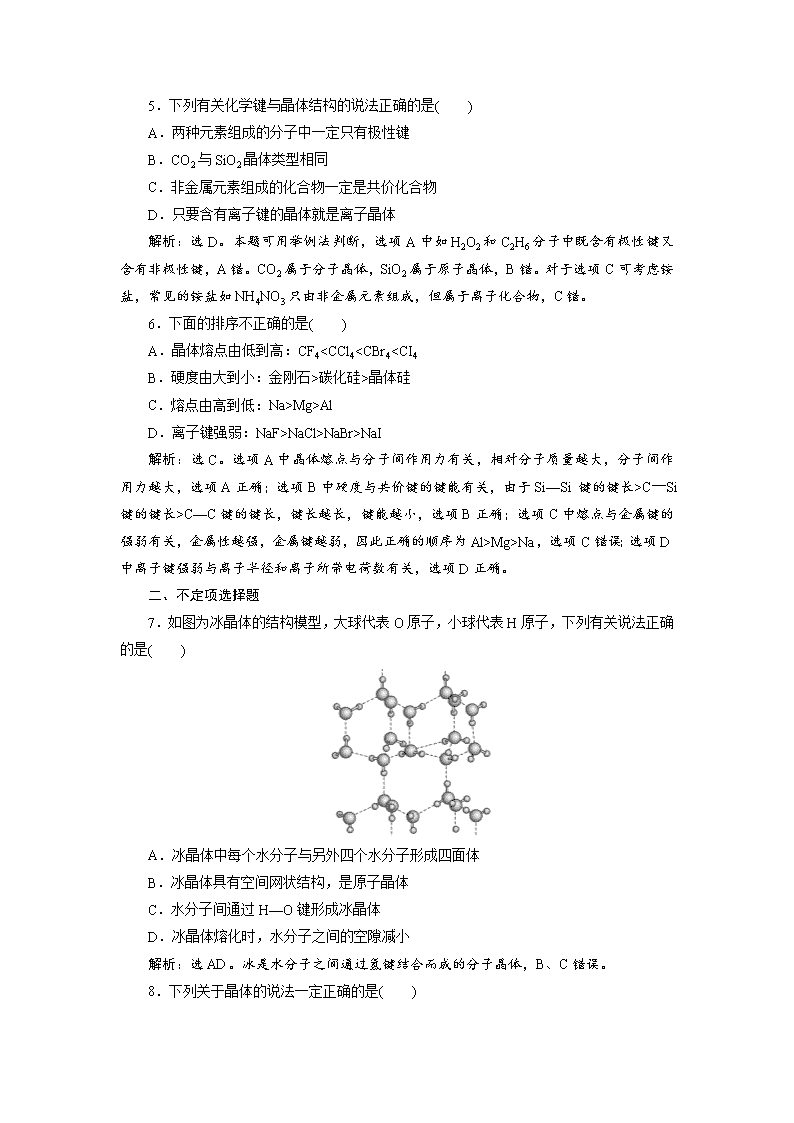
7.如图为冰晶体的结构模型,大球代表O原子,小球代表H原子,下列有关说法正确的是( )
A.冰晶体中每个水分子与另外四个水分子形成四面体
B.冰晶体具有空间网状结构,是原子晶体
C.水分子间通过H—O键形成冰晶体
D.冰晶体熔化时,水分子之间的空隙减小
解析:选AD。冰是水分子之间通过氢键结合而成的分子晶体,B、C错误。
8.下列关于晶体的说法一定正确的是( )
A.分子晶体中都存在共价键
B.CaTiO3晶体中每个Ti4+与12个O2-相邻
C.SiO2晶体中每个硅原子与4个氧原子以共价键相结合
D.金属晶体的熔点都比分子晶体的熔点高
解析:选BC。有些单原子的分子晶体中不存在共价键,如稀有气体构成的晶体,A错;因在晶体中Ti4+位于顶点而O2-位于面心,所以CaTiO3晶体中每个Ti4+与12个O2-相邻,B正确;SiO2晶体中每个Si原子与4个O原子以共价键相结合,C正确;有些金属晶体比分子晶体的熔点低,如汞在常温下为液体,D错。
9.高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O
B.晶体中每个K+周围有8个O,每个O周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中与每个K+距离最近的K+有6个
解析:选A。由题中的晶胞结构知:有8个K+位于顶点,6个K+位于面心,则晶胞中含有的K+数为8×+6×=4个;有12个O位于棱上,1个O处于中心,则晶胞中含有O数为12×+1=4个,所以超氧化钾的化学式为KO2;每个K+周围有6个O,每个O周围有6个K+,与每个K+距离最近的K+有12个。
三、非选择题
10.下图为几种晶体或晶胞的示意图:
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为________________________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的熔点________(填“大于”或“小于”)MgO晶体,原因是_____________________________________________________________
________________________________________________________________________。
(4)每个Cu晶胞中实际占有________个Cu原子,CaCl2晶体中Ca2+的配位数为________。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是________________________________________________________________________
________________。
答案:(1)金刚石晶体
(2)金刚石、MgO、CaCl2、冰、干冰
(3)小于 MgO晶体中离子所带的电荷数大于NaCl晶体中离子所带的电荷数,且r(Mg2+)<r(Na+)、r(O2-)<r(Cl-)
(4)4 8 (5)H2O分子之间能形成氢键
11.氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可做高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。
(1)基态硼原子的电子排布式为__________________________________________。
(2)关于这两种晶体的说法,正确的是________(填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B—N键均为共价键
d.两种晶体均为分子晶体
(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为________,其结构与石墨相似却不导电,原因是_________________________________________________
________________________________________________________________________。
(4)立方相氮化硼晶体中,硼原子的杂化轨道类型为________。该晶体的天然矿物在青藏高原地下约300 km的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是____________________________________________。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 mol NH4BF4含有________mol配位键。
解析:(1)B的原子序数为5,故其基态原子的电子排布式为1s22s22p1。
(2)立方相氮化硼晶体的硬度大小与是否含有σ键和π键无关,与晶体的结构有关,即立方相氮化硼晶体为原子晶体,硬度较大,a错误;六方相氮化硼晶体与石墨晶体相似,根据石墨晶体可知其层和层之间是靠范德华力结合的,故其作用力小,质地较软,b正确;B和N都是非金属元素,两种晶体中的B—N键都是共价键,c正确;六方相氮化硼晶体与石墨晶体相似,属于混合型晶体,立方相氮化硼晶体为原子晶体,d错误。
(3)六方相氮化硼晶体与石墨晶体相似,同一层上的原子在同一平面内,根据六方相氮化硼晶体的晶胞结构可知,1个B原子与3个N原子相连,故为平面三角形结构;由于B最外层有3个电子,都参与了成键,层与层之间没有自由移动的电子,故不导电。
(4)立方相氮化硼晶体的结构与金刚石相似,故B原子为sp3杂化;该晶体存在地下约300 km的古地壳中,因此制备需要的条件是高温、高压。
(5)NH中有1个配位键,BF中有1个配位键,故1 mol NH4BF4含有2 mol配位键。
答案:(1)1s22s22p1 (2)bc (3)平面三角形 层状结构中没有自由移动的电子 (4)sp3 高温、高压 (5)2
12.M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是________________
________________________________________________________________________。
(2)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是________(填离子符号)。
(3)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________________________________________________
________________________________________________________________________。
解析:由M基态原子L层中p轨道电子数是s轨道电子数的2倍可知,M为氧元素;R是同周期元素中最活泼的短周期金属元素,且原子序数大于氧元素,故R为钠元素;X和M形成的一种化合物是引起酸雨的主要大气污染物,故X为硫元素,Y为氯元素;Z的基态原子4s和3d轨道半充满,故其电子排布式为1s22s22p63s23p63d54s1,故Z为铬元素。(1)S的氢化物为H2S,与H2S组成相似的O的氢化物为H2O,由于水分子间能够形成氢键,使H2O的沸点高于H2S。(2)分析Na2O的晶胞结构图,利用均摊法可知,黑球与白球的个数之比为2∶1,故黑球代表的离子为Na+。(3)在稀硫酸中,K2Cr2O7具有很强的氧化性,能把H2O2氧化,化学方程式为K2Cr2O7+3H2O2+4H2SO4===K2SO4+Cr2(SO4)3+3O2↑+7H2O。
答案:(1)H2S分子间不存在氢键,H2O分子间存在氢键
(2)Na+
(3)K2Cr2O7+3H2O2+4H2SO4===K2SO4+Cr2(SO4)3+3O2↑+7H2O
13.原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的一种1∶2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s原子轨道与p原子轨道电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有________种不同运动状态的电子,T原子有________种不同原子轨道的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为________(用元素符号表示)。
(3)Z与R能形成化合物甲,1 mol甲中含________ mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为__________________。
(4)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为______________________
________________________________________________________________________。
氟化物
G的氟化物
Q的氟化物
R的氟化物
熔点/K
993
1 539
183
(5)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(6)X单质的晶胞如图所示,一个X晶胞中有________个X原子;若X晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则晶体中最近的两个X原子之间的距离为________cm(用代数式表示)。
解析:根据信息推断出X为C、Y为N、Z为O、Q为Mg、R为Si、T为Cu,而结合(4)中信息可知G为Na。(1)原子中每个电子的运动状态都不相同,N原子有7个电子,故有7种运动状态不同的电子;Cu的电子排布式为1s22s22p63s23p63d104s1,共有1s、2s、2p、3s、3p、3d、4s7种不同原子轨道的电子。(2)注意第一电离能的反常性。(3)1 mol SiO2含4 mol Si—O键,SiO2与HF反应生成的SiF4的空间构型为正四面体形,而生成的H2O为V形。(5)氨水过量后,生成的是配离子[Cu(NH3)4]2+。(6)晶胞中原子数=×8+×6+4=8;两个C原子间最近的距离是晶胞体对角线的,即a(a为晶胞棱长),根据上述思路计算即可。
答案:(1)7 7 (2)C<O<N
(3)4 正四面体形、V形
(4)NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点最低;Mg2+的半径比Na+的半径小,Mg2+所带电荷数比Na+多,故MgF2的熔点比NaF高
(5)Cu2++2NH3·H2O===Cu(OH)2↓+2NH、
Cu(OH)2+4NH3·H2O===[Cu(NH3)4]2++2OH-+4H2O
(6)8 ×
相关文档
- 2021版浙江高考选考化学一轮复习课2021-07-058页
- 2021版新高考地区选考化学(人教版)一2021-07-056页
- 2021版新高考地区选考化学(人教版)一2021-07-056页
- 2021版新高考地区选考化学(人教版)一2021-07-057页
- 2021版江苏新高考选考化学(苏教版)一2021-07-057页
- 2021版浙江高考选考化学一轮复习课2021-07-057页
- 2021版浙江高考选考化学一轮复习课2021-07-054页
- 2021版江苏新高考选考化学(苏教版)一2021-07-058页
- 2021版新高考地区选考化学(人教版)一2021-07-057页
- 2021版新高考地区选考化学(人教版)一2021-07-057页