- 595.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第2课时 元素的性质与原子结构
[目标导航] 1.了解碱金属、卤素原子在周期表中的位置。2.了解碱金属、卤素原子的结构特点,了解原子结构与元素性质的关系。3.了解碱金属、卤素性质的相似性与递变性,并能初步运用原子结构理论解释。
一、碱金属元素
1.结构特点
(1)完成表格
元素
名称
元素
符号
核电
荷数
原子结构
示意图
最外层
电子数
电子
层数
原子半
径/nm
碱
金
属
元
素
锂
Li
3
]
1
2
0.152
钠
Na
11
]
1
3
0.186
钾
K
19
]
1
4
0.227
铷
Rb
37
]
1
5
0.248
铯
Cs
55
]
1
6
0.265
(2)得出结论:碱金属元素原子结构的共同点是最外层电子数均为1,不同点是电子层数和原子半径不同,其变化规律是随着核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大。
2.碱金属的性质
(1)物理性质
(2)化学性质
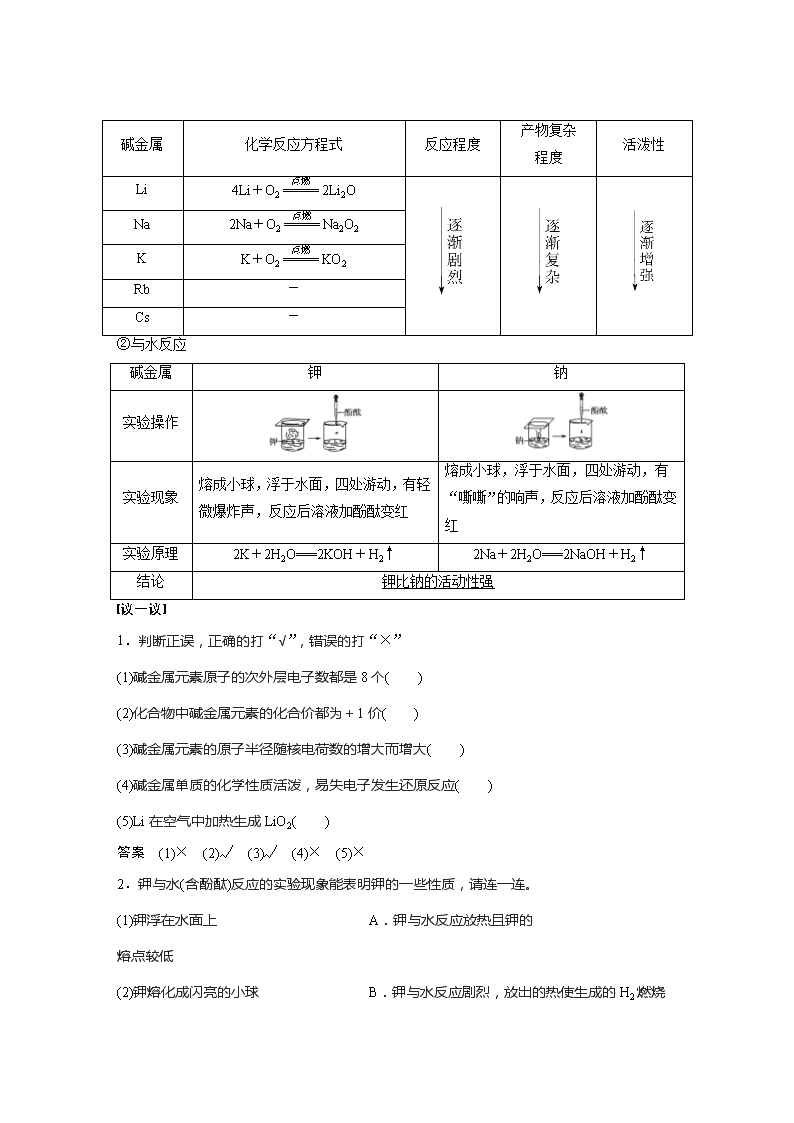
①与O2反应
碱金属
化学反应方程式
反应程度
产物复杂
程度
活泼性
Li
4Li+O22Li2O
Na
2Na+O2Na2O2
K
K+O2KO2
Rb
-
Cs
-
②与水反应
碱金属
钾
钠
实验操作
实验现象
熔成小球,浮于水面,四处游动,有轻微爆炸声,反应后溶液加酚酞变红
熔成小球,浮于水面,四处游动,有“嘶嘶”的响声,反应后溶液加酚酞变红
实验原理
2K+2H2O===2KOH+H2↑
2Na+2H2O===2NaOH+H2↑
结论
钾比钠的活动性强
议一议
1.判断正误,正确的打“√”,错误的打“×”
(1)碱金属元素原子的次外层电子数都是8个( )
(2)化合物中碱金属元素的化合价都为+1价( )
(3)碱金属元素的原子半径随核电荷数的增大而增大( )
(4)碱金属单质的化学性质活泼,易失电子发生还原反应( )
(5)Li在空气中加热生成LiO2( )
答案 (1)× (2)√ (3)√ (4)× (5)×
2.钾与水(含酚酞)反应的实验现象能表明钾的一些性质,请连一连。
(1)钾浮在水面上 A.钾与水反应放热且钾的
熔点较低
(2)钾熔化成闪亮的小球 B.钾与水反应剧烈,放出的热使生成的H2燃烧
(3)钾球四处游动,并有轻,微的爆鸣声 C.钾的密度比水小
(4)溶液变为红色 D.钾与水反应后
的溶液呈碱性
答案 (1)—C (2)—A (3)—B (4)—D
二、卤族元素
1.原子结构
(1)完成表格:
元素名称
氟(F)
氯(Cl)
溴(Br)
碘(I)
原子序数
9
17
35
53
原子结构
示意图
最外层电子数
7
7
7
7
电子层数
2
3
4
5
原子半径
由小到大
(2)得出结论:卤族元素原子结构的共同点是最外层电子数都是7,不同点是电子层数和原子半径不同,其变化规律是随着原子序数增大,电子层数逐渐增多,原子半径逐渐增大。
2.卤族元素单质的性质
(1)物理性质
(2)化学性质
①与H2反应
a.填写下表:
反应条件
化学方程式
产物稳
定性
F2
暗处
H2+F2===2HF
很稳定
Cl2
光照或点燃
H2+Cl22HCl
较稳定
Br2
加热
H2+Br22HBr
不稳定
I2
不断加热
H2+I22HI
很不稳定
b.得出结论:从F2到I2,与H2反应所需要的条件逐渐升高,反应剧烈程度依次减弱,生成气态氢化物的稳定性依次减弱。
②卤素单质间的置换反应
a.填写下表:
实验操作
实验现象
化学方程式
静置后,液体分层,上层无色,下层橙红色
2NaBr+Cl2===2NaCl+Br2
静置后,液体分层,上层无色,下层紫红色
2KI+Br2===2KBr+I2
静置后,液体分层,上层无色,下层紫红色
2KI+Cl2===2KCl+I2
b.得出结论:Cl2、Br2、I2三种卤素单质的氧化性由强到弱的顺序是Cl2>Br2>I2,相应卤素离子的还原性由强到弱的顺序是I->Br->Cl-。
提醒 因为F2能与H2O发生反应(2F2+2H2O===4HF+O2),所以F2不能从其他卤化物的盐溶液中置换出卤素单质。
议一议
1.判断正误,正确的打“√”,错误的打“×”(X代表卤素)
(1)卤素单质与水反应均可用X2+H2O===HXO+HX表示( )
(2)HX都极易溶于水,它们的热稳定性随核电荷数增加而增强( )
(3)卤素单质的颜色从F2―→I2按相对分子质量增大而加深( )
(4)将F2通入NaCl溶液中可置换出Cl2( )
答案 (1)× (2)× (3)√ (4)×
解析 (1)F2与H2O反应为2F2+2H2O===4HF+O2,不可用X2+H2O===HXO+HX表示。(2)HX的热稳定性随核电荷数的增加而减弱。(4)F2性质极活泼,遇盐溶液先和水反应,故不能将卤素从它的盐溶液里置换出来。
2.已知还原性I->Br->Cl->F-,试从原子结构的角度分析原因。
答案 还原性即微粒失去电子的能力。按I-→Br-→Cl-→F-的顺序,离子的半径逐渐减小,原子核对最外层电子的吸引力逐渐增大,失去电子的能力逐渐减弱,故还原性逐渐减弱。
一、碱金属元素单质化学性质的相似性和递变性
例1 下列对碱金属性质的叙述中,正确的是( )
A.碱金属元素的单质具有强还原性,可置换出硫酸铜溶液中的铜单质
B.单质在空气中燃烧生成的都是过氧化物
C.碱金属单质与水反应生成碱和氢气
D.单质熔、沸点随着原子序数递增而升高
解析 A项中碱金属元素的单质具有强还原性,但活泼的金属易与H2O反应,故不能从盐溶液中置换出不活泼的金属,A项错;锂在空气中燃烧生成的是氧化锂,而不是过氧化锂,B项错;碱金属单质的熔、沸点随着原子序数的递增而降低,D项错;碱金属都能与水反应生成对应的碱和氢气,只是反应越来越剧烈,C项正确。
答案 C
归纳总结 碱金属的原子结构与化学性质的关系
(1)相似性
原子都容易失去最外层的一个电子,化学性质活泼,它们的单质都具有较强的还原性,它们都能与氧气等非金属单质及水反应。碱金属与水反应的通式为2R+2H2O===2ROH+H2↑(R表示碱金属元素)。
(2)递变性
随着原子序数的递增,原子半径逐渐增大,原子核对最外层电子的引力逐渐减小,碱金属元素的原子失电子能力逐渐增强,金属性逐渐增强。
①
②与O2的反应越来越剧烈,产物更加复杂,如Li与O2反应只能生成Li2O,Na与O2反应还可以生成 Na2O2,而K与O2反应能够生成KO2等。
③与H2O的反应越来越剧烈,如K与H2O反应可能会发生轻微爆炸,Rb与Cs遇水发生剧烈爆炸。
④最高价氧化物对应水化物的碱性逐渐增强,CsOH的碱性最强。
变式训练1 下列各组比较不正确的是( )
A.锂与水反应不如钠与水反应剧烈
B.还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠
C.熔、沸点:Li>Na>K
D.碱性:LiOH<NaOH<KOH
答案 B
解析 锂的活泼性比钠弱,与水反应不如钠剧烈,A正确;还原性:K>Na>Li,但K
不能置换出NaCl溶液中的Na,而是先与H2O反应,B错误;碱金属元素从Li到Cs,熔、沸点逐渐降低,即Li>Na>K>Rb>Cs,C正确;从Li到Cs,碱金属元素的金属性逐渐增强,对应最高价氧化物的水化物的碱性依次增强,即碱性:LiOH<NaOH<KOH<RbOH<CsOH,D正确。
二、卤素单质的相似性、递变性和特性
例2 下列对卤素的说法不符合递变规律的是( )
A.F2、Cl2、Br2、I2的氧化性逐渐减弱
B.HF、HCl、HBr、HI的热稳定性逐渐减弱
C.F-、Cl-、Br-、I-的还原性逐渐增强
D.卤素单质按F2、Cl2、Br2、I2的顺序颜色变浅,密度增大
解析 从F→I原子半径依次增大,单质氧化性逐渐减弱,则阴离子的还原性逐渐增强,氢化物的稳定性逐渐减弱,卤素单质按F2、Cl2、Br2、I2的顺序颜色逐渐变深,密度也逐渐增大。
答案 D
归纳总结 卤素的原子结构与化学性质的关系
(1)相似性(X表示卤素元素)
卤素原子都容易得到一个电子使其最外层达到8个电子的稳定结构,它们的单质都是活泼的非金属单质,都具有较强的氧化性。
①与H2反应:X2+H22HX。
②与活泼金属(如Na)反应:2Na+X22NaX。
③与H2O反应
a.X2+H2O===HX+HXO(X=Cl、Br、I);
b.2F2+2H2O===4HF+O2。
④与NaOH溶液反应
X2+2NaOH===NaX+NaXO+H2O(X=Cl、Br、I)。
(2)递变性(X表示卤素元素)
随着原子序数的递增,原子半径逐渐增大,原子核对最外层电子的引力逐渐减小,卤素原子得电子的能力逐渐减弱,非金属性逐渐减弱。
①
②与H2反应越来越难,对应氢化物的稳定性逐渐减弱,还原性逐渐增强,即:
稳定性:HF>HCl>HBr>HI;
还原性:HF<HCl<HBr<HI。
③卤素单质与变价金属(如Fe)反应时,F2、Cl2、Br2生成高价卤化物(如FeX3),而I2
只能生成低价卤化物(如FeI2)。
④氢化物都易溶于水,其水溶液酸性依次增强。
⑤最高价氧化物的水化物的酸性逐渐减弱,即酸性:HClO4>HBrO4>HIO4,HClO4是已知含氧酸中酸性最强的酸。
变式训练2 砹是现知原子序数最大的卤族元素,根据卤素性质的递变规律,对砹及其化合物的叙述,正确的是( )
A.与H2化合能力:At2>I2
B.砹在常温下为白色固体
C.砹原子的最外电子层上有7个电子
D.砹能从NaCl溶液中置换出氯单质
答案 C
解析 从F2到At2,元素的非金属性逐渐减弱,与H2化合能力逐渐减弱,A项不正确;由F2到I2,单质的颜色依次加深,I2是紫黑色固体,则砹为黑色固体,B项不正确;卤族元素的原子,最外层上都有7个电子,C项正确;因氧化性Cl2>At2,所以At2不能从NaCl溶液中置换出Cl2,D项不正确。
规律总结 卤素的特性
(1)氟元素无正价,无含氧酸。F-的还原性极弱。
(2)X2+H2O===HX+HXO而2F2+2H2O===4HF+O2。
(3)Br2在常温下是唯一的一种液态非金属单质。
(4)碘为紫黑色固体,易升华,淀粉遇I2变蓝色。
(5)氢氟酸为弱酸,而盐酸、氢溴酸、氢碘酸为强酸。
三、同主族元素性质的递变规律
例3 下列关于主族元素的说法错误的是( )
A.同主族元素随着原子序数递增,元素金属性增强
B.同主族元素随着原子序数递增,元素单质的熔、沸点逐渐升高
C.同主族元素原子最外层电子数都相同
D.同主族元素最高价氧化物对应水化物的酸性逐渐减弱,碱性逐渐增强
解析 同主族元素随着原子序数的递增,电子层数逐渐增多,失电子能力逐渐增强,得电子能力逐渐减弱,即元素的金属性逐渐增强,非金属性逐渐减弱,最高价氧化物对应水化物的碱性逐渐增强,酸性逐渐减弱,A项、D项都正确;对于同主族的金属元素,单质的熔、沸点从上到下逐渐降低,对于同主族的非金属元素,单质的熔、沸点从上到下逐渐升高,B项错误;同主族元素原子最外层电子数都相同,C项正确。
答案 B
归纳总结
1.元素的性质与原子结构的关系
元素性质与原子结构密切相关,主要与原子核外电子的排布特别是最外层电子数有关。原子结构不同,元素性质不同;原子结构相似,元素性质相似;原子结构发生规律性递变,元素性质发生规律性递变。原子结构相似的同族元素,它们在化学性质上表现出相似性和递变性。
2.同主族元素性质的递变规律
从碱金属元素和卤素的性质来看,同主族从上至下元素及其典型化合物性质的递变规律如下表所示。
物质类别
性质
递变规律
元素
元素金属性
逐渐增强
元素非金属性
逐渐减弱
单质
氧化性
逐渐减弱
还原性
逐渐增强
非金属元素氢化物
气态稳定性
逐渐减弱
水溶液酸性
逐渐增强
还原性
逐渐增强
最高价氧化物
对应水化物
碱性
逐渐增强
酸性
逐渐减弱
变式训练3 下列说法中错误的是( )
A.钾的金属性比钠强
B.溴的非金属性比氯强
C.NaOH的碱性比LiOH强
D.HCl的热稳定性比HBr强
答案 B
解析 由于金属性K>Na>Li,故碱性KOH>NaOH>LiOH;非金属性Cl>Br,则其对应氢化物的热稳定性HCl>HBr。
1.关于碱金属元素的说法中正确的是( )
A.ⅠA族元素都是碱金属元素
B.碱金属单质可将铜从其盐溶液中置换出来
C.金属钾具有强还原性,K+具有强氧化性
D.Cs常温下与水反应会发生爆炸
答案 D
解析 ⅠA族元素还有氢元素,A
错;碱金属单质非常活泼,在水溶液中先与水反应生成强碱再与铜离子反应生成Cu(OH)2沉淀,而不能将铜置换出来,B错;由于钾原子的最外层只有1个电子,钾单质具有较强的还原性,但是其失去电子后形成的K+最外层已经达到8电子的稳定结构,其氧化性非常弱,C错;Cs是还原性比Li、Na、K、Rb都强的金属单质,与水反应会发生爆炸,D正确。
2.下列关于卤素的叙述正确的是( )
A.卤素是典型的非金属元素,因此不能与其他非金属元素化合
B.卤素单质越活泼,其熔、沸点就越高
C.卤素各单质都能与水剧烈反应
D.卤素的单质都能与氢气反应,且气态氢化物的稳定性随单质氧化性的增强而增强
答案 D
解析 卤素能与其他非金属化合,如H、C等;卤素单质越活泼,其相对分子质量越小,其熔、沸点越低;卤素单质中只有氟能与水剧烈反应。
3.已知锂及其化合物的许多性质与碱金属差异较大,却与镁相似。下列有关锂及其化合物的叙述不正确的是( )
A.碳酸锂受强热很难分解
B.碳酸锂的溶解度比碳酸氢锂的小
C.锂在过量氧气中燃烧,主要产物是氧化锂而不是过氧化锂
D.锂可以与氮气化合生成氮化锂(Li3N)
答案 A
解析 解题时充分利用题目信息,锂及其化合物的性质与镁的相似,MgCO3煅烧分解成MgO和CO2,由此可知,Li2CO3也易分解。
4.如图表示碱金属的某些性质与核电荷数的变化关系,则下列各性质中不符合图示关系的是( )
A.还原性
B.与水反应的剧烈程度
C.熔点
D.原子半径
答案 C
解析 由图可知,随着核电荷数的增大,碱金属的性质呈增大趋势,而碱金属单质的熔、沸点随核电荷数的增大而降低。
5.(1)向NaBr和KI的混合溶液中,通入足量的Cl2后,将溶液蒸干并灼烧,最后蒸发皿中剩余的物质是________,写出反应的化学方程式:_____________________________________。
(2)向KI溶液中滴入淀粉溶液,现象是______________,再滴入氯水,现象是______________;有关反应的离子方程式为_______________________________________________。
答案 (1)NaCl、KCl 2NaBr+Cl2===2NaCl+Br2,2KI+Cl2===2KCl+I2
(2)无明显变化 溶液变蓝色 Cl2+2I-===2Cl-+I2
6.(1)常见卤素氢化物中最不稳定的是__________(写化学式)。
(2)下列单质熔、沸点随原子序数递增而升高的是_____________________________________
(填字母,下同)。
A.碱金属元素 B.卤族元素
(3)下列反应中,更剧烈的是__________。
A.钠与水反应 B.钾与水反应
(4)取下列溶液分装两试管,再分别依次加入少量氯水和少量四氯化碳,用力振荡、静置后,四氯化碳层显紫红色的是__________。
A.溴化钠溶液 B.碘化钾溶液
答案 (1)HI (2)B (3)B (4)B
解析 卤素中碘元素的非金属性最弱,氢化物最不稳定的是HI;碱金属元素的单质熔、沸点随原子序数递增而降低,卤素单质熔、沸点随原子序数递增而升高;钾比钠活泼,与水反应更剧烈;氯水与NaBr、KI溶液分别生成Br2、I2,而二者的四氯化碳溶液分别为橙色、紫红色。
[基础过关]
题组1 碱金属元素性质的考查
1.下列对碱金属性质的叙述中,正确的是( )
①都是银白色的柔软金属(除铯外),密度都比较小 ②单质在空气中燃烧生成的都是过氧化物 ③碱金属单质都与水剧烈反应 ④单质的熔、沸点随着原子序数的增加而升高
A.①③ B.②④ C.①④ D.②③
答案 A
解析 除铯外,碱金属单质均为银白色金属,质软,有延展性,密度较小,①正确;碱金属单质在空气中燃烧时,产物不同,Li生成Li2O,Na生成Na2O2,K、Rb、Cs
则生成较复杂的氧化物,②错误;碱金属单质性质活泼,都能与水剧烈反应,③正确;碱金属单质的熔、沸点随着原子序数的增加而逐渐降低,④错误。
2.已知钡的金属活动性处于钾和钠之间。则下列变化中可能实现的是( )
A.钡可从氯化钠溶液中置换出金属钠
B.钡可从冷水中置换出氢气
C.钡可从硫酸铜溶液中置换出铜
D.在溶液中Ba2+可氧化金属锌,生成Zn2+
答案 B
解析 由于钡可以与水反应,所以钡和钠一样并不能置换出水溶液中的金属离子。
题组2 卤素性质的考查
3.卤素是最活泼的一族非金属,下列关于卤族元素的说法正确的是( )
A.卤素单质的最外层电子数都是7
B.从上到下,卤素原子的电子层数依次增多,半径依次减小
C.从F到I,原子核对最外层电子的吸引能力依次减弱,原子的得电子能力依次减弱
D.卤素单质与H2化合由易到难顺序为F2<Cl2<Br2<I2
答案 C
解析 卤素原子最外层有7个电子,而不是单质最外层有7个电子,A错误;卤素原子从F到I,电子层数依次增多,半径依次增大,原子核对最外层电子吸引能力依次减弱,原子得电子能力依次减弱,B错误,C正确;单质与H2化合由易到难顺序为F2>Cl2>Br2>I2,D错误。
4.下列关于卤族元素由上到下性质递变规律的叙述,正确的是( )
①单质的氧化性增强 ②单质的颜色加深 ③气态氢化物的稳定性增强 ④单质的沸点升高 ⑤阴离子的还原性增强
A.①②③ B.②③④ C.②④⑤ D.①③⑤
答案 C
解析 F2、Cl2、Br2、I2氧化性依次减弱,其对应的阴离子F-、Cl-、Br-、I-的还原性依次增强,故①叙述错误,⑤叙述正确;F2、Cl2、Br2、I2的颜色由淡黄绿色→黄绿色→深红棕色→紫黑色逐渐加深,②叙述正确;HF、HCl、HBr、HI的稳定性逐渐减弱,③叙述错误;F2、Cl2、Br2、I2在通常情况下其状态变化为气→液→固,则沸点逐渐升高,④叙述正确,C正确。
5.往碘化钾溶液中先加入氯水,再加入CCl4振荡,静置后出现分层,下层呈( )
A.橙红色 B.紫红色
C.无色 D.深褐色
答案 B
解析 碘化钾中加入氯水发生反应2KI+Cl2===2KCl+I2,加入CCl4后由于碘易溶于CCl4,
CCl4层(下层)呈现紫红色。
6.下列关于卤素(用X表示)的叙述正确的是( )
A.其单质都能与水反应,通式为X2+H2O===HX+HXO
B.HX易溶于水,其水溶液都是强酸
C.其单质都有颜色,都有毒
D.最高价含氧酸的通式为HXO4
答案 C
解析 本题考查卤素及有关化合物的基本知识规律,解答好本题,除掌握一般规律外,要注意F2及F的化合物的特殊性:①F2与水反应置换H2O中的O生成O2,不像其他卤素单质,②F是最强的非金属,在化合物中不表现正价,HF的溶液表现弱酸性。
7.若能发现第117号元素X,它的原子结构与卤族元素相似,电子排布有7个电子层,且最外层有7个电子。下列叙述中正确的是( )
A.此X元素的气态氢化物的化学式为HX,在常温下很稳定
B.其单质带有金属光泽,具有强氧化性,可与KI发生置换反应生成I2
C.其单质的分子式为X2,易溶于有机溶剂
D.AgX是一种有色的易溶于水的化合物
答案 C
解析 因为此X显-1价,所以X元素的气态氢化物的化学式为HX,但由于X的非金属性很弱,所以HX在常温下很不稳定,A错误;X单质氧化性比碘弱,不可与KI发生置换反应,B错误;类比Br2、I2等,C正确;类比AgCl、AgBr等,D错误。
题组3 卤素互化物的性质
8.溴化碘(IBr)的化学性质很像卤素的单质,它能与大多数金属、非金属化合生成卤化物,它也能与水发生以下反应:IBr+H2O===HBr+HIO。下列有关IBr的叙述中,不正确的是( )
A.在很多反应中IBr是强氧化剂
B.IBr与水反应时既作氧化剂,又作还原剂
C.IBr与AgNO3溶液反应会生成AgBr沉淀
D.IBr与NaOH溶液反应时,生成NaBr和NaIO
答案 B
解析 此题是一道信息题,题中给出了三点信息:①溴化碘(IBr)暗示Br呈-1价,I呈+1价;②IBr性质与卤素相似;③IBr与水反应生成HIO和HBr。由②可知,IBr是一种强氧化剂。分析IBr中各元素的化合价,确定碘为+1价,溴为-1价。再结合③,可知IBr与水的反应不是氧化还原反应,而是复分解反应。因此,A、C、D正确,B不正确。
题组4 位、构、性关系考查
9.已知元素aA、bB、cC、dD、eE的原子的结构示意图分别为
请回答下列问题:
(1)属于同周期的元素是__________(填元素符号,下同),属于同主族的元素__________。
(2)金属性最强的元素是__________,非金属性最强的元素是__________。
(3)上述元素中最高价氧化物对应的水化物碱性最强的是__________。
答案 (1)Na、Al、Cl F、Cl、Br (2)Na F (3)NaOH
解析 (1)弄清原子结构示意图与元素在周期表中的位置关系,即电子层数与周期数相等,所以A、B、C同周期。主族的族序数与最外层电子数相等,所以B、D、E同主族。(2)同周期从左到右金属性减弱,非金属性增强;同主族从上到下金属性增强,非金属性减弱。所以Na的金属性最强,F的非金属性最强。(3)金属性越强,最高价氧化物对应的水化物碱性越强。
10.下表为元素周期表的一部分。
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
一
①
二
②
③
④
⑤
⑥
三
⑦
⑧
⑨
⑩
四
⑪
⑫
⑬
(1)表中元素________的非金属性最强;元素________的金属性最强;元素________的单质室温下呈液态(填写元素符号)。
(2)表中元素⑦的原子结构示意图为_____________________________________________。
(3)表中元素⑥⑩氢化物的稳定性顺序为________>________(填写化学式,下同)。
(4)表中元素⑩和⑬最高价氧化物对应水化物的酸性:
________>________。
(5)表中元素②和⑦最高价氧化物对应水化物的碱性:________>________。
答案 (1)F K Br (2) (3)HF HCl (4)HClO4 HBrO4 (5)NaOH LiOH
[能力提升]
11.最新报道,我国科学家通过与多个国家进行科技合作,成功研发出铯(Cs)原子喷泉钟,使我国时间频率基准的精度从30万年不差1秒提高到600万年不差1秒,标志着我国时间频率基准研究进入世界先进行列。已知铯位于元素周期表中第六周期第ⅠA族,根据铯在元素周期表中的位置,推断下列内容:
(1)铯的原子核外共有________层电子,最外层电子数为________,铯的原子序数为
________。
(2)铯单质与水剧烈反应,放出________色气体,同时使紫色石蕊溶液显________色,因为________________________________________________________________________
________________________________________________________________________(写出化学方程式)。
(3)预测铯单质的还原性比钠单质的还原性________(填“弱”或“强”)。
答案 (1)6 1 55 (2)无 蓝 2Cs+2H2O===2CsOH+H2↑ (3)强
解析 根据原子核外电子排布规律,结合铯在元素周期表中的位置知:铯原子核外电子分六层排布,分别是2、8、18、18、8、1,原子序数是55,最外层只有1个电子。铯与钠同主族,具有极强的金属性。与水反应生成氢气和氢氧化铯:2Cs+2H2O===2CsOH+H2↑,氢氧化铯是强碱,使紫色石蕊溶液变蓝色。
12.常温下,KMnO4固体和浓盐酸反应产生氯气。为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是_________________________________________
________________________________________________________________________。
(2)B中溶液发生反应的离子方程式是_____________________________________________
________________________________________________________________________。
(3)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是
________________________________________________________________________。
(4)过程Ⅲ实验的目的是______________________________________________
________________________________________________________________________。
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,电子层数依次增多,________________________________________________________________________,
得电子能力逐渐减弱,非金属性逐渐减弱。
答案 (1)湿润的淀粉KI试纸变蓝
(2)Cl2+2Br-===Br2+2Cl-
(3)打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D震荡,静至后CCl4层溶液变为紫红色
(4)确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰
(5)原子半径逐渐增大
解析 装置A:高锰酸钾溶液和浓盐酸反应生成氯气,烧瓶上端湿润的淀粉KI试纸变蓝,验证氯气的氧化性强于碘;装置B:装置B中盛有溴化钠,氯气进入装置B中,氯气氧化溴离子为溴单质,溶液呈黄色,验证氯的氧化性强于溴,氯气有毒,能被氢氧化钠吸收,浸有氢氧化钠的棉花防止氯气污染空气;当B和C中的溶液都变为黄色时,夹紧弹簧夹,为验证溴的氧化性强于碘,实验时应避免氯气的干扰。当B中溶液由黄色变为红棕色时,说明有大量的溴生成,此时应关闭活塞a,否则氯气过量,影响实验结论。
[拓展探究]
13.某学生在做元素性质与原子结构关系的实验时,设计了一套实验方案,并记录了有关的实验现象。请帮助该学生整理并完成实验报告。
(1)实验目的
探究同一主族元素性质的递变规律。
(2)实验用品
仪器:试管、胶头滴管
药品:新制氯水、新制溴水、溴化钠溶液、碘化钠溶液、四氯化碳
(3)实验内容(在下表横线中填写相关内容)
序号
实验方案
实验现象
①
向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置
液体分为两层,下层呈________色
②
向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置
液体分为两层,下层呈________色
(4)实验结论:________________________________________________________。
(5)问题和讨论
①上述两个实验中发生反应的离子方程式分别为_____________________________、
________________________________________________________________________。
②由于氟单质过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举两项事实说明氟的非金属性比氯的强:______________、________________。
答案 (3)①橙红 ②紫红
(4)同主族元素从上到下,元素原子的得电子能力逐渐减弱
(5)①Cl2+2Br-===Br2+2Cl- 2I-+Br2===2Br-+I2
②HF的稳定性比HCl的强 F2能置换出水中的氧,而Cl2不能置换出水中的氧(其他合理答案也可)
解析 向溴化钠溶液中加入新制氯水,发生反应:Cl2+2Br-===Br2+2Cl-,证明氧化性:Cl2>Br2;再加入四氯化碳后,振荡静置,溶液分层,上层近无色,下层呈橙红色。向碘化钠溶液中加入新制溴水,发生反应:Br2+2I-===I2+2Br-,证明氧化性:Br2>I2;再加入四氯化碳后,振荡静置,溶液分层,上层近无色,下层呈紫红色。两个实验说明:同主族元素从上到下,元素原子的得电子能力逐渐减弱。
相关文档
- 2020届高考化学一轮复习化学反应与2021-07-0612页
- 2021届高考化学一轮复习化学键学案2021-07-067页
- 2021届高考化学一轮复习化学反应速2021-07-065页
- 2020届高考化学一轮复习化学反应与2021-07-068页
- 2020届高考化学一轮复习化学物质及2021-07-069页
- 2021届高考化学一轮复习化学反应速2021-07-0516页
- 2020届高考化学一轮复习化学实验方2021-07-0516页
- 2020届高考化学一轮复习化学平衡作2021-07-0511页
- 2020届高考化学一轮复习化学计量在2021-07-059页
- 2020届高考化学一轮复习化学反应中2021-07-0517页