- 705.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第20讲 盖斯定律及反应热的计算
1.利用盖斯定律计算反应热
(1)盖斯定律的内容
不论化学反应是一步完成还是分几步完成,其反应热是相同的。即化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
(2)特点
①反应的热效应只与始态、终态有关,与途径无关。
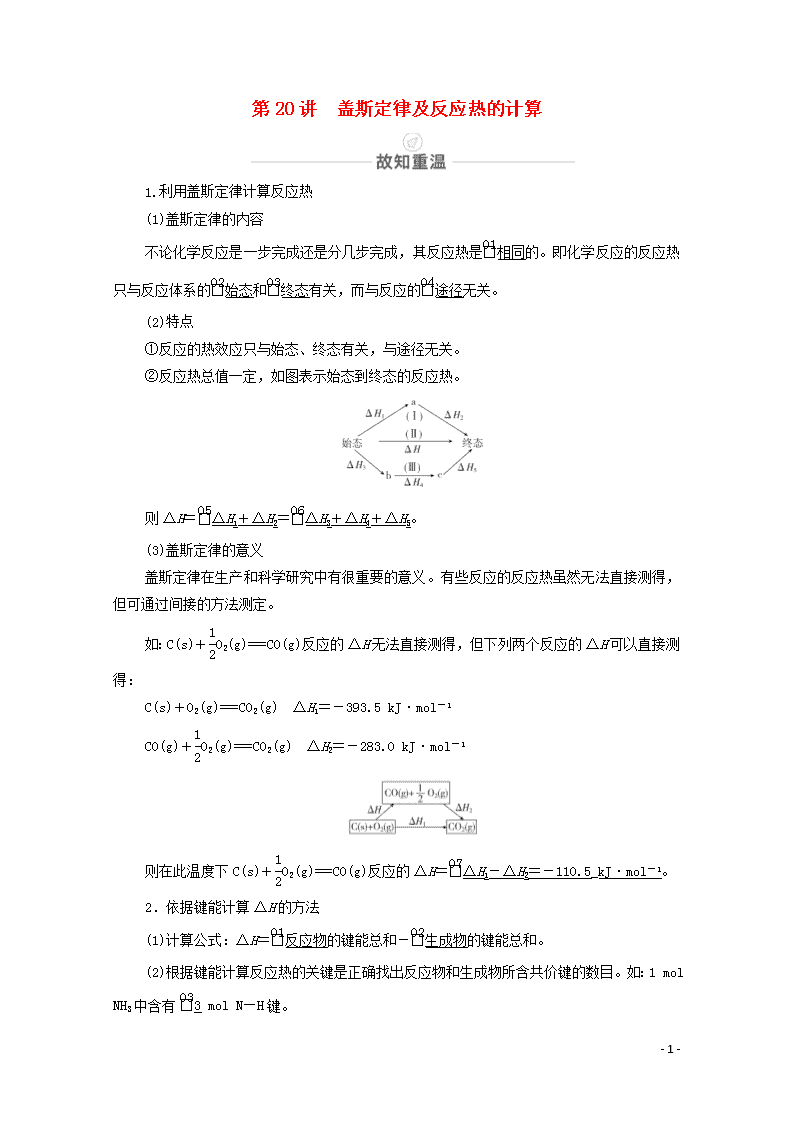
②反应热总值一定,如图表示始态到终态的反应热。
则ΔH=ΔH1+ΔH2=ΔH3+ΔH4+ΔH5。
(3)盖斯定律的意义
盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。
如:C(s)+O2(g)===CO(g)反应的ΔH无法直接测得,但下列两个反应的ΔH可以直接测得:
C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
CO(g)+O2(g)===CO2(g) ΔH2=-283.0 kJ·mol-1
则在此温度下C(s)+O2(g)===CO(g)反应的ΔH=ΔH1-ΔH2=-110.5_kJ·mol-1。
2.依据键能计算ΔH的方法
(1)计算公式:ΔH=反应物的键能总和-生成物的键能总和。
(2)根据键能计算反应热的关键是正确找出反应物和生成物所含共价键的数目。如:1 mol NH3中含有3 mol N—H键。
- 14 -
1.判断正误,正确的画“√”,错误的画“×”,并指明错因。
(1)C(石墨,s)===C(金刚石,s) ΔH>0,说明石墨不如金刚石稳定。(×)
错因:能量越低越稳定,即石墨比金刚石稳定。
(2)已知:500 ℃、30 MPa下,N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ。(×)
错因:此反应是可逆反应,不能进行完全,1.5_mol_H2不能完全转化为NH3,放出的热量小于46.2_kJ。
(3)已知相同条件下2SO2(g)+O2(g)2SO3(g) ΔH1,反应2SO2(s)+O2(g)2SO3(g) ΔH2,则ΔH1>ΔH2。(×)
错因:ΔH越小,放出的热量越多,固态SO2转化为SO3(g)时放出的热量应小于气态SO2转化为SO3(g)放出的热量,即ΔH1<ΔH2。
(4)H2(g)+O2(g)===H2O(l) ΔH1和2H2(g)+O2(g)===2H2O(l) ΔH2中的ΔH1=ΔH2。(×)
错因:ΔH的数值与方程式中的分子式前面的系数成正比,即ΔH2=2ΔH1。
2.教材改编题
(据人教选修四P14T6)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25 ℃、101 kPa时:4Fe(s)+3O2(g)===2Fe2O3(s)
ΔH=-1648 kJ·mol-1 ①
C(s)+O2(g)===CO2(g)
ΔH=-393 kJ·mol-1 ②
2Fe(s)+2C(s)+3O2(g)===2FeCO3(s)
ΔH=-1480 kJ·mol-1 ③
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是____________________________________________。
答案 4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g)ΔH=-260 kJ·mol-1
考点一 盖斯定律及应用
- 14 -
[解析] 根据盖斯定律,反应①+②可得反应③,则ΔH3=ΔH1+ΔH2=100.3 kJ•mol-1+(-11.0 kJ·mol-1)=89.3 kJ·mol-1。
[答案] +89.3
利用盖斯定律计算反应热的一般步骤
1.在298 K、101 kPa时,已知:
①2H2O(g)===O2(g)+2H2(g) ΔH1
②Cl2(g)+H2===2HCl(g) ΔH2
③2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
答案 A
解析 根据盖斯定律,由①+②×2可以得到③,故ΔH1+2ΔH2=ΔH3,A正确。
2.(2019·长春外国语学校高三期末)氧化还原法消除NOx的转化如下:NONO2N2
已知:NO(g)+O3(g)===NO2(g)+O2(g)
ΔH=-200.9 kJ·mol-1
2NO(g)+O2(g)===2NO2(g)
ΔH=-116.2 kJ·mol-1
- 14 -
则反应Ⅰ的热化学方程式为__________________________________________________________。
答案 3NO(g)+O3(g)===3NO2(g)ΔH=-317.1 kJ·mol-1
解析 根据盖斯定律,目标反应等于①+②,所以反应Ⅰ的热化学方程式为3NO(g)+O3(g)===3NO2(g) ΔH=-317.1 kJ·mol-1。
- 14 -
考点二 根据键能计算反应热
[解析] 化学反应的焓变应该等于反应物键能减去生成物的键能,所以焓变为(4×413+2×745) kJ·mol-1-(2×1075+2×436) kJ·mol-1=+120 kJ·mol-1。
[答案] +120 kJ·mol-1
熟悉常见物质中化学键的数目
1 mol
物质
CO2
(C===O)
CH4
(C—H)
P4
(P—P)
SiO2
(Si—O)
石墨
(C—C)
金刚石
(C—C)
Si
(Si—Si)
化学键数
2NA
4NA
6NA
4NA
1.5NA
2NA
2NA
3.(2019·山西大学附中模拟)根据键能数据估算CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热ΔH为( )
化学键
C—H
C—F
H—F
F—F
键能/(kJ·mol-1)
414
489
565
155
A.-485 kJ·mol-1 B.+485 kJ·mol-1
C.+1940 kJ·mol-1 D.-1940 kJ·mol-1
答案 D
解析 ΔH=反应物的键能总和-生成物的键能总和=414 kJ·mol-1×4+155 kJ·mol-1×4-489 kJ·mol-1×4-565 kJ·mol-1×4=-1940 kJ·mol-1。
4.已知:C(s)+H2O(g)===CO(g)+H2(g)
ΔH=a kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-220 kJ·mol-1
H—H、O===O和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为( )
A.-332 B.-118
C.+350 D.+130
答案 D
- 14 -
解析 根据盖斯定律,由题给的两个热化学方程式可得:2H2O(g)===2H2(g)+O2(g) ΔH=+(2a+220) kJ·mol-1,则有:4×462 kJ·mol-1-2×436 kJ·mol-1-496 kJ·mol-1=(2a+220) kJ·mol-1,解得a=+130,故选项D正确。
考点三 反应热大小的比较
[解析] 1 mol CuSO4·5H2O(s)溶于水会使溶液温度降低,为吸热反应,故ΔH1>0,1 mol CuSO4(s)溶于水会使溶液温度升高,为放热反应,故ΔH2<0,1 mol CuSO4·5H2O(s)溶于水可以分为两个过程,先分解成1 mol CuSO4(s)和5 mol水,然后1 mol CuSO4(s)再溶于水,CuSO4·5H2O的分解为吸热反应,即ΔH3>0,根据盖斯定律得到关系式ΔH1=ΔH2+ΔH3,分析得到答案:ΔH1<ΔH3。
[答案] B
比较反应热大小的注意要点
1.反应物和生成物的状态
物质的气、液、固三态的变化与反应热关系:
2.ΔH的符号:比较反应热大小时不要只比较ΔH数值的大小,还要考虑其符号。
3.化学计量数:当反应物和生成物的状态相同时,化学计量数越大,放热反应的ΔH越小,吸热反应的ΔH越大。
4.根据反应物的本性比较
等物质的量的不同物质与同一种物质反应时,性质不同其反应热不同,一般情况,等物质的量的不同金属或非金属与同一物质发生反应,金属或非金属越活泼,反应就越容易,放出的热量就越多,ΔH越小。
如:(1)2K(s)+2H2O(l)===2KOH(aq)+H2(g) ΔH1
2Na(s)+2H2O(l)===2NaOH(aq)+H2(g) ΔH2
ΔH1<ΔH2
(2)H2(g)+Cl2(g)===2HCl(g) ΔH3
H2(g)+Br2(g)===2HBr(g) ΔH4
- 14 -
ΔH3<ΔH4
5.对于燃烧反应,燃烧越充分放出的热量就越多,ΔH越小。
如:2C(s)+O2(g)===2CO(g) ΔH1
2C(s)+2O2(g)===2CO2(g) ΔH2
ΔH1>ΔH2
6.对于可逆反应,若正反应为放热反应,反应正向进行的程度越大,则反应放出的热量就越多,若正反应为吸热反应,反应程度越大,则反应吸收的热量就越多。
7.正确理解可逆反应的反应热(ΔH),如:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1中的92.4 kJ是1 mol N2(g)与3 mol H2(g)完全反应生成2 mol NH3(g)时放出的热量。
5.下列各组变化中,反应热前者小于后者的有( )
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1;
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH2;
②2H2(g)+O2(g)===2H2O(l) ΔH1;
H2(g)+O2(g)===H2O(l) ΔH2;
③CaCO3(s)===CaO(s)+CO2(g) ΔH1;
CaO(s)+H2O(l)===Ca(OH)2(s) ΔH2。
A.①②③ B.①②
C.①③ D.②③
答案 B
解析 ①中ΔH1和ΔH2均小于零,由于H2O(l)===H2O(g)吸收能量,故|ΔH1|>|ΔH2|,因此ΔH1<ΔH2。②中ΔH1=2ΔH2,又ΔH1、ΔH2均小于零,所以ΔH1<ΔH2。③中ΔH1>0,ΔH2<0,所以ΔH1>ΔH2。故选B。
6.已知下列四个热化学方程式(ΔH的单位均为kJ/mol):
NH4Cl(s)===NH3(g)+HCl(g) ΔH1=a(ⅰ)
Ba(OH)2·8H2O(s)===BaO(s)+9H2O(l) ΔH2=b(ⅱ)
2NH4Cl(s)+Ba(OH)2·8H2O(s)===BaCl2(aq)+2NH3(g)+10H2O(l) ΔH3=c(ⅲ)
BaO(s)+2HCl(aq)===BaCl2(aq)+H2O(l) ΔH4=d(ⅳ)
其中a、b、c均大于0,HCl气体溶解于水,溶液温度升高。由此可知下列判断一定正确的是( )
A.d<0 B.c<2a+b+d
C.c=2a+b+d D.c>2a+b+d
- 14 -
答案 B
解析 通过给出的信息无法判断反应(ⅳ)是放热反应还是吸热反应,A错误;根据题目提示信息可得:HCl(g)===HCl(aq) ΔH5=e<0,由盖斯定律可确定c=2a+b+d+2e,故c-(2a+b+d)<0,即c<2a+b+d,B正确,C、D错误。
建议用时:40分钟 满分:100分
一、选择题(每题7分,共70分)
1.下列依据热化学方程式得出的结论正确的是( )
A.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量
B.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
C.已知2C(s)+2O2(g)===2CO2(g) ΔH=a
2C(s)+O2(g)===2CO(g) ΔH=b,则a>b
D.已知P(白磷,s)===P(红磷,s) ΔH<0,则白磷比红磷稳定
答案 A
解析 稀的强酸和强碱溶液发生中和反应生成1 mol水时所放出的热量为57.3 kJ,醋酸是弱酸,其电离过程是吸热过程,40.0 g即1 mol NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量,故A正确;氢气的燃烧热必须是生成液态水的过程所放出的热量,故B错误;焦炭完全燃烧放出的热量高于不完全燃烧放出的热量,焓变是负值,即a<b,故C错误;P(白磷,s)===P(红磷,s) ΔH<0,所以红磷的能量低于白磷的能量,所以白磷不如红磷稳定,故D错误。
2.已知强酸与强碱的稀溶液发生中和反应的热化学方程式为H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,又知电解质的电离是吸热过程。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应。其焓变ΔH1、ΔH2、ΔH3的关系是( )
A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH3<ΔH2
C.ΔH1=ΔH3>ΔH2 D.ΔH1>ΔH3>ΔH2
答案 D
解析 因为醋酸是弱电解质,电离时吸热,浓硫酸溶于水时放热,故中和反应时放出的热量Q(浓硫酸)>Q(稀硝酸)>Q(稀醋酸),又因放热反应中,ΔH为负值,即ΔH=-Q,故ΔH2<ΔH3<ΔH1。
- 14 -
3.(2019·北京海淀高三期末)以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
相关反应的热化学方程式为:
反应Ⅰ:SO2(g)+I2(g)+2H2O(l)===2HI(aq)+H2SO4(aq) ΔH1=-213 kJ·mol-1
反应Ⅱ:H2SO4(aq)===SO2(g)+H2O(l)+O2(g)ΔH2=+327 kJ·mol-1
反应Ⅲ:2HI(aq)===H2(g)+I2(g)ΔH3=+172 kJ·mol-1
下列说法不正确的是( )
A.该过程实现了太阳能到化学能的转化
B.SO2和I2对总反应起到了催化剂的作用
C.总反应的热化学方程式为:2H2O(l)===2H2(g)+O2(g) ΔH=+286 kJ·mol-1
D.该过程降低了水分解制氢反应的活化能,但总反应的ΔH不变
答案 C
解析 反应Ⅰ+反应Ⅱ+反应Ⅲ,得到H2O(l)===H2(g)+O2(g) ΔH=(-213+327+172) kJ·mol-1=+286 kJ·mol-1,故C错误。
4.由金红石TiO2制取单质Ti,涉及的步骤为TiO2―→TiCl4Ti。已知:
①C(s)+O2(g)===CO2(g) ΔH1
②2CO(g)+O2(g)===2CO2(g) ΔH2
③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH3
则反应TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的ΔH为( )
A.ΔH3+2ΔH1-2ΔH2 B.ΔH3+ΔH1-ΔH2
C.ΔH3+2ΔH1-ΔH2 D.ΔH3+ΔH1-2ΔH2
答案 C
解析 根据盖斯定律,由2×①-②+③,可得TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g) ΔH=2ΔH1-ΔH2+ΔH3,故C正确。
5.已知:
①H2(g)+O2(g)===H2O(g) ΔH1=a kJ·mol-1
②2H2(g)+O2(g)===2H2O(g) ΔH2=b kJ·mol-1
③H2(g)+O2(g)===H2O(l) ΔH3=c kJ·mol-1
- 14 -
④2H2(g)+O2(g)===2H2O(l) ΔH4=d kJ·mol-1
下列关系式中正确的是( )
A.ad>0
C.2a=b<0 D.2c=d>0
答案 C
解析 氢气燃烧为放热反应,ΔH<0,气态水液化放出热量,故生成液态水放出的热量多,但ΔH小,故c0 B.ΔH5<0 ΔH4<ΔH3
C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5
答案 B
解析 将题给的5个热化学方程式依次编号为①、②、③、④、⑤,其中①、③分别表示H2、Fe燃烧的热化学方程式,燃烧均为放热反应,则ΔH1<0,ΔH3
- 14 -
<0,故A错误;铝热反应为放热反应,故ΔH5<0;根据盖斯定律,由④-③可得:2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s) ΔH5=ΔH4-ΔH3<0,则ΔH4<ΔH3,故B正确;根据盖斯定律,由(②+③)×可得:2H2(g)+O2(g)===2H2O(g) ΔH1=(ΔH2+ΔH3),故C错误;ΔH5=ΔH4-ΔH3,则ΔH3=ΔH4-ΔH5,故D错误。
10.用H2可将工业废气中的NO催化还原成N2,其能量转化关系如下所示,则NO(g)+H2(g)===N2(g)+H2O(g)的ΔH为( )
A.0.5(a+b-c-d) kJ·mol-1
B.0.5(c+a-d-b) kJ·mol-1
C.0.5(c+d-a-b) kJ·mol-1
D.0.5(b+d-a-c) kJ·mol-1
答案 A
解析 根据题图知,NO中键能为0.5a kJ·mol-1,N2中键能为c kJ·mol-1,H2中键能为0.5b kJ·mol-1,H—O的键能为0.25d kJ·mol-1,故该反应中ΔH=0.5a kJ·mol-1+0.5b kJ·mol-1-=0.5(a+b-c-d) kJ·mol-1。
二、非选择题(共30分)
11.(13分)(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。
请写出NO2和CO反应的热化学方程式:
________________________________________________________________________。
- 14 -
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g)ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g)===CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸气燃烧为液态水的热化学方程式为
________________________________________________________________________。
答案 (1)减小 不变 NO2(g)+CO(g)===CO2(g)+NO(g)ΔH=-234 kJ·mol-1
(2)CH3OH(g)+O2(g)===CO2(g)+2H2O(l)ΔH=-764.7 kJ·mol-1
解析 (1)观察图,E1应为正反应的活化能,加入催化剂反应的活化能降低,但是ΔH不变;由题图可知该反应为放热反应,1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)的反应热数值即反应物和生成物的能量差,因此该反应的热化学方程式为NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ·mol-1。
(2)观察方程式,利用盖斯定律,将所给热化学方程式如下运算:②×3-①×2+③×2,即可得出甲醇蒸气燃烧的热化学方程式。
12.(17分)(1)(2019·河南南阳市高三期末质量评估)铁及其化合物在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。利用铁的氧化物循环裂解水制氢气的过程如下图所示。整个过程与温度密切相关,当温度低于570 ℃时,发生反应Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g),阻碍循环反应的进行。
已知:(ⅰ)Fe3O4(s)+CO(g)3FeO(s)+CO2(g)
ΔH1=+19.3 kJ·mol-1
(ⅱ)3FeO(s)+H2O(g)Fe3O4(s)+H2(g)
ΔH2=-57.2 kJ·mol-1
(ⅲ)C(s)+CO2(g)2CO(g)
ΔH3=+172.4 kJ·mol-1
铁氧化物循环裂解水制氢气总反应的热化学方程式是________________________________________。
(2)(2019·湖北八校高三联考)标准摩尔生成焓是指在25 ℃和101 kPa,最稳定的单质生成1 mol化合物的焓变。已知25 ℃和101 kPa时存在:
①2C2H6(g)+7O2(g)===4CO2(g)+6H2O(l)ΔH=-3116 kJ·mol-1
②C(石墨,s)+O2(g)===CO2(g)ΔH=-393.5 kJ·mol-1
- 14 -
③2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1
写出表示乙烷标准摩尔生成焓的热化学方程式:
________________________________________________________________________。
(3)(2019·北京师大附中高三期中)某温度时,ⅥA元素单质与H2反应生成气态H2X的热化学方程式如下:
O2(g)+H2(g)===H2O(g)ΔH=-242 kJ·mol-1
S(g)+H2(g)===H2S(g) ΔH=-20 kJ·mol-1
Se(g)+H2(g)H2Se(g) ΔH=+81 kJ·mol-1
下列说法正确的是( )
A.稳定性:H2OH2S>H2Se,故A错误;Se(g)+H2(g)H2Se(g)对应的ΔH>0,说明该反应正向吸热,降温使得反应向放热的方向移动,即逆向移动,不利于生成H2Se,故B错误;将已知热化学方程式依次编号为①、②、③,根据盖斯定律,由2×(①-②)可得:O2(g)+2H2S(g)===2H2O(g)+2S(g) ΔH=-444 kJ·mol-1,故C正确;随着核电荷数的减小,ⅥA族元素的非金属性逐渐增强,与氢原子形成的共价键越强,放出的热量越多,生成物越稳定,ⅥA族元素的单质与H2的化合反应越容易发生,故D错误。
- 14 -
相关文档
- 2017-2018学年黑龙江省大庆铁人中2021-07-069页
- 2018-2019学年湖北省沙市中学高二2021-07-0611页
- 【化学】新疆吾尔自治区哈密市第十2021-07-0614页
- 山东省泰安市宁阳一中2018-2019学2021-07-068页
- 2020-2021学年浙江省高考化学模拟2021-07-0624页
- 2018届一轮复习人教版化学计量在实2021-07-0616页
- 宁夏石嘴山三中2019-2020学年高一2021-07-0611页
- 2019届二轮复习金属的电化学腐蚀与2021-07-068页
- 2018-2019学年湖南省湘潭县一中、2021-07-0624页
- 河南省商丘市第一高级中学2019-2022021-07-067页