- 712.97 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
漳州市2020届高三毕业班第一次教学质量检测卷
化学
注意事项:
1.本试题卷共8页,满分100分,考试时间90分钟。
2.答题前,考生务必将自己的姓名、准考证号等填写在答题卡的相应位置。
3.全部答案在答题卡上完成,答在本试题卷上无效。
4.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。
5.考试结束后,将本试题卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 Mn-55
一、选择题(本题共14小题,每小题3分,共42分)
1.化学与生活密切相关。下列叙述不正确的是( )
A. “信口雌黄”中的雌黄因与纸张颜色相近被称为古代的“修正带”,它的修正原理不涉及化学变化
B. “乌桕,实如鸡头,液如猪脂,可压油为烛”,古代的蜡烛成分为烃
C. 珍珠奶茶中的“珍珠”是由淀粉制成,淀粉属于糖类
D. 硅胶(主要成分为SiO2·nH2O)对水分子具有极强的吸附性,可以用作袋装食品的干燥剂
【答案】B
【解析】
【详解】A.雌黄的修正原理利用的是与纸张颜色相近这一点,颜色属于物理性质,修正过程不涉及化学变化,A正确;
B.乌桕种子有一层蜡质表皮,是制蜡的上品,桕子榨油,混入融化的白蜡,倒进模具内,凝结后便是桕烛,古代的蜡烛不属于烃,B错误;
C.淀粉属于糖类,是一种多糖,C正确;
D.硅胶对水分子具有极强的吸附性,对人体无毒无害,是常用的袋装食品干燥剂,D正确;
答案选B。
2.下列化学用语正确的是( )
A. 质子数为7、中子数为8的氮原子:N B. 甲烷的球棍模型
- 21 -
C. 苯的结构式:C6H6 D. 氯化铵的电子式:
【答案】A
【解析】
【详解】A.氮原子的质量数为15,表示为N,A正确;
B. 是甲烷的比例模型,B错误;
C. C6H6是苯的分子式,C错误;
D. 中氯离子的电子式书写错误,正确的为,D错误;
答案选A。
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,2.24L苯在氧气中完全燃烧,得到0.6NA个CO2分子
B. 1.6gCD4中所含质子数为NA
C. 1mol·L-1氯化铜溶液中的Cl-数为2NA
D. 32g由氧气和臭氧组成的混合物中含有氧原子的数目为2NA
【答案】D
【解析】
【详解】A. 标准状况下,苯为液体,2.24L苯不是0.1mol,A错误;
B. CD4摩尔质量是20g/mol,1.6g CD4物质的量是0.08mol,质子的物质的量为0.8mol,所含质子数为0.8mol NA,B错误;
C溶液体积不知道,无法求Cl-数,C错误;
D.氧气和臭氧组成的混合物中含有氧原子共32g,氧原子的物质的量为2mol,数目为2NA,D正确;
答案选D。
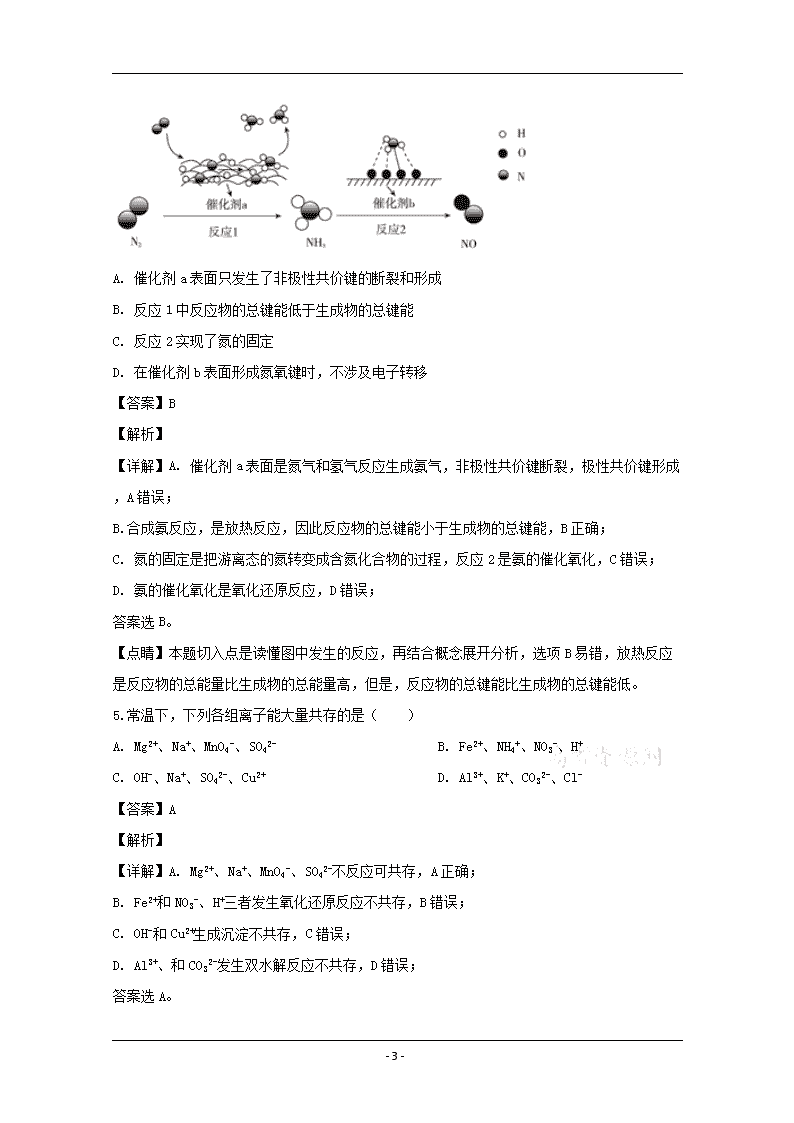
4.氮及其化合物的转化过程如图所示,下列分析正确的是( )
- 21 -
A. 催化剂a表面只发生了非极性共价键的断裂和形成
B. 反应1中反应物的总键能低于生成物的总键能
C. 反应2实现了氮的固定
D. 在催化剂b表面形成氮氧键时,不涉及电子转移
【答案】B
【解析】
【详解】A. 催化剂a表面是氮气和氢气反应生成氨气,非极性共价键断裂,极性共价键形成,A错误;
B.合成氨反应,是放热反应,因此反应物的总键能小于生成物的总键能,B正确;
C. 氮的固定是把游离态的氮转变成含氮化合物的过程,反应2是氨的催化氧化,C错误;
D. 氨的催化氧化是氧化还原反应,D错误;
答案选B。
【点睛】本题切入点是读懂图中发生的反应,再结合概念展开分析,选项B易错,放热反应是反应物的总能量比生成物的总能量高,但是,反应物的总键能比生成物的总键能低。
5.常温下,下列各组离子能大量共存的是( )
A. Mg2+、Na+、MnO4-、SO42- B. Fe2+、NH4+、NO3-、H+
C. OH-、Na+、SO42-、Cu2+ D. Al3+、K+、CO32-、Cl-
【答案】A
【解析】
【详解】A. Mg2+、Na+、MnO4-、SO42-不反应可共存,A正确;
B. Fe2+和NO3-、H+三者发生氧化还原反应不共存,B错误;
C. OH-和Cu2+生成沉淀不共存,C错误;
D. Al3+、和CO32-发生双水解反应不共存,D错误;
答案选A。
- 21 -
【点睛】B容易错选,因为Fe2+ 、NO3-和H+三者发生的氧化还原反应比较隐蔽,同学要多熟悉溶液中具有强氧化性、强还原性的离子,也要注意溶液酸碱性对反应的影响,例如S2-、SO32-、和H+不能共存,但是S2-、SO32-、和OH-能共存。
6.下列离子方程式书写正确的( )
A. Al(OH)3沉淀溶于NaOH溶液:Al3++4OH-=AlO2-+2H2O
B. 在酸性溶液中KBrO3与KBr反应:5Br-+BrO3-+3H2O=3Br2+6OH-
C. 向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-=H2O+BaSO4↓
D. 溴化亚铁溶液中通入足量的氯气:3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2
【答案】D
【解析】
【详解】A. Al(OH)3是沉淀,不能拆写,A错误;
B. 在酸性溶液中不会生成大量OH-,应为5Br-+BrO3-+6H+=3Br2+3H2O,B错误;
C. OH-、H+以及H2O的化学计量数应该均为2,C错误;
D. 由于通入足量的氯气,溴化亚铁溶液中Fe2+和Br-按物质的量之比为1:2的比例被完全氧化,D正确;
答案选D。
【点睛】C容易出错为Ba2++OH-+H++SO42-=H2O+BaSO4↓原因,是没有考虑滴入的稀硫酸中H+与SO42-物质的量之比为2:1,两个离子均被Ba(OH)2溶液中Ba2+和OH-完全反应,正确的离子方程式Ba2++2OH-+2H++SO42-=2H2O+BaSO4↓中则体现了这一点。
7.指甲花中的β-紫罗兰酮属于一种萜类化合物,可作为合成维生素A的原料,其结构如图所示。下列有关β-紫罗兰酮的说法正确的是( )
A. β-紫罗兰酮的分子式为C13H18O B. 分子中所有碳原子可能处于同一平面
C. 与足量的H2反应后,分子中只含1种官能团 D. 不能被酸性KMnO4溶液氧化
【答案】C
【解析】
【详解】A. 分子式应为C13H20O,A错误;
- 21 -
B. 环上有一个碳原子连着2个甲基,所以分子中所有碳原子不可能处于同一平面,B错误;
C. 分子中碳碳双键与氢气加成,变为饱和键,分子中羰基与足量的H2反应后,有羟基生成,C正确;
D. 分子中所含碳碳双键,能被酸性KMnO4溶液氧化,D错误;
答案选C。
8.已知:三氧化硫的沸点为45℃,熔点为16.8℃,具有很强的氧化性和挥发性。如图是快速制备三氧化硫的实验装置图,其中装置Ⅰ和Ⅲ中都加入了金属铜,下列说法不正确的是( )
A. 装置Ⅰ和Ⅲ都需要加热
B. 本实验制备三氧化硫(SO3)的原理为NO2+SO2=NO+SO3
C. 连接反应器与尾气处理装置不宜使用橡胶管
D. 实验结束后,往反应器中滴加水,瓶内红棕色逐渐褪去
【答案】A
【解析】
【详解】A. 装置Ⅰ内铜和浓硝酸反应制NO2不需要加热,Ⅲ内铜和浓硫酸反应制SO2需要加热,A错误;
B. 装置Ⅱ内SO2被NO2氧化为SO3,制备三氧化硫(SO3)的原理为NO2+SO2=NO+SO3,B正确;
C. NO2、SO3具强氧化性,会腐蚀橡胶管,C正确;
D. 水会和红棕色NO2反应得到硝酸和NO而褪色,D正确;
答案选A。
9.下列关于化学反应与能量的说法正确的是( )
A. 已知正丁烷的燃烧热为2878kJ·mol-1,则表示正丁烷燃烧热的热化学方程式为2CH3CH2CH2CH3(g)+13O2(g)=8CO2(g)+10H2O(l) ΔH=-2878kJ·mol-1
B. 已知在一定条件下,2molSO2与1molO2充分反应后,释放出98kJ的热量,则其热化学方程式为2SO2(g)+O2(g)2SO3(g) ΔH=-98kJ·mol-1
- 21 -
C. 已知稀盐酸与稀NaOH溶液反应的中和热为57.3kJ·mol-1,则表示稀硫酸与稀NaOH溶液反应的热化学方程式为H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+H2O(l) ΔH=-57.3kJ·mol-1
D. 已知CuSO4(s)+5H2O(l)=CuSO4·5H2O(s),该反应为熵增加的反应
【答案】C
【解析】
【详解】A. 燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,则表示正丁烷燃烧热的热化学方程式为CH3CH2CH2CH3(g)+O2(g)=4CO2(g)+5H2O(l) ΔH=-1439kJ·mol-1,A错误;
B. 不知道该条件下物质的状态,该反应是可逆反应,2molSO2与1molO2充分反应后,实际消耗多少不得而知,所以无法写出热化学方程式,B错误;
C. 在稀溶液中酸和碱发生中和反应生成1molH2O放出的热量是中和热,C正确;
D. 从液态H2O到固态CuSO4·5H2O,且物质的量减少,该反应熵减,D错误;
答案为C。
【点睛】B容易出错, 2SO2(g)+O2(g)2SO3(g) ΔH=-98kJ·mol-1,这样的可逆反应,代表的是实际消耗2molSO2(g)和1molO2(g)生成2molSO3(g)时,放热98kJ。
10.W、X、Y、Z为原子序数依次递增的短周期主族元素,其中X的某同位素可用于测量文物年代,M为由X元素构成的一种单质。甲和丁两种物质都由W和Y元素组成,乙由Y和Z元素组成,常温下为气体,具有漂白性,戊为二元强酸。它们之间的转化关系如下,下列叙述正确的是( )
A. 气态氢化物的稳定性:X>Y>Z B. 原子半径顺序:Z>Y>X>W
C. 丁的水溶液适用于医用伤口消毒及环境消毒 D. 常温常压下,M能和丙发生化合反应
【答案】C
【解析】
【分析】
据题意可推断:W为H、X为C、Y为O、Z为S,甲和丁两种物质分别为H2O,H2O2,乙为SO2,丙为CO2,戊为二元强酸H2SO4;
- 21 -
【详解】A. 非金属性:O> C,所以气态氢化物的稳定性:H2O>CH4,A错误;
B. 同一周期,从左到右,原子半径减小,故原子半径顺序:C>O,B错误;
C. H2O2水溶液因为强氧化性可杀菌消毒,且还原产物是H2O适用于医用伤口消毒,C正确;
D. 常温常压下,碳的单质与CO2不反应,高温下才反应,D错误;
答案选C。
11.下列实验操作、现象、结论或解释均正确的是( )
选项
实验操作
实验现象
结论或解释
A
向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无NH4+
B
往加有酚酞的碳酸钠溶液中加入足量的CaCl2溶液
产生白色沉淀,红色褪去
证明CO32-水解呈碱性
C
向NaOH溶液中滴加足量的MgCl2溶液,然后再滴加CuCl2溶液
先产生白色沉淀,然后沉淀变蓝色
Ksp[Cu(OH)2]>Ksp[Mg(OH)2]
D
用硫酸作催化剂的淀粉水解液中,加入新制Cu(OH)2悬浊液,加热
无砖红色沉淀生成
淀粉未发生水解
A. A B. B C. C D. D
【答案】B
【解析】
【详解】A. 滴加的是稀NaOH溶液且没有加热,难于产生氨气,难以判断原溶液中无NH4+,A错误;
B. 加有酚酞的碳酸钠溶液呈红色,红色溶液中加入足量的CaCl2溶液,钙离子把碳酸根离子沉淀完全的同时,红色也褪去,证明原溶液的碱性是CO32-水解所致,B正确;
C. 溶解度小的沉淀易向溶解度更小的沉淀转化,得出的结论应是Ksp[Cu(OH)2]<Ksp[Mg(OH)2],C错误;
D. 淀粉水解液中含硫酸,未加碱中和直接加入新制Cu(OH)2悬浊液,导致Cu(OH)2
- 21 -
被消耗,达不到预期现象,D错误;
答案选B。
【点睛】D容易错,淀粉水解一般在稀硫酸催化下进行,检测还原性糖的生成,应该选碱性环境,先在水解液中加过量NaOH溶液,再加新制的Cu(OH)2悬浊液,加热;而检测淀粉有没有水解完全?应该直接在水解液中加碘水,观察是否变成特殊的蓝色,若变蓝,则证明淀粉没有完全水解,若不变蓝,则水解完全。
12.复旦大学的王永刚教授研究团队在柔性电池研究方面取得了新突破,发展了一种基于有机物电极材料的柔性水系锌电池。充放电过程中实现了芘四酮 (PTO)与PTO-Zn的相互转化,原理如图所示。下列说法不正确的是( )
A. 放电时,Zn电极发生氧化反应 B. 放电时,Y极反应式可表示为PTO+2e-+Zn2+=PTO-Zn
C. 充电时,Zn2+向Y极移动 D. 充电时,X电极与电源负极相连
【答案】C
【解析】
【详解】A. 放电时是原电池,电子从Zn电极流出,Zn发生氧化反应,说法正确,A不符合;
B. 放电时,Y极是正极,反生还原反应,说法正确,B不符合;
C. 充电时是电解池,Zn2+是阳离子应向阴极移动,Y极在充电时是阳极,说法错误,C符合;
D. 充电时,X电极是阴极,与电源负极相连,说法正确,D不符合;
答案选C。
【点睛】二次电池的电极,放电时正极,充电时则为阳极;放电时负极,充电时则为阴极;
原电池负极的判断:电子流出那一极是负极,发生氧化反应的一极是负极,阴离子向负极移动,负极有可能因参加反应溶解而变细,如果是二次电池,与电源负极相连的那一极,在放电时是负极。
13.常温下,向20.00mL0.10mol·L-1NH4Cl溶液中逐滴加入0.10mol·L-1
- 21 -
NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发),其中d点为反应终点。下列说法不正确的是( )
A. V=20.00mL
B. 常温下,Kb(NH3·H2O)的数量级为10-5
C. b点溶液中:c(Cl-)>c(Na+)>c(H+)=c(OH-)
D. c点的混合溶液中:c(NH4+)=c(Na+)
【答案】D
【解析】
【分析】
A. d点溶液是反应终点,按恰好完全反应来分析;
B. a点溶液是氯化铵溶液水解呈酸性,常温下pH为5,结合水解常数与电离平衡常数的关系估算;
C. b点溶液恰好呈中性,加入的碱溶液体积小于10.00mL来判断;
D. c点的混合溶液中,一水合氨和氯化铵的物质的量相等,根据电荷守恒和物料守恒分析;
【详解】A. d点为反应终点,加入NaOH的体积为20.00mL时,恰好完全反应生成NH3⋅H2O和NaCl,说法正确,不符合;
B. 常温下,a点对应的0.10mol·L-1NH4Cl溶液,存在水解平衡, ,Kb(NH3·H2O)10-5,说法正确,不符合;
C. b点溶液恰好呈中性,加入NaOH的体积小于10.00mL:混合溶液中c(Cl-)>c(Na+)>c(H+)=c(OH-),说法正确,C不符合;
- 21 -
D. c点溶液为加入NaOH的体积为10.00mL,恰得到物质的量均为10-3mol的NH3⋅H2O和NH4Cl,溶液中存在电荷守恒:,由物料守恒:,两个式子合并得到:,因为c点溶液呈碱性,所以 >c(Na+),D选项说法错误,D符合;
答案选D。
14.反应2NO+Cl2=2NOCl在295K时,其反应物浓度与反应速率关系的数据如下:
c(NO)/(mol·L-1)
c(Cl2)/(mol·L-1)
v(Cl2)/(mol·L-1·s-1)
①
0.100
0.100
8.0×10-3
②
0.500
0.100
2.0×10-1
③
0.100
0.500
4.0×10-2
注:①反应物浓度与反应速率关系式为v(Cl2)=k·cm(NO)cn(Cl2)(式中速率常数k=Ae-Ea/RT,其中Ea为活化能,A、R均为大于0的常数,T为温度);②反应级数是反应的速率方程式中各反应物浓度的指数之和。下列说法不正确的是( )
A. m=2,n=1,反应级数为3级
B. 当c(NO)=0.200mol·L-1,c(Cl2)=0.300mol·L-1,v(NO)=0.192mol·L-1·s-1
C. 加入催化剂可以改变反应途径,也可以增大速率常数k,而加快反应速率
D. 升高温度,可以增大反应的活化能Ea,从而使速率常数k增大
【答案】D
【解析】
分析】
由表中①③数据可知,n=1,由①②组数据可知,m=2,由①数据可知;
【详解】A.据数据分析知m=2,n=1,反应级数为3级,A正确;
- 21 -
B. 当c(NO)=0.200mol·L-1,c(Cl2)=0.300mol·L-1,v(NO)=2v(Cl2)=2×8.0××0.300mol·L-1·s-1=0.192mol·L-1·s-1,B正确;
C. 催化剂可降低反应的活化能,增大活化分子数目,增大反应速率,C正确;
D. 升高温度,活化能不变,D错误;
答案选D。
二、非选择题(本题共5小题,共58分)
15.A是来自石油的基本化工原料,其分子式为C2H4。B和D是生活中两种常见的有机物,F是高分子化合物。它们之间的相互转化关系如图所示:
(1)C中官能团名称是__。
(2)在反应①~⑥中,属于取代反应的是__(填序号)。
(3)用于鉴别B、D的试剂是__(任写一种)。
(4)写出A→F的化学方程式:__。
(5)请写出G的同分异构体中含有羧基的结构简式:__。
【答案】 (1). 醛基 (2). ④⑤ (3). Na2CO3溶液(或紫色石蕊试液等) (4). nCH2=CH2 (5). CH3CH2CH2COOH、(CH3)2CHCOOH
【解析】
【分析】
A是来自石油的基本化工原料,其分子式为C2H4,即乙烯,B、C和D分别为乙醇、乙醛和乙酸,G为乙酸乙酯,E为乙酸钠,F为聚乙烯,据此回答;
【详解】(1)C为乙醛,所含官能团为醛基;
答案为:醛基;
(2)酯化反应和酯的水解属于取代反应;
答案为:④⑤;
- 21 -
(3)B、D分别是乙醇和乙酸,乙醇呈中性,乙酸呈酸性,可利用紫色石蕊试液(溶液变红)(或碳酸钠溶液,产生气体)鉴别;
答案为:紫色的石蕊试剂;
(4)A→F是乙烯的加聚反应,
答案为:
(5)G为CH3COOCH2CH3,分子式为C4H8O2,含有羧基的同分异构体为羧酸,CH3CH2CH2COOH、(CH3)2CHCOOH;
答案为: CH3CH2CH2COOH、(CH3)2CHCOOH。
16.二氧化氯是一种高效消毒剂,通常状况下二氧化氯易溶于水,沸点为11.0℃,极易爆炸,制取和使用二氧化氯时要用性质稳定的气体按一定比例稀释,以防爆炸。某实验小组在干燥空气稀释条件下,用干燥的氯气与固体亚氯酸钠制备二氧化氯,实验装置如图所示:
(1)仪器a的名称为__,装置A中反应的化学方程式为__。
(2)试剂X是__。
(3)装置D中冰水的主要作用是__。装置D内发生反应的化学方程式为__。
(4)工业上也常用盐酸或双氧水还原NaClO3制备ClO2,相比之下用双氧水制备ClO2方法更优,可能的原因是__。
(5)装置E中主要反应的离子方程式为:__。
(6)已知NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
①请完成实验室利用NaClO2溶液制得NaClO2晶体的操作步骤:a.减压,55℃蒸发结晶;b.__;c.用38~60℃的温水洗涤;d.低于60℃干燥,得到产品。
②取上述所得产品2.50g溶于水配成250mL溶液,取出25.00mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.500mol·L-1Na2S2O3
- 21 -
标准液滴定至终点。进行3次实验后,平均用去标准液18.80mL,试计算NaClO2产品的纯度:__(已知:2Na2S2O3+I2=Na2S4O6+2NaI)。
【答案】 (1). 分液漏斗 (2). MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O (3). 饱和食盐水 (4). 冷凝ClO2 (5). 2NaClO2+Cl2=2NaCl+2ClO2 (6). H2O2的氧化产物为O2不会污染环境(或HCl的氧化产物为Cl2会污染环境) (7). Cl2+2OH-=Cl-+ClO-+H2O (8). 趁热过滤 (9). 85.07%(或“0.8507”等)
【解析】
【分析】
(1)装置A是制取氯气用的,要注意反应条件,其中浓盐酸通过分液漏斗滴加;
(2)试剂X用于去除Cl2中的HCl气体,据此选择试剂;
(3)装置B的目的可从信息“沸点为11.0℃,极易爆炸”来推知,写装置D中用干燥的氯气与固体亚氯酸钠反应制备二氧化氯方程式,注意氧化还原中同种元素的价态变化;
(4)相比之下用双氧水制备ClO2方法更优,从是否环境友好型来分析;
(5)装置E是氢氧化钠溶液吸收多余氯气的反应;
(6)①利用NaClO2溶液制得NaClO2晶体最关键是控制结晶的温度:高于38℃低于60℃;
②要计算NaClO2产品的纯度:最关键找到Na2S2O3 和NaClO2的关系式,代入数据计算即可;
【详解】(1)装置A是MnO2和浓HCl在共热条件下发生反应制取氯气用的,其中浓盐酸通过分液漏斗滴加;
答案为:分液漏斗; MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;
(2)试剂X用于去除Cl2中的HCl气体,所以选择饱和食盐水;
答案为:饱和食盐水;
(3)装置B的目的是为防止气态ClO2爆炸,利用冰水浴降温,使ClO2冷凝;装置D中用干燥的氯气与固体亚氯酸钠反应得到二氧化氯,并同时生成NaCl,发生反应的化学方程式为2NaClO2+Cl2=2NaCl+2ClO2;
答案为:冷凝ClO2;2NaClO2+Cl2=2NaCl+2ClO2;
(4)相比之下用双氧水制备ClO2方法更优,因为H2O2的氧化产物为O2不会污染环境(或HCl的氧化产物为Cl2会污染环境);
答案为:H2O2的氧化产物为O2不会污染环境(或HCl的氧化产物为Cl2会污染环境);
(5)装置E是氢氧化钠溶液吸收多余氯气的反应,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;
答案为:Cl2+2OH-=Cl-+ClO-+H2O
(6)①利用NaClO2溶液制得NaClO2
- 21 -
晶体最关键是控制结晶的温度:高于38℃低于60℃;故操作为将装置D反应后的溶液在55℃条件下减压蒸发结晶,趁热过滤,再用38℃~60℃的温水洗涤,最后在低于60℃条件下干燥,得到NaClO2晶体;
故答案为:趁热过滤;
②要计算NaClO2产品的纯度:最关键找到Na2S2O3 和NaClO2的关系式,代入数据计算即可;
=85.07%;
答案为:85.07%或0.8507。
17.碳酸锰可用作脱硫的催化剂,是合成二氧化锰和制造其他锰盐的原料。工业上从锰泥(主要含KMnO4和少量MnO2、CuO、PbO等)中回收MnCO3的流程如图所示:
回答下列问题:
(1)“滤渣1”中的主要成分为PbSO4,其中Pb元素的化合价是__。
(2)Fe2+能将MnO2还原为Mn2+,该反应的离子方程式:__。
为检验FeSO4是否被氧化,可往滤液1中加入__溶液(填化学式)。
(3)已知Ksp[Fe(OH)3]=4.0×10-38,通入NH3调pH=4时,溶液中c(Fe3+)=__。
(4)流程中加入固体X能使Cu2+沉淀,则最适宜的固体X为__(填字母)。
a.MnS b.ZnS c.Ca(OH)2 d.Ba(OH)2
(5)加入氨水和过量NH4HCO3生成MnCO3沉淀的离子方程式为__。
(6)处理锰泥时,H2SO4、FeSO4混合溶液中比值不宜过大,请从节约药品的角度分析,原因是___。
(7)若利用100t锰泥制得55tMnCO3,反应中Mn元素的转化率为80.0%,则锰泥中Mn元素的质量分数为__%(精确到小数点后1位)。
- 21 -
【答案】 (1). +2 (2). 4H++2Fe2++MnO2=Mn2++2Fe3++2H2O (3). KSCN (4). 4.0×10-8mol·L-1 (5). a (6). Mn2++NH3·H2O+HCO3-=MnCO3↓+NH4++H2O (7). 在调节pH环节会多消耗氨气 (8). 32.9
【解析】
【分析】
锰泥(主要成分为KMnO4和少量MnO2、CuO、PbO等)加入硫酸、硫酸亚铁的混合溶液,过滤,滤渣1为PbSO4,滤液1含有Mn2+、Cu2+等,通入氨气调节pH=4,可生成氢氧化铁沉淀,加入MnS,生成CuS沉淀,即滤渣2,用氨水调节pH为6.5-7.2,加入过量碳酸氢铵,过滤、洗涤、干燥,可得MnCO3,以此解答该题。
(1)PbSO4中Pb元素的化合价+2;
(2)Fe2+能将MnO2还原为Mn2+,书写离子方程式时注意酸性环境;检验FeSO4是否被氧化,检验的是氧化产物Fe3+;
(3)已知Ksp[Fe(OH)3]=4.0×10-38=c(Fe3+)c3(OH-),通过pH=4即可求c(Fe3+);
(4)固体X能使Cu2+沉淀,则最适宜的固体X必定能最大程度地沉淀Cu2+,同时不引人杂质;
(5)加入氨水和过量NH4HCO3生成MnCO3沉淀的核心转化是碳酸氢根转成碳酸根被沉淀生成MnCO3;
(6)那么太多的氢离子肯定会多消耗碱;
(7)从锰泥到MnCO3,抓住反应中Mn元素的转化率为80.0%计算;
【详解】(1)PbSO4中Pb元素的化合价+2;
答案为:+2;
(2)Fe2+能将MnO2还原为Mn2+,因为是酸性环境,所以反应方程式为4H++2Fe2++MnO2=Mn2++2Fe3++2H2O;检验FeSO4氧化产物Fe3+,检验时试剂用KSCN;
答案为:4H++2Fe2++MnO2=Mn2++2Fe3++2H2O ;KSCN;
(3)已知Ksp[Fe(OH)3]=4.0×10-38=c(Fe3+)c3(OH-),因为调节pH=4,即c (OH-)=10-10mol/L则;
答案为:4.0×10-8mol·L-1;
(4)固体X能使Cu2+沉淀,则最适宜的固体X必定能最大程度地沉淀Cu2+,同时不引人杂质,最佳为MnS;
答案为:a;
- 21 -
(5)加入氨水和过量NH4HCO3生成MnCO3沉淀的核心,把碳酸氢根转成碳酸根被沉淀生成MnCO3,所以反应为Mn2++ +=MnCO3↓+NH4++H2O;
答案为:Mn2+++=MnCO3↓+NH4++H2O
(6)那么太多的氢离子肯定会多消耗碱,此处用氨气来调节pH,所以会多消耗氨气;
答案为:在调节pH环节会多消耗氨气
(7)从锰泥到MnCO3,抓住反应中Mn元素的转化率为80.0%计算,=32.9%;
答案为:32.9。
18.氢能作为新型能源,可利用CO制得.北京大学马丁教授等团队向容积为VL的密闭容器中充入等物质的量的CO和H2O进行反应。
已知:
反应Ⅰ:FeO(s)+CO(g)Fe(s)+CO2(g) ΔH1
反应Ⅱ:FeO(s)+H2(g)Fe(s)+H2O(g) ΔH2
反应Ⅲ:CO(g)+H2O(g)CO2(g)+H2(g) ΔH
反应Ⅲ在不同催化剂作用下(反应相同时间),温度与CO转化率的关系如图所示。
(1)反应Ⅲ的ΔH与ΔH1、ΔH2关系式:ΔH=_。
(2)若反应Ⅰ和反应Ⅱ的平衡常数分别为K1和K2,则反应Ⅲ的平衡常数K与K1、K2的关系式:K=___。
(3)随着温度的升高,CO的转化率先升后降,“后降”的可能原因是__。
(4)由图可知,ΔH__0(填“大于”或“小于”),催化剂应选择_(填“Au/α-MoC”或“Au/α-MoC/NaCN”)
- 21 -
(5)已知T=1025K时,K=1。则平衡时CO的转化率α(0)=__。当T>1025K时,平衡时,H2的体积分数ω的取值范围为_。此时,CO还原FeO(s)的能力__H2(填“大于”或“小于”)。
(6)欲提高H2的体积分数,可采取的措施为__。
【答案】 (1). ΔH1-ΔH2 (2). (3). 温度过高,催化剂的催化活性下降 (4). 小于 (5). Au/α-MoC (6). 50% (7). 0<ω<25% (8). 小于 (9). 及时分离出CO2(或降低温度)
【解析】
【分析】
(1)用盖斯定律进行分析;
(2)热化学方程式相减,化学平衡常数相除;
(3)在一定温度范围内催化剂活性较高;
(4)升高温度CO转化率降低,说明平衡逆向移动;温度越低、催化剂活性越高越好,据此选择催化剂;
(5)已知T=1025K时,K=1,可用三段式计算出CO、H2O、CO2、H2的物质的量相等,求出CO的转化率、得氢气的体积分数为25%;升高温度平衡逆向移动,氢气的体积分数有所下降,据此判断出体积分数的范围0<ω<25%;平衡逆向移动导致c(CO)>c(H2);选取的催化剂受温度影响;
(6)欲提高H2的体积分数,可以通过改变条件使平衡正向移动而实现;
【详解】(1)反应Ⅰ:FeO(s)+CO(g)Fe(s)+CO2(g) ΔH1,反应Ⅱ:FeO(s)+H2(g)Fe(s)+H2O(g)ΔH2,将反应Ⅰ减去反应Ⅱ得到反应Ⅲ:CO(g)+H2O(g)CO2(g)+H2(g) ΔH,ΔH=ΔH1-ΔH2;
答案为:ΔH1-ΔH2;
(2)根据反应Ⅰ、反应Ⅱ,写出各自的平衡常数表达式K1= ,K2= ;热化学方程式相减,反应Ⅲ:CO(g)+H2O(g)CO2(g)+H2(g),化学平衡常数相除,则反应Ⅲ的平衡常数K与K1、K2的关系式为:;
- 21 -
答案为:;
(3)在一定温度范围内催化剂活性较高,温度过高,催化剂的催化活性下降;
答案为:温度过高,催化剂的催化活性下降;
(4)升高温度CO转化率降低,说明平衡逆向移动,则正反应为放热反应,△H <0;温度越低、催化剂活性越高越好,根据图知,应该选取Au/α-MoC;
答案为:小于;Au/α-MoC;
(5)已知向容积为VL的密闭容器中充入等物质的量的CO和H2O进行反应,设充入的气体各为1mol,T=1025K时,K=1, 得x=0.5,= 、;反应未发生时没有氢气,升高温度平衡逆向移动,氢气的体积分数有所下降,据此判断出体积分数的范围0<ω<25%;平衡逆向移动导致c(CO)>c(H2);
答案为:50%;0<ω<25%;小于;
(6)欲提高H2的体积分数,可以通过改变条件使平衡正向移动而实现;
答案为:及时分离出CO2(或降低温度)。
19.开发稳定高效的脱硫脱硝工艺是当前国内外研究的热点。
(1)天然气中含有的H2S会腐蚀管道和设备,可在1200℃下进行脱硫处理,其中涉及H2S与O2的反应,产物为SO2和水蒸气。若1molH2S参与该反应放热586.16kJ,则该反应的热化学方程式是__。
(2)烟气中的SO2可用“双碱法”洗除:先用NaOH溶液吸收烟气中的SO2,再往所得溶液中加入CaO,反应得到NaOH和CaSO3,原理可表示为:NaOH(aq)Na2SO3(aq)。
①Na2SO3溶液中阴离子的浓度由大到小的顺序:__。
②“双碱法”洗除SO2的优点是__(任写一点)。
(3)过二硫酸钾(K2S2O8
- 21 -
)是一种白色、无味品体,溶于水,不溶于乙醇,有强氧化性。可作为燃煤锅炉烟气脱硝的氧化剂。
①S2O82-的结构式为,则过二硫酸钾(K2S2O8)所含化学键有:__,1个S2O82-中含有化合价为-1价的氧原子的个数是___。
②脱硝过程中依次发生两步反应:第1步K2S2O8将NO氧化成HNO2,第2步K2S2O8继续氧化HNO2,第2步的氧化产物为__。
③实验室中通过电解饱和KHSO4水溶液的方法制备K2S2O8。
电极B为电解池__极(填“阳”或“阴”,气体a为__(写化学式),电极A的电极反应式为__。
【答案】 (1). H2S(g)+O2(g)=SO2(g)+H2O(g) ΔH=-586.16kJ·mol-1 (2). c(SO32-)>c(OH-)>c(HSO3-) (3). 用CaO可使NaOH再生(或可获得副产物石膏等其他合理答案) (4). 离子键、共价键 (5). 2 (6). HNO3 (7). 阴 (8). H2 (9). 2SO42--2e-=S2O82-(或2HSO4--2e-=S2O82-+2H+)
【解析】
【分析】
(1)写热化学方程式时注意状态及化学计量数与ΔH的比例关系;
(2)①Na2SO3溶液水解呈碱性,按水解程度不大,把三种阴离子的浓度c(SO32-)、(OH-)、c(HSO3-)排序;②“双碱法”洗除SO2的优点可从提高原料利用率等综合经济效益的角度思考;
(3)根据结构式,过二硫酸钾(K2S2O8)是含复杂离子的离子化合物,可据此判断化学键;求-1价的氧原子的个数,就是指氧原子之间共用一对电子对的那几个氧原子;HNO2的氧化产物只能为硝酸;电解饱和KHSO4水溶液制备K2S2O8,是KHSO4被氧化反应,按反应类型判断出电极A为阳极,并可写出电极A的电极反应式;气体a则是阴极产物;
【详解】(1)H2S与O2的反应的方程式为2H2S+3O2=2SO2+2H2O,1molH2
- 21 -
S参与该反应放热586.16kJ ,故热化学方程式可以为:H2S(g)+O2(g)=SO2(g)+H2O(g) ΔH=-586.16kJ·mol-1;
答案为:H2S(g)+O2(g)=SO2(g)+H2O(g) ΔH=-586.16kJ·mol-1
(2)①Na2SO3是强碱弱酸盐,水解显碱性,水解程度不大并且以第一步水解为主,水有极微弱的电离,则可知溶液中阴离子的浓度c(SO32-)>c(OH-)>c(HSO3-);
答案为:c(SO32-)>c(OH-)>c(HSO3-);
②双碱法原理可表示为:NaOH(aq)Na2SO3(aq),由此可知,第一步消耗NaOH、第二步又生成NaOH和CaSO3,使NaOH再生,而CaSO3氧化生成CaSO4,得到石膏;
答案为:用CaO可使NaOH再生(或可获得副产物石膏等其他合理答案)
(3)①①过二硫酸钾(K2S2O8)是离子化合物、含有离子键;阴离子S2O82-的结构式为可知含有极性共价键O-S、O=S键和非极性共价键O-O键,其中-1价的氧原子的个数为2;
答案:离子键、共价键;2;
②HNO2的氧化产物只能为硝酸;
答案为:HNO3;
③电解饱和KHSO4水溶液制备K2S2O8,是KHSO4被氧化反应,电极A为阳极,并可写出电极A的电极反应式2SO42--2e-=S2O82-(或2HSO4--2e-=S2O82-+2H+);电极B是阴极,气体a是阴极的还原产物,只能是氢气;
答案为:阴;H2;2SO42--2e-=S2O82-(或2HSO4--2e-=S2O82-+2H+)。
【点睛】(3)出现了过二硫酸钾,信息提示它的强氧化性,从结构式中完全可以找到原因:含有—O—O—不稳定,这-1的氧原子可以联想过氧化钠、过氧化氢;碰到新物质,要联想有共同点的熟悉的物质类比。
- 21 -
- 21 -
相关文档
- 福建省漳州市东山第二中学2019-2022021-07-0621页
- 广西柳州市2020届高三毕业班4月模2021-07-068页
- 河北省石家庄市2020届高三毕业班综2021-07-0610页
- 湖南省郴州市2020届高三第一次教学2021-07-0623页
- 福建省南平市2020届高三毕业班第一2021-07-0610页
- 广东省2020届高三年级第一次教学质2021-07-068页
- 安徽省合肥市2020届高三第一次教学2021-07-069页
- 河北省石家庄市第二中学2020届高三2021-07-0612页
- 【化学】福建省漳州市平和县第一中2021-07-0512页
- 2017-2018学年陕西省渭南市尚德中2021-07-059页