- 339.02 KB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019届高三化学10月月考试题
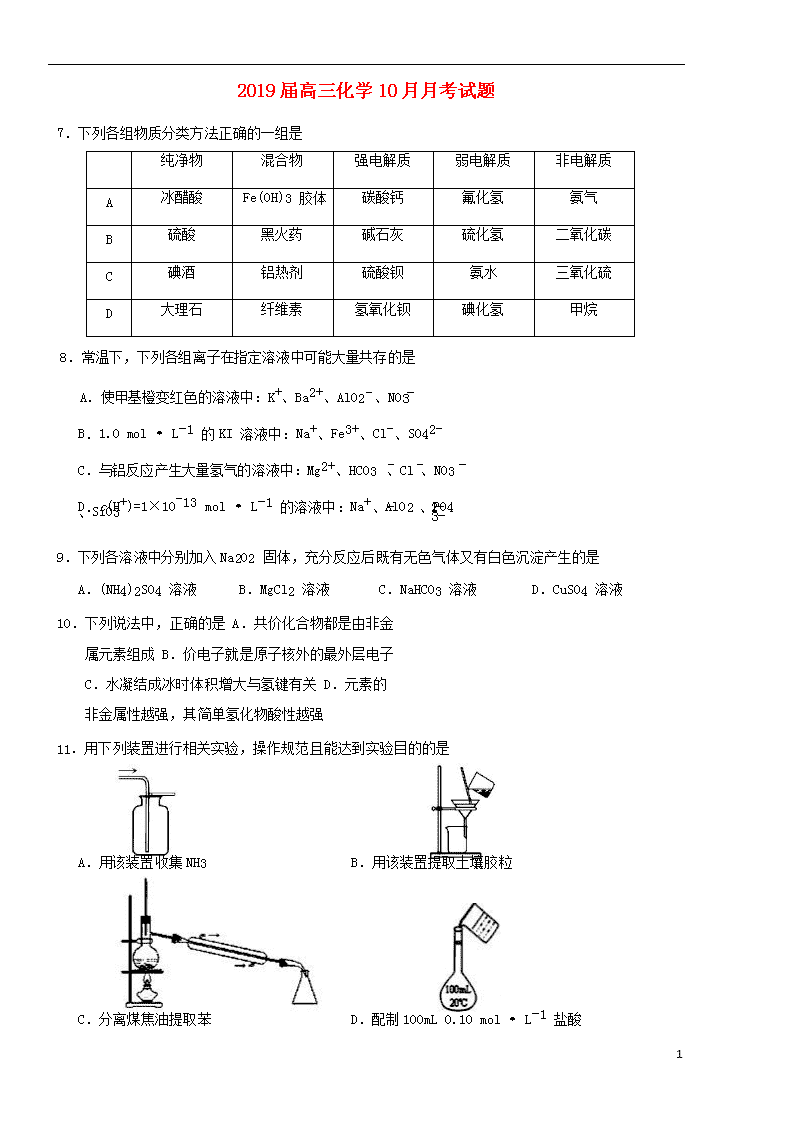
7.下列各组物质分类方法正确的一组是
纯净物
混合物
强电解质
弱电解质
非电解质
A
冰醋酸
Fe(OH)3 胶体
碳酸钙
氟化氢
氨气
B
硫酸
黑火药
碱石灰
硫化氢
二氧化碳
C
碘酒
铝热剂
硫酸钡
氨水
三氧化硫
D
大理石
纤维素
氢氧化钡
碘化氢
甲烷
8.常温下,下列各组离子在指定溶液中可能大量共存的是
A.使甲基橙变红色的溶液中:K+、Ba2+、AlO2 、NO3
- -
B.1.0 mol·L-1 的 KI 溶液中:Na+、Fe3+、Cl-、SO42-
- - -
C.与铝反应产生大量氢气的溶液中:Mg2+、HCO3 、Cl 、NO3
8
D.c(H+)=1×10-13 mol·L-1 的溶液中:Na+、AlO2 、SiO3
、PO4
8
- 2- 3-
9.下列各溶液中分别加入 Na2O2 固体,充分反应后既有无色气体又有白色沉淀产生的是
A.(NH4)2SO4 溶液 B.MgCl2 溶液 C.NaHCO3 溶液 D.CuSO4 溶液
10.下列说法中,正确的是 A.共价化合物都是由非金属元素组成 B.价电子就是原子核外的最外层电子 C.水凝结成冰时体积增大与氢键有关 D.元素的非金属性越强,其简单氢化物酸性越强
11.用下列装置进行相关实验,操作规范且能达到实验目的的是
A.用该装置收集 NH3 B.用该装置提取土壤胶粒
C.分离煤焦油提取苯 D.配制 100mL 0.10 mol·L-1 盐酸
8
12.已知:NA 表示阿伏加德罗常数,则下列说法正确的是
4 A
A.常温下,向 1L 0.2 mol·L-1 的盐酸溶液通入氨气,当溶液 PH=7 时,溶液中 NH +的数目等于 0.2N
B.标准状况下,2.24L HF 中所含质子的数目为 NA
C.常温常压下,22.4L 乙烯和丙烯的混合气体含氢原子数目为 5NA
D.124g 白磷(P4)分子中所含 P—P 共价键数目为 4NA
13.将 51.2g Cu 完全溶于适量浓硝酸中,收集到氮的氧化物(含 NO、NO2、N2O4)的混合物共 0.8 mol,这些气 体恰好能被 600mL 2.0 mol·L-1 NaOH 溶液完全吸收,溶液中生成 NaNO3 和 NaNO2,则 NaNO2 物质的量为 A.0.6 mol B.0.8 mol C.1 mol D.1.2 mol
8
+ - + + 2-
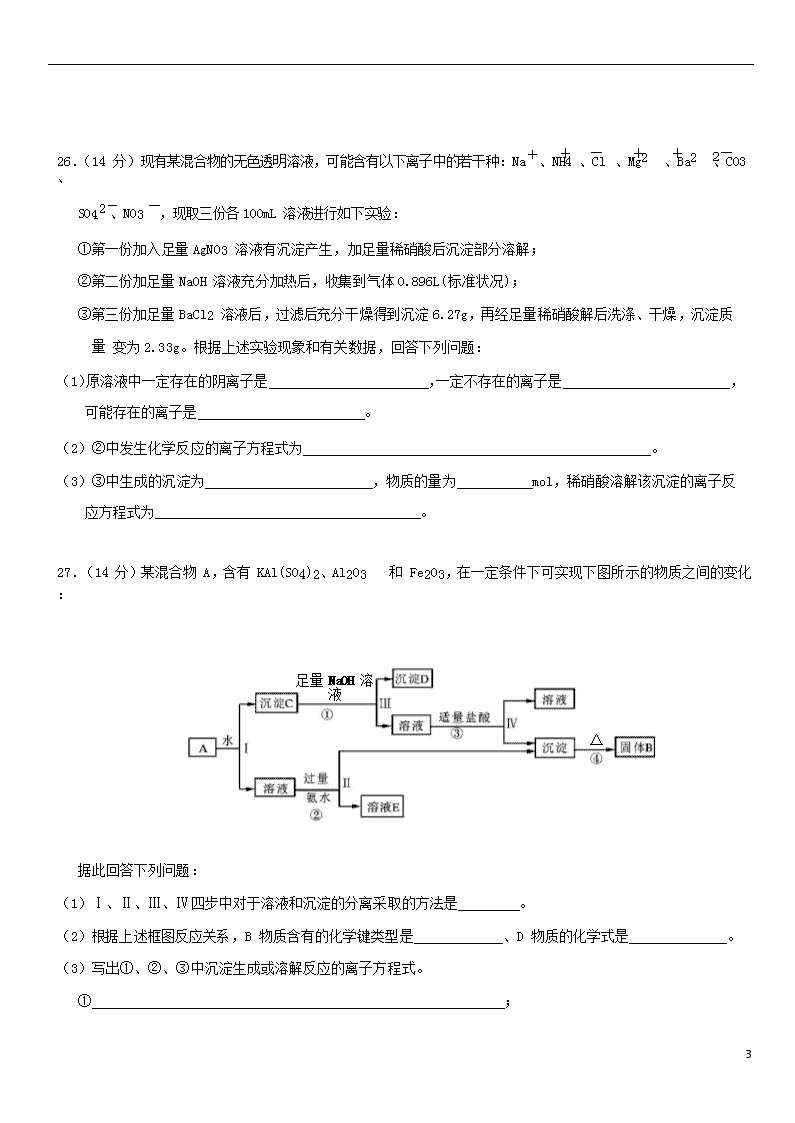
26.(14 分)现有某混合物的无色透明溶液,可能含有以下离子中的若干种:Na+、NH4 、Cl 、Mg2 、Ba2 、CO3 、
2- -
8
SO4
、NO3 ,现取三份各 100mL 溶液进行如下实验:
8
①第一份加入足量 AgNO3 溶液有沉淀产生,加足量稀硝酸后沉淀部分溶解;
②第二份加足量 NaOH 溶液充分加热后,收集到气体 0.896L(标准状况);
③第三份加足量 BaCl2 溶液后,过滤后充分干燥得到沉淀 6.27g,再经足量稀硝酸解后洗涤、干燥,沉淀质量 变为 2.33g。根据上述实验现象和有关数据,回答下列问题:
(1)原溶液中一定存在的阴离子是 ,一定不存在的离子是 , 可能存在的离子是 。
(2)②中发生化学反应的离子方程式为 。
(3)③中生成的沉淀为 ,物质的量为 mol,稀硝酸溶解该沉淀的离子反 应方程式为 。
27.(14 分)某混合物 A,含有 KAl(SO4)2、Al2O3 和 Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
足量 NaOH 溶液
△
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是 。
(2)根据上述框图反应关系,B 物质含有的化学键类型是 、D 物质的化学式是 。
(3)写出①、②、③中沉淀生成或溶解反应的离子方程式。
① ;
8
② ;
③ 。
(4)步骤③较难操作,如何将实验方案进行改进? 。
28.(15 分)粉煤灰中含有 SiO2、Al2O3、Fe2O3 等,某实验室对其进行处理的流程如图所示:
8
粉煤灰
①NH4HSO4
400℃
NH3
熟料
②水浸 过滤
滤液 A
③NH4HCO3
调节 pH
过滤
滤液 C
Fe(OH)3
④
蒸发、结晶 晶体
⑤过量试剂 D
8
回答下列问题:
滤渣 B
Al(OH)3
滤液 E
过滤
⑥过量 CO2
过滤
Al(OH)3
8
(1)Fe2O3 中 Fe 元素在周期表的位置是 ,滤渣 B 的主要成分为 。
(2)第①步得到 NH3 和“熟料”,请写出 NH3 的电子式 ,“熟料”中可溶性的成分主要是 NH4Fe(SO4)2 和 NH4Al(SO4)2 等。向 NH4Al(SO4)2 溶液中加入过量的 Ba(OH)2 溶液时,写出发生反应的离子方 程式: 。
(3)已知 Ksp[Fe(OH)3]=4×10﹣38,Ksp[Al(OH)3]=1×10﹣33。为实现步骤③的实验目的,应使溶液中 c(Al3+)小于或等 于 1×10﹣6mol/L,则溶液 A 至少应调节到 pH= ,此时 c(Fe3+)= mol/L。
(4)实验室进行第④步操作时,所需的仪器除铁架台(带铁圈)、酒精灯、玻璃棒外还需要 。第⑤ 步所加试剂 D 可能是 ;第⑥步生成 Al(OH)3 的离子方程式是 。
8
35.【化学——选修三《物质结构与性质》】(15 分)
根据已学物质结构与性质的有关知识,回答下列问题:
(1)请写出第三周期元素中 p 轨道上有 3 个未成对电子的元素符号: ,硒元素被科学家称之为人 体微量元素中的“防癌之王”,其原子的外围电子(价电子)排布是 。
8
(2)根据价层电子对互斥理论推测:H3O+中氧原子采取的杂化类型是 ,BF3 的空间结构是 。
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透 明溶液,写出有关化学反应方程式 、 。
(4)金属铁的晶体在不同温度下有两种堆积方式, 晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际 含有的 Fe 原子个数之比为 ;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心
立方晶胞的密度之比为 。
8
36.【化学——选修五《有机化学基础》】(15 分)
某些有机化合物之间具有如下转化关系:
体心立方 面心立方
8
8
A
(C4H2O3)
H2O
①
B
(C4H4O4)
H2/Ni
△ ②
C LiAlH4
③
浓 H2SO4
D △ ④
G
(C4H6)
8
8
H2O
一定条件 ⑤
CH3CH2OH △ ⑥ 浓 H SO
8
2 4
8
E
(M=134 g/mol)
F
(C8H14O4)
8
其中 A 是一种五元环状化合物,其分子中只有一种化学环境的氢原子;B 分子中无支链,1mol B 与 NaHCO3
发生反应放出 22.4L 气体(标准状况),其分子中有两种化学环境的氢原子;F 核磁共振氢谱显示有三种化 学环境的氢原子,且峰面积之比为 2:2:3。
H2O
已知:① 2R—COOH(其中 R 是烃基)
②R-COOH R-CH2OH(其中 R 是烃基) 请回答下列问题:
(1)B 中含氧官能团的名称是 ,G 是合成顺丁橡胶的主要原料,G 的名称是 ,
②和④的反应类型分别是 、 。
(2)写出 C 的结构简式 。
(3)写出①的化学方程式 。
8
(4)E 在一定条件下能够发生缩聚反应,E 的结构简式为 。有机物 Y 与 E 互为同分异构体, 且与 E 具有相同的官能团种类和数目,则 Y 的结构有 种。
(5)结合本题信息,请设计以 CH3COOH 为原料合成 CH2=CH2 的工艺流程
贵州省都匀一中 2018 届高三第三次月考
理科综合能力测试
化学参考答案
7—13 A、D、B、C、C、A、B
26.(除特殊说明外,每空 2 分,共 14 分)
8
2- 2-
+ + -
8
(1) Cl-、CO3
+
、SO4
△
; Mg2
、Ba2
; NO3
8
(2)
NH4
+OH- NH3↑+H2O
8
(3)BaCO3 和 BaSO4 0.03 BaCO3+2H+=Ba2++CO2↑+H2O
27.(除特殊说明外,每空 2 分,共 14 分)
(1)过滤
(2)离子键;Fe2O3
(3)①Al2O3 + 2 OH -=2AlO2 -+H2O
②Al3++3NH3·H2O=Al(OH) 3↓+3NH4+
③AlO2-+H+ +H2O=Al(OH) 3↓
(4)将加入盐酸改为通入过量的 CO2 气体
28.(除特殊说明外,每空 2 分,共 15 分)
(1)第四周期 VIII 族 SiO2(1 分)
2- - 2+ -
8
(2) NH4++Al3++2SO4
(3)5;4×10-11
+5OH +2Ba
=NH3·H2O+AlO2 +2H2O+2BaSO4↓
8
(4)蒸发皿(1 分); NaOH(或 KOH)溶液(1 分);AlO2﹣+CO2+H2O=Al(OH)3↓+HCO3-
35(除特殊说明外,每空 2 分,共 15 分)
(1)P(1 分) 4s24p4
(2)sp3、平面正三角形
(3) CuSO 4 + 2NH 3 × H 2O = Cu(OH) 2 ¯ +(NH 4 )2 SO 4
Cu(OH)2+4 NH3·H2O =[Cu(NH3)4](OH)2+4H2O
(4) 1∶2 ; 3 6 /8
36 (除特殊说明外,每空 2 分,共 15 分)
(1)羧基(1 分) 1,3-丁二烯 加成反应(还原反应)(1 分) 消去反应 (1 分)
(2) HOOC—CH2—CH2—COOH
(3) + H2O HOOC—CH=CH—COOH (4)HOOC—CH(OH)—CH2—COOH 2
(5) CH3-COOH CH3-CH2OH CH2=CH2
- 1 -
8
相关文档
- 2018-2019学年河南省信阳高中、商2021-07-079页
- 高中化学教案新人教版选修1 爱护水2021-07-074页
- 2020高中化学 第四章 元素与材料世2021-07-074页
- 广东省深圳科学高中2019-2020学年2021-07-0717页
- 高中化学必修1第1章第1节第1课时练2021-07-077页
- 高中化学教案新人教版必修2 开发利2021-07-074页
- 2020高中化学 重要的体内能源—油2021-07-074页
- 2020新教材高中化学课时作业3氮气2021-07-076页
- 2020高中化学 单元复习与巩固(基础)2021-07-074页
- 高中物理 第12章 第5节多普勒效应2021-07-0725页