- 1.10 MB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
阶段复习课
第
1
章
核心整合
·
思维导图
情境探究
•
素养提升
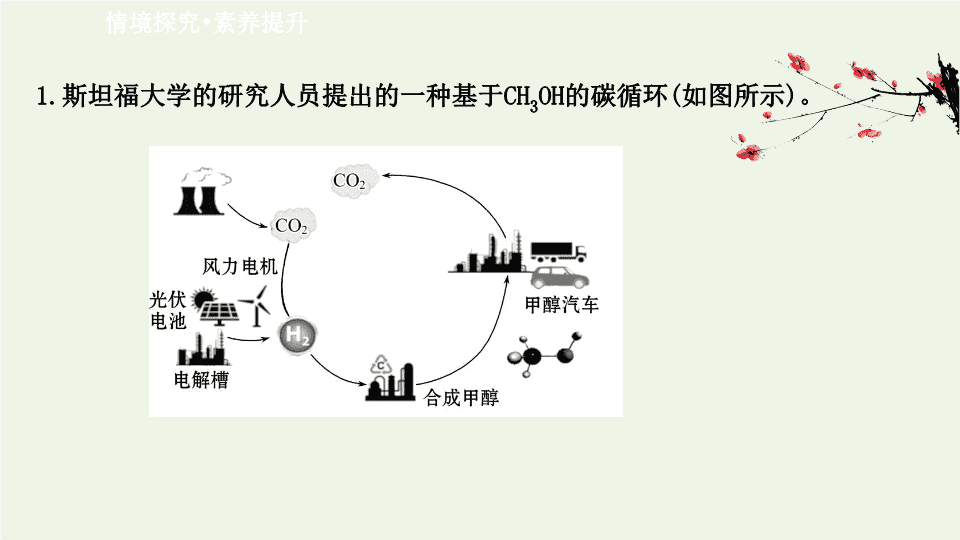
1.
斯坦福大学的研究人员提出的一种基于
CH
3
OH
的碳循环
(
如图所示
)
。
(1)
甲醇是一种重要的燃料
,
已知在
25 ℃
、
100 kPa
下
,1 g
甲醇燃烧生成
CO
2
和
液态水时放热
22.68 kJ,
写出此反应的热化学方程式。
提示
:
1 mol CH
3
OH
燃烧生成
CO
2
和液态水时放热为
32×22.68 kJ=725.76 kJ,
因此热化学方程式为
CH
3
OH(l)+ O
2
(g)====CO
2
(g)+2H
2
O(l)
ΔH=
-725.76 kJ·mol
-1
。
(2)
制氢气的过程中能量的转化形式是怎样的
?
写出生成氢气的电极反应式。
提示
:
制取氢气时采用的是电解法
,
电能转化为化学能
,
其中生成氢气的电极反应式为
2H
+
+2e
-
====H
2
↑
。
(3)
可以将甲醇制成燃料电池
,
甲醇燃料电池
(DMFC)
可用于笔记本电脑、汽
车、遥感通讯设备等
,
它的一极通入甲醇
,
另一极通入氧气
;
电解质是质子交换
膜。
写出此电池的总方程式和电极反应式。
提示
:
电池的总反应式就是甲醇燃烧的方程式
,
因此电池总反应式为
2CH
3
OH +3O
2
====2CO
2
+4H
2
O
。通入甲醇的一极失去电子为负极
,
电极反应式为
CH
3
OH+H
2
O-6e
-
====CO
2
↑+6H
+
,
通入氧气的电极为正极
,
电极反应式为
O
2
+4H
+
+4e
-
====2H
2
O
。
2.
近年来
,
随着聚酯工业的快速发展
,
氯气的需求量和氯化氢的产出量也随之
迅速增长。因此
,
将氯化氢转化为氯气的技术成为科学研究的热点。
Deacon
直
接氧化法可按下列催化过程进行
:
CuCl
2
(s)
====
CuCl(s)+ Cl
2
(g)
Δ
H
1
=83 kJ·mol
- 1
CuCl(s)+ O
2
(g)
====
CuO(s)+ Cl
2
(g)
Δ
H
2
=-20 kJ·mol
- 1
CuO(s)+2HCl(g)
====
CuCl
2
(s)+H
2
O(g)
Δ
H
3
=-121 kJ·mol
- 1
计算反应
4HCl(g)+O
2
(g)
====
2Cl
2
(g)+2H
2
O(g)
的焓变。
提示
:
-116 kJ
·
mol
- 1
。
反应
Ⅰ:CuCl
2
(s)
====
CuCl(s)+ Cl
2
(g)
Δ
H
1
=83 kJ
·
mol
-1
,
反应
Ⅱ:CuCl(s)+ O
2
(g)
====
CuO(s)+ Cl
2
(g)
Δ
H
2
=-20 kJ
·
mol
-1
,
反应
Ⅲ:CuO(s)+2HCl(g)
====
CuCl
2
(s)+H
2
O(g)
Δ
H
3
=-121 kJ
·
mol
-1
,
根据盖斯定律知
,(
反应
Ⅰ+
反应
Ⅱ+
反应
Ⅲ)×2
得
4HCl(g)+O
2
(g)====
2Cl
2
(g)+2H
2
O(g),
则此反应的
Δ
H=(
Δ
H
1
+
Δ
H
2
+
Δ
H
3
)×2=-116 kJ
·
mol
-1
。
3.
根据美国国家海洋和大气管理局气候变化专门委员会周四发布的最新月度全球气候报告
,2019
年
6
月是
140
年来最热的
6
月
,
创下了全球气候记录。其中
CO
2
的作用是巨大的
,“
节能减排”是必须的
,CO
2
的资源化利用能有效减少
CO
2
排放
,
充分利用碳资源。其中电解法转化
CO
2
可实现
CO
2
资源化利用。电解
CO
2
制
HCOOH
的原理示意图如下。
(1)
写出阴极
CO
2
被还原为
HCOO
-
的电极反应式。
提示
:
阴极
CO
2
被还原为
HCOO
-
的电极反应是二氧化碳得到电子生成甲酸根离子
,
电极反应式为
CO
2
+ +2e
-
====HCOO
-
+
。
(2)
电解一段时间后
,
阳极区的
KHCO
3
溶液浓度怎样变化。
提示
:
电解一段时间后
,
阳极区的
KHCO
3
溶液浓度降低。原因是阳极氢氧根离子
失电子生成氧气
,
电极附近氢离子浓度增大
,pH
减小
,
和碳酸氢根离子反应
,
浓度降低
,K
+
部分迁移至阴极区。
4.
液流电池是一种新的蓄电池
,
使正负极电解液分开
,
各自循环的一种高性能蓄电池
,
具有容量高、使用领域
(
环境
)
广、循环使用寿命长的特点。一种锌溴液流电池如图所示
,
电解液为溴化锌的水溶液。
(1)
判断充电时外接电源的
a
、
b
的正负。
提示
:
锌溴液流电池的电解液为溴化锌的水溶液
,
根据图示可以得出此电池反应为
Zn+Br
2
==== Zn
2+
+2Br
-
。所以锌端为负极而溴的一端为正极
,
所以充电时外接电源
a
端为正极
,b
端为负极。
(2)
写出充电时的电极反应式。
提示
:
充电时为电解池
,
电极反应式是放电时电极反应式的逆反应
,
故充电时正极
(
阳极
)
电极反应式为
2Br
-
-2e
-
==== Br
2
,
负极
(
阴极
)
电极反应式为
Zn
2+
+2e
-
==== Zn
。
(3)
判断放电过程中电解质储罐中的离子总浓度的变化。
提示
:
增大。放电时左侧生成溴离子
,
右侧生成锌离子
,
所以放电时左右两侧电解质储罐中的离子总浓度均增大。
相关文档
- 【化学】吉林省长春市第二十九中学2021-07-077页
- 化学卷·2019届黑龙江省哈尔滨师范2021-07-078页
- 【化学】河南省商丘市第一高级中学2021-07-079页
- 化学卷·2018届陕西省西北大学附属2021-07-0719页
- 四川省泸县第四中学2020届高三下学2021-07-076页
- 湖南省邵东县第一中学2019-2020学2021-07-0722页
- 2018-2019学年吉林省白城市通榆县2021-07-0718页
- 甘肃省定西市岷县第二中学2019-2022021-07-078页
- 2017-2018学年黑龙江省大庆实验中2021-07-0711页
- 吉林省实验中学2019-2020学年高二2021-07-0721页