- 1016.50 KB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
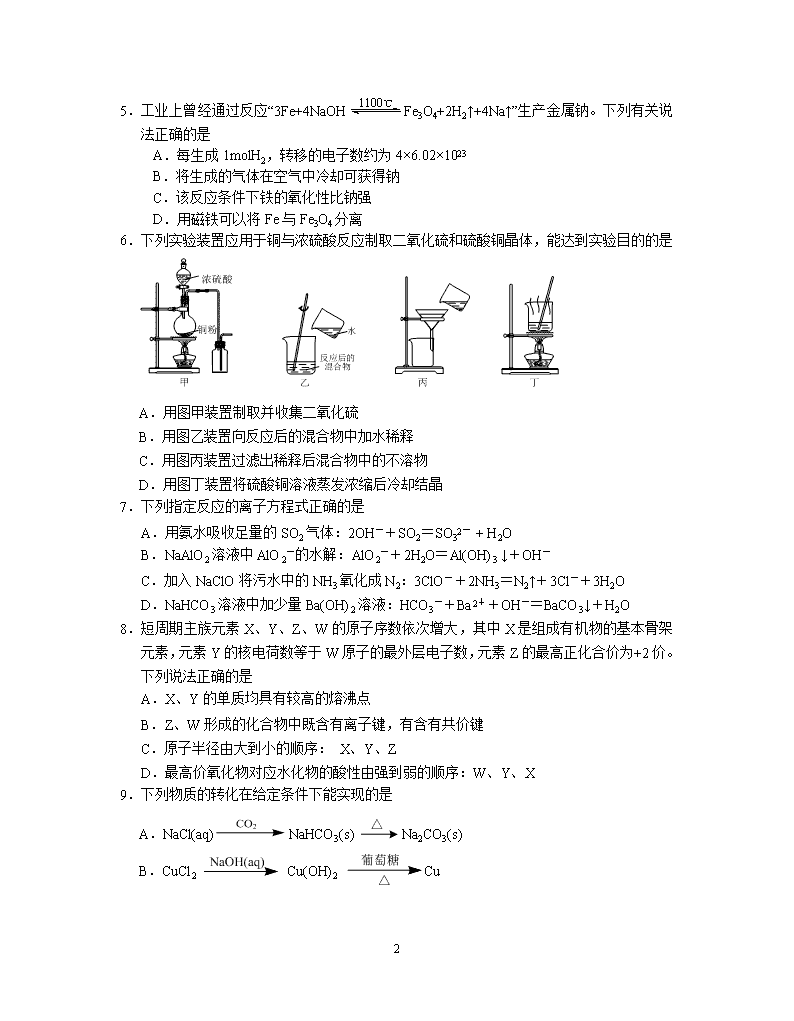
- 网站客服QQ:403074932
2019届省淳中高考适应性考试
化 学 2019.5
本试卷分选择题和非选择题两部分。共120分。考试用时100分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 K 39 Mn 55 Fe 56 Pb 207
选择题(共40分)
单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。
1.我国《可再生能源法》倡导碳资源的高效转化及循环利用(如图所示)。下列做法与上述理念相违背的是
A.大力发展煤的气化及液化技术
B.加快石油等化石燃料的开采和使用
C.以CO2 为原料生产可降解塑料
D.将秸秆进行加工转化为乙醇燃料
2.下列有关化学用语表示正确的是
A.Cl-的结构示意图: B.次氯酸的结构式:
C.CH3F的电子式: D.CO2的分子比例模型:
3.下列物质性质与应用对应关系正确的是
A.SO2具有还原性,可用于漂白纸浆
B.碱石灰具有吸水性,可用于干燥氯气
C.氢氟酸具有弱酸性,可用于蚀刻玻璃
D.H2O2具有还原性,可用于与酸性高锰酸钾溶液反应制取少量氧气
4.常温下,下列各组离子一定能在指定溶液中大量共存的是
A.由水电离产生的c(OH﹣)=1×10﹣10mol•L﹣1的溶液中:Ba2+、K+、NO3﹣、Br﹣
B.使甲基橙变红色的溶液中:K+、NH4+、HCO3﹣、Cl﹣
C.与Al反应能放出大量H2的溶液中:Fe2+、Na+、NO3﹣、Cl﹣
D.c(I﹣)=0.1mol•L﹣1的溶液中:Na+、Mg2+、ClO﹣、SO42﹣
9
5.工业上曾经通过反应“3Fe+4NaOHFe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是
A.每生成1molH2,转移的电子数约为4×6.02×1023
B.将生成的气体在空气中冷却可获得钠
C.该反应条件下铁的氧化性比钠强
D.用磁铁可以将Fe与Fe3O4分离
6.下列实验装置应用于铜与浓硫酸反应制取二氧化硫和硫酸铜晶体,能达到实验目的的是
A.用图甲装置制取并收集二氧化硫
B.用图乙装置向反应后的混合物中加水稀释
C.用图丙装置过滤出稀释后混合物中的不溶物
D.用图丁装置将硫酸铜溶液蒸发浓缩后冷却结晶
7.下列指定反应的离子方程式正确的是
A.用氨水吸收足量的SO2气体:2OH-+SO2=SO32- + H2O
B.NaAlO2溶液中AlO2-的水解:AlO2-+2H2O=Al(OH)3 ↓+OH-
C.加入NaClO将污水中的NH3氧化成N2:3ClO-+2NH3=N2↑+3Cl-+3H2O
D.NaHCO3溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
8.短周期主族元素X、Y、Z、W的原子序数依次增大,其中X是组成有机物的基本骨架元素,元素Y的核电荷数等于W原子的最外层电子数,元素Z的最高正化合价为+2价。下列说法正确的是
A.X、Y的单质均具有较高的熔沸点
B.Z、W形成的化合物中既含有离子键,有含有共价键
C.原子半径由大到小的顺序: X、Y、Z
D.最高价氧化物对应水化物的酸性由强到弱的顺序:W、Y、X
9.下列物质的转化在给定条件下能实现的是
A.NaCl(aq)NaHCO3(s) Na2CO3(s)
B.CuCl2 Cu(OH)2 Cu
9
C.Al NaAlO2(aq) NaAlO2(s)
D.MgO(s) Mg(NO3)2(aq) Mg(s)
10.下列图示与对应的叙述相符的是
A.图1表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化
B.图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1
C.图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D.图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)2BaO(s)+O2(g), O2的平衡浓度与容器容积的关系
不定项选择题:本题包括5小题,每小题4分,共计20分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11.金银花的有效成分为绿原酸,具有广泛的杀菌、消炎功能,其结构简式见图7。下列有关绿原酸的说法中不正确的是
图7
A. 绿原酸分子中有4个手性碳原子
B. 绿原酸能发生显色反应、取代反应和加成反应
C. 每摩尔绿原酸最多与4 mol NaOH反应
D. 绿原酸分子中所有碳原子都能在同一平面上
12.下列有关说法正确的是
A.反应CaC2(s)+N2(g)=CaCN2(s)+C(s)能自发进行,是因为△H<0
B.若电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化
C.向水中加入NaHCO3或NaHSO4固体后,水的电离程度均增大
D.对于乙酸乙酯的水解反应,加入稀硫酸会使平衡向正反应方向移动
9
13.下列根据实验操作和现象所得出的结论正确的是
选项
实验操作
实验现象
结论
A
向溶有SO2的BaCl2溶液中通入气体X
产生白色沉淀
X一定是Cl2
B
向NaAlO2溶液中持续通入气体Y
先出现白色沉淀,最终沉淀又溶解
Y可能是CO2气体
C
向Na2CO3溶液中加入冰醋酸,将产生的气体直接通入苯酚钠溶液中
产生白色浑浊
酸性:醋酸>碳酸>苯酚
D
向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液
前者溶液变蓝色,后者有黄色沉淀
KI3溶液中存在
I3-I2 + I- 平衡
14.25℃时,用0.0500 mol·L-1H2C2O4(二元弱酸)溶液滴定25.00 mL0.1000 mol·L-1NaOH溶液所得滴定曲线如右图。下列说法正确的是
A.点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O)= c(OH-)
B.点②所示溶液中:c(HC2O)+2c(C2O)= c(Na+)
C.点③所示溶液中:c(Na+)>c(HC2O)>c(H2C2O4)>c(C2O)
D.滴定过程中可能出现:
c(Na+)>c(C2O)=c(HC2O)>c(H+)>c(OH-)
15.一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)COCl2(g),其中容器Ⅰ中5 min时到达平衡。
容器编号
温度/℃
起始物质的量/mol
平衡物质的量/mol
CO
Cl2
COCl2
COCl2
Ⅰ
500
1.0
1.0
0
0.8
Ⅱ
500
1.0
a
0
0.5
Ⅲ
600
0.5
0.5
0.5
0.7
下列说法中正确的是
A.容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B.该反应正反应为吸热反应
C.容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D.若起始时向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO转化率小于80%
9
非选择题(共80分)
16.(12分)工业上处理含铬(主要成分是HCrO4-)污水并制备磁性铁铬氧体工艺流程如下:
FeSO4.7H2O
稀H2SO4
(1)还原过程中HCrO4-转化为Cr3+ 的离子方程式为 ;
(2)当沉淀池中c(Fe2+):c(Fe3+)=2:1时,能生成铁
铬氧体。通入压缩空气是形成铁铬氧体的必要
条件之一,通入压缩空气的目的是 、
。在加NaOH溶液
之前通入的空气量不宜过多,若过多必须向
沉淀池中增补的物质可能 为 。(填字母)
A.FeSO4 B.Cu C.H2O2 D.Fe
(3)已知三价铬[Cr(Ⅲ)]在水溶液中的存在形态随pH 的变化如右图,为尽可能除去铬元
素实现清液达标排放,沉淀池中pH要控制在 ;若pH过高,溶液中残留铬量增大,其原因为 。
17.(15分)血竭素是传统中药血竭中的重要成分,血竭素的中间体G的一种合成路线如下:
(1)A中含氧官能团名称为 和 。
(2)D→E的反应类型是 。
(3)F的分子式为C10H10O6,F→G发生还原反应,F的结构简式为 。
9
(4)G的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式: (只写一种)。
①能与FeCl3溶液发生显色反应,能发生银镜反应并能水解反应。
②有四种不同化学环境的氢。
(5) 已知。写出以、CH3OH和(CH3)2SO4为原料制备的合成路线流程图(无机试剂任用)
18.(12分)PbO2是一种棕黑色粉末,难溶于水,可用作氧化剂和电极制造等。实验室由Ca(ClO)2溶液氧化碱性Pb(OH)2法制备PbO2的步骤如下:
(1)“氧化”过程中,反应液的pH (填“变大”“变小”或“不变”)。
(2)“硝酸洗”时,被溶解的含铅杂质可能是 (填化学式)。
(3)产品定性检验:向Mn(NO3)2的HNO3溶液中加入少量产品,搅拌并水浴微热,溶液变紫色,说明含有PbO2。该反应的离子方程式为 (PbO2还原为Pb2+)。
(4)为测定产品(只含PbO2和PbO)中PbO2、PbO的物质的量之比,称取产品0.5194g,加入 20.00 mL 0.2500 mol·L-1H2C2O4溶液(PbO2还原为Pb2+)搅拌使其充分反应,然后用氨水中和,过滤、洗涤除去PbC2O4,滤液酸化后用0.0400 mol·L-1KMnO4标准溶液滴定至终点(MnO还原为Mn2+),消耗标准溶液10.00 mL。计算产品中n(PbO2)与n(PbO)的物质的量之比(写出计算过程)。
9
19. (15分)实验室中利用CoCl2·6H2O为原料制取三氯化六氨合钴[Co(NH3)6Cl3]的实验步骤如下:
已知:
①Co(NH3)6Cl3在不同温度下水中的溶解度曲线如右图。
②在Co(NH3)6Cl3溶液中加入一定量盐酸有利于结晶。
③Ksp[Co(OH)2]=1.09×10-15,Ksp[Co(OH)3]=2×10-44。
(1)在实验过程中NH4Cl除作反应物外,还有一个作用
是 。
(2) 氧化过程中加入氨水和H2O2在溶液中生成Co(NH3)6Cl3。
①氧化时须先加入氨水再加入H2O2,其原因是 。
②该反应的化学方程式为 。
③反应时需要控制反应温度在50~60 ℃之间,可采取的加热方式是 。
(3) 冰水冷却的目的是 。
(4) 请补充完整由过滤后所得滤渣获取Co(NH3)6Cl3的实验方案:将滤渣加入沸水中,,充分搅拌, ,低温干燥。(实验中须使用的试剂:盐酸、乙醇)
20. (14分)燃煤烟气中含有大量NOx、CO2、CO和SO2,经处理可获得重要的化工原料。
(1) 用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+4NO2(g)4NO(g)+CO2(g)+2H2O(g) ΔH1= -574.0 kJ·mol-1 平衡常数为K1
CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g) ΔH2= +1 160.0 kJ·mol-1 平衡常数为K2
①反应CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g),平衡常数K= (用K1、K2表示)。
②若反应中还原NOx至N2,消耗标准状况下4.48 L CH4,则反应过程中转移的电子总数为 。
(2) 利用烟气中分离所得的CO2、CO与H2按一定比例混合在催化剂的作用下合成甲醇,发生的主要反应如下:
反应1: CO(g)+2H2(g)CH3OH(g) ΔH1= -99.0 kJ·mol-1
反应2: CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH2= +83.0 kJ·mol-1
反应3: CO2(g)+H2(g)CO(g)+H2O(g) ΔH3=+384.0 kJ·mol-1
9
反应体系中CO平衡转化率(α)与温度和压强的关系如右图所示。
①α(CO)随温度升高而减小的原因是 。
②图中的p1、p2、p3由大到小的顺序为 。
(3) 亚氯酸钠(NaClO2)和次氯酸钠(NaClO)混合液作为复合吸收剂可脱除烟气中的NOx、SO2,使其转化为NO3-、SO42-。
①写出NO与NaClO2反应的离子方程式: 。
②图甲表示在一定条件下温度与复合吸收剂对烟气中SO2、NO脱除效率的关系。图中SO2比NO脱除效率高的原因可能是 。
甲 乙
③从复合吸收剂吸收烟气后的废液中可回收得到NaHSO4,低温电解NaHSO4水溶液可制备工业上常用的强氧化剂Na2S2O8,原理如图乙所示。电解时电极Ⅰ的电极反应式为 。
21.(12分)“物质结构与性质”
过渡元素铁可形成多种配合物,如[Fe(CN)6]4-、[Fe(OCN)6]4-等。
(1) C、N、O三种元素的第一电离能由大到小的顺序为 ,配合物[Fe(CN)6]4-中π键和σ键的个数比为 。
(2)Cl与Br位于同一主族,写出Br基态核外电子排布式为 。
(3) 研究表明用TiO2作光催化剂可将CN-、CO、N2O、C2H4等氧化为N2、CO2。
C2H4沸点比N2H4低得多,主要原因是 。
(4)C2H4与N2H4在组成上均为A2B2型分子,C2H4与N2H4的中心原子的杂化类型分别
为 、 。
(5) 铁可形成多种功能性材料。右图为铁的一种高韧性、高耐磨性合金的晶体结构,其化学式为 。
9
9
相关文档
- 辽宁省阜新市第二高级中学2019-2022021-07-075页
- 广西省桂林市龙胜中学2019-2020学2021-07-078页
- 【化学】山西省忻州市静乐县静乐一2021-07-0714页
- 化学卷·2018届江西省抚州市崇仁二2021-07-0723页
- 河南省郑州市中牟县第一高级中学202021-07-079页
- 化学卷·2018届甘肃省武威一中高二2021-07-0734页
- 【化学】吉林省长春市第二十九中学2021-07-077页
- 【化学】河南省商丘市第一高级中学2021-07-079页
- 化学卷·2018届陕西省西北大学附属2021-07-0719页
- 甘肃省定西市岷县第二中学2019-2022021-07-078页