- 526.50 KB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
小专题九
化学工艺流程题的突破策略
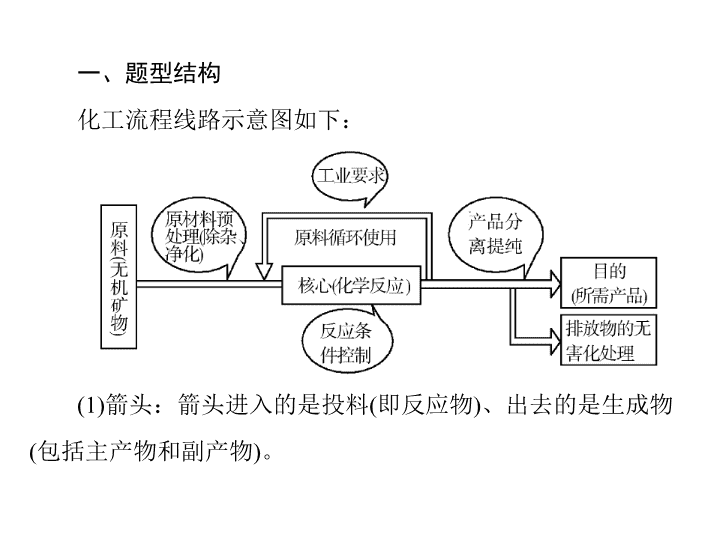
一、题型结构
化工流程线路示意图如下:
(1)
箭头:箭头进入的是投料
(
即反应物
)
、出去的是生成物
(
包括主产物和副产物
)
。
(2)
三线:出线和进线均表示物料流向或操作流程,可逆线
表示该物质循环使用。
(3)
规律:主线主产品,分支副产品,回头为循环。
二、解题方法
(1)
首尾分析法:对线型流程工艺
(
从原料到产品为一条龙的
生产
工序
)
试题,首先对比分析流程图中的第一种物质
(
原材料
)
与最后一种物质
(
产品
)
,从此分析中找出它们的关系,弄清原
料转化的
基本原理和除杂、分离、提纯的化工工艺,再结合题
设问题,逐一解答。
(2)
分段分析法:对于用同样的原料生产多种
(
两种或两种以
上
)
产品
(
含副产品
)
的工艺流程题,用此法更容易找到解题的
切
入点。
(3)
交叉分析法:有些化工生产选用多组原材料,先合成一
种或几种中间产品,再用这一中间产品与部分其他原材料生产
所需的主流产品,这种题适合用交叉分析法。即将提供的流程
示意图结合常见化合物的制取原理划分成几条生产流水线,然
后上下交叉分析。
三、考查角度
角度
1
考查原料预处理方式
1.
研磨、粉碎、喷洒
(1)
可增大反应物的接触面和接触机会,加快反应速率,以
提高原料转化率、利用率、浸取率等。
(2)
增大接触面积的具体措施有:固体采用粉碎、研磨的方
法;液体采用喷洒的方法;气体采用多孔分散器
;等。
2.
浸出
浸出即浸取、溶解,向固体中加入适量溶剂,使其中可溶
性的物质溶解或通过反应进入溶液。浸出可分为水浸、酸浸、
碱浸、醇浸等。
(1)
水浸:是为了分离水溶性和非水溶性的物质;
(2)
酸浸:是为了溶解金属、金属氧化物、调节
pH
促进某
离子的水解而转化为沉淀等;
(3)
碱浸:是为了除去油污、溶解酸性氧化物、溶解铝及其
化合物、调节
pH
等;
(4)
醇浸:为了提取有机物。
3.
灼烧
(
煅烧、焙烧
)
是指在高温下使固体原料分解、反应或改变结构。
4.
搅拌、加热
加速溶解;增大反应物的接触面积,加快反应速率;对于
吸热反应,加热可同时提高原料的转化率,但要避免反应物或
生成物的过热分解。
5.
表面处理
如除去表面油污;金属晶体可用机械法打磨;化学法除去
表面氧化物;等。
角度
2
考查反应条件控制
反应条件
条件内容
调节溶液
的
pH
(1)
目的:使某些金属离子形成氢氧化物沉淀而分离。
(2)
方法:加入能消耗
H
+
的物质且不引入新的杂质。如要除去
Cu
2
+
中混有的
Fe
3
+
,可加入
CuO
、
Cu(OH)
2
、
Cu
2
(OH)
2
CO
3
等来调节溶液的
pH
(
续表
)
反应条件
条件内容
控制温度
(1)
加热:加快反应速率或溶解速率;促进平衡向吸热方向移动;除杂,除去热不稳定的杂质,如
NaHCO
3
、
Ca(HCO
3
)
2
、
KMnO
4
、
NH
4
Cl
等物质;使沸点相对较低或易升华的原料气化。
(2)
降温:防止某物质在高温时溶解
(
或分解
)
;使化学平衡向着题目要求的方向移动
(
放热方向
)
;使某个沸点较高的产物液化,使其与其他物质分离;降低晶体的溶解度,减少损失。
(3)
控温
(
用水浴带温度计便于控温且受热均匀
)
:防止某种物质温度在过高时分解或挥发;为了使某物质达到沸点挥发出来;使催化剂的活性达到最好;防止副反应的发生。
(4)
降温或减压可以减少能源成本,降低对设备的要求,达到绿色化学的要求
反应条件
条件内容
控制压强
改变速率,使平衡向需要的方向移动
使用催化剂
大大提高反应速率、降低能耗,但不影响化学平
衡。使用时必须注意其活性温度,且防止杂质使
催化剂“中毒”,延长使用寿命
(
续表
)
方法
目的
水溶法
除去可溶性杂质
酸溶法
除去碱性杂质
碱溶法
除去酸性杂质
氧化剂或还原剂法
除去还原性或氧化性杂质
加热灼烧法
除去受热易分解或易挥发的杂质
调节
pH
法
如除去酸性铜溶液中的
Fe
3+
等
角度
3
考查混合物的提纯方法
角度
4
考查混合物的分离方法
(1)
过滤
(
趁热过滤或抽滤
)
:分离难溶物和易溶物,根据特
殊需要采用趁热过滤或者抽滤等方法。
(2)
萃取和分液:利用溶质在互不相溶的溶剂里的溶解度不
同提取分离物质,如用
CCl
4
萃取溴水中的溴。
(3)
结晶:蒸发结晶、冷却热饱和溶液。
(4)
蒸馏或分馏:分离沸点不同且互溶的液体混合物,如分
离乙醇和甘油。
(5)
冷却法:利用气体易液化的特点分离气体,如合成氨工
业采用冷却法分离氨气
与氮气、氢气。
角度
5
考查绿色化学
物质的循环利用、废物处理、原子利用率、能量的充分利
用等。
角度
6
考查化工安全
防爆、防污染、防中毒等。
角度
7
考查反应原理
离子反应、氧化还原反应、化学平衡、电离平衡、溶解平
衡、水解原理等。
角度
8
考查循环操作与副产物利用
(1)
对可逆反应:可将未转化的反应物分离出来后送入反应
器重新反应。如合成氨反应是可逆反应,分离氨后的尾气中还
含有大量原料气
(N
2
和
H
2
)
可送入合成塔,实施循环生成。
(2)
若某种物质在流程中既是辅助原料又是副产品
(
既流进
又流出
)
,则可考虑循环利用。
(3)
注意某些隐形存在物质,在循环操作中因累积导致浓度
过高,可能影响
产品的纯度。
[
典例
]
(2018
年北京卷
)
磷精矿湿法制备磷酸的一种工艺
流
程如下:
已知:磷精矿主要成分为
Ca
5
(PO
4
)
3
(OH)
,还含有
Ca
5
(PO
4
)
3
F
和有机碳等。
溶解度:
Ca
5
(PO
4
)
3
(OH)”
或“
<”)
。
②结合元素周期律解释①中结论:
P
和
S
电子层数相同,
_________________________________________________
。
(3)
酸浸时,磷精矿中
Ca
5
(PO
4
)
3
F
所含氟转化为
HF
,并进
一步转化为
SiF
4
除去。写出生成
HF
的化学方程式:
_________________________________________________
。
(4)H
2
O
2
将粗磷酸中的有机碳氧化为
CO
2
脱除,同时自身也
会发生分解。相同投料比、
相同反应时间,不同温度下的有机
碳脱除率如图所示。
80 ℃
后脱除率变化的原因:
__________
_____________________________________________________
。
(5)
脱硫时,
CaCO
3
稍过量,充分反应后仍有
SO
2
-
残留,
原因是
________________
;加入
BaCO
3
可进一步提高硫的脱除
率,其离子方程式是
_____________________________________
____________________________________________________
。
(6)
取
a
g
所得精制磷酸,加适量水稀释,以百里香酚酞作
指示剂,用
b
mol·L
-
1
NaOH
溶液滴定至终点时生成
Na
2
HPO
4
,
消 耗
NaOH
溶 液
c
mL
, 精 制 磷 酸 中
H
3
PO
4
的 质 量分数是
4
________
。
(
已知:
H
3
PO
4
摩尔质量为
98 g·mol
-
1
)
答案:
(1)
研磨、
加热
(2)①
<
②
核电荷数
P
<
S
,原子半径
P
>
S
,得电子能力
P
<
S
,非金属性
P
<
S
(3)2Ca
5
(PO
4
)
3
F
+
10H
2
SO
4
+
5H
2
O===10CaSO
4
·0.5H
2
O
+
6H
3
PO
4
+
2HF↑
(4)80 ℃
后,
H
2
O
2
分解速率大,浓度显著降低
0.049
bc
(6)
a
相关文档
- 2021届湖南四大名校联考新高考模拟2021-07-0719页
- 2019-2020学年河北省邯郸市大名一2021-07-077页
- 四川省广元市利州区川师大万达中学2021-07-079页
- 新疆石河子市第二中学2019-2020学2021-07-074页
- 江苏省五校2019届高三12月联考 地2021-07-076页
- 【化学】湖南省娄底市2019-2020学2021-07-077页
- 【化学】吉林省长春市汽车经济技术2021-07-078页
- 2018-2019学年内蒙古呼和浩特市回2021-07-075页
- 浙江省台州市温岭市箬横中学2019-22021-07-0712页
- 2018-2019学年重庆市万州第二高级2021-07-075页