- 1.94 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
2
讲 离子反应与氧化还原反应
-
2
-
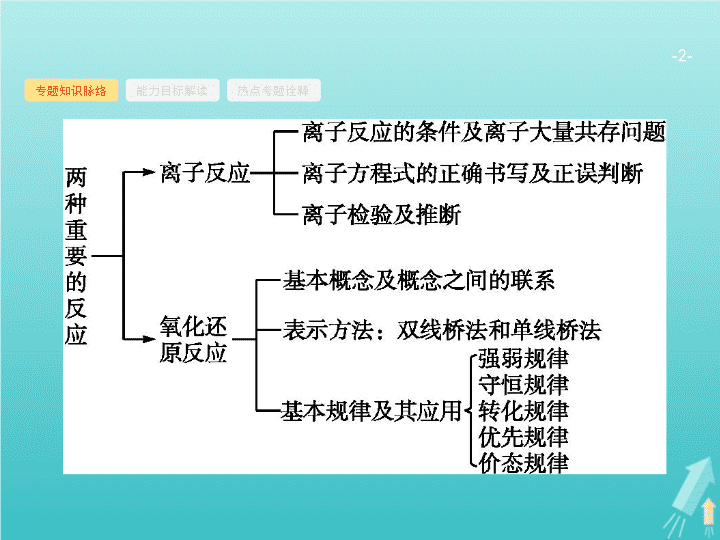
专题知识脉络
能力目标解读
热点考题诠释
-
3
-
专题知识脉络
能力目标解读
热点考题诠释
-
4
-
专题知识脉络
能力目标解读
热点考题诠释
-
5
-
专题知识脉络
能力目标解读
热点考题诠释
-
6
-
专题知识脉络
能力目标解读
热点考题诠释
-
7
-
专题知识脉络
能力目标解读
热点考题诠释
1
.(2019
全国
Ⅰ
)
硼酸
(H
3
BO
3
)
是一种重要的化工原料
,
广泛应用于玻璃、医药、肥料等工业。一种以硼镁矿
(
含
Mg
2
B
2
O
5
·H
2
O
、
SiO
2
及少量
Fe
2
O
3
、
Al
2
O
3
)
为原料生产硼酸及轻质氧化镁的工艺流程如下
:
-
8
-
专题知识脉络
能力目标解读
热点考题诠释
回答下列问题
:
(1)
在
95
℃
“
溶浸
”
硼镁矿粉
,
产生的气体在
“
吸收
”
中反应的化学方程式为
。
(2)“
滤渣
1”
的主要成分有
。为检验
“
过滤
1”
后的滤液中是否含有
Fe
3+
,
可选用的化学试剂是
。
(3)
根据
H
3
BO
3
的解离反应
:
,
K
a
=5.81 ×10
-10
,
可判断
H
3
BO
3
是
酸
;
在
“
过滤
2”
前
,
将溶液
pH
调节至
3.5,
目的是
。
(4)
在
“
沉镁
”
中生成
Mg(OH)
2
·MgCO
3
沉淀的离子方程式为
,
母液经加热后可返回
工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是
。
-
9
-
专题知识脉络
能力目标解读
热点考题诠释
-
10
-
专题知识脉络
能力目标解读
热点考题诠释
-
11
-
专题知识脉络
能力目标解读
热点考题诠释
-
12
-
专题知识脉络
能力目标解读
热点考题诠释
2
.(2016
全国
Ⅰ
)NaClO
2
是一种重要的杀菌消毒剂
,
也常用来漂白织物等
,
其一种生产工艺如下
:
-
13
-
专题知识脉络
能力目标解读
热点考题诠释
回答下列问题
:
(1)NaClO
2
中
Cl
的化合价为
。
(2)
写出
“
反应
”
步骤中生成
ClO
2
的化学方程式
:
。
(3)“
电解
”
所用食盐水由粗盐水精制而成
,
精制时
,
为除去
Mg
2+
和
Ca
2+
,
要加入的试剂分别为
、
。
“
电解
”
中阴极反应的主要产物是
。
(4)“
尾气吸收
”
是吸收
“
电解
”
过程排出的少量
ClO
2
。此吸收反应中
,
氧化剂与还原剂的物质的量之比为
,
该反应中氧化产物是
。
(5)“
有效氯含量
”
可用来衡量含氯消毒剂的消毒能力
,
其定义是
:
每克含氯消毒剂的氧化能力相当于多少克
Cl
2
的氧化能力。
NaClO
2
的有效氯含量为
g
。
(
计算结果保留两位小数
)
-
14
-
专题知识脉络
能力目标解读
热点考题诠释
-
15
-
专题知识脉络
能力目标解读
热点考题诠释
-
16
-
专题知识脉络
能力目标解读
热点考题诠释
-
17
-
专题知识脉络
能力目标解读
热点考题诠释
3
.(1)[2016
全国
Ⅱ
,26(1)]
联氨
(
又称肼
,N
2
H
4
,
无色液体
)
是一种应用广泛的化工原料
,
可用作火箭燃料。联氨分子的电子式为
,
其中氮的化合价为
。
(2)[2016
全国
Ⅱ
,28(1)]
在
FeCl
2
溶液中需加入少量铁屑
,
其目的是
。
(3)[2015
全国
Ⅰ
,28(1)]
大量的碘富集在海藻中
,
用水浸取后浓缩
,
再向浓缩液中加
MnO
2
和
H
2
SO
4
,
即可得到
I
2
。该反应的还原产物为
。
(4)[2014
全国
Ⅰ
,27(2)]
次磷酸
(H
3
PO
2
)
是一种精细磷化工产品
,
具有较强还原性。
H
3
PO
2
及
NaH
2
PO
2
均可将溶液中的
Ag
+
还原为银
,
从而可用于化学镀银。
H
3
PO
2
中
,P
元素的化合价为
。
-
18
-
专题知识脉络
能力目标解读
热点考题诠释
-
19
-
专题知识脉络
能力目标解读
热点考题诠释
-
20
-
命题热点一
命题热点二
命题热点三
命题热点四
离子方程式的书写
有关离子方程式书写的思维路径
-
21
-
命题热点一
命题热点二
命题热点三
命题热点四
问题探究
1
.
书写离子方程式有哪些基本要求
?
(1)
合事实
:
离子反应要符合客观事实
,
不可臆造产物及反应。
(2)
式正确
:
化学式与离子符号使用正确合理。
(3)
号实际
:
“↑”“↓”
等符号符合实际。
(4)
三守恒
:
两边原子数、电荷数必须守恒
,
属于氧化还原反应的离子方程式中氧化剂得电子总数与还原剂失电子总数要相等。
(5)
明类型
:
依据离子反应原理
,
分清类型
,
总结方法技巧。
(6)
细检查
:
结合书写离子方程式过程中易出现的错误
,
细心检查。
-
22
-
命题热点一
命题热点二
命题热点三
命题热点四
2
.
如何判断离子反应的先后顺序
?
(1)
氧化还原型离子反应。
同一氧化剂
(
或还原剂
)
可能与多种还原剂
(
或氧化剂
)
反应
,
书写此类反应离子方程式应按如下程序
:
确定氧化剂
(
或还原剂
)
强弱顺序
→
判断反应顺序
→
据题给数据确定离子反应。
(2)
复分解型离子反应。
如某溶液中含有
Al
3+
、
、
H
+
,
向该溶液中逐滴加入
NaOH
溶液
,OH
-
先与
H
+
反应
,
再与
Al
3+
反应生成
Al(OH)
3
,
最后与
反应。判断方法采用
“
假设验证法
”:
假设某种离子先反应
,
若生成产物与其他成分能共存
,
则该离子优先反应
,
否则该离子不能优先反应。
-
23
-
命题热点一
命题热点二
命题热点三
命题热点四
例
1
Li
4
Ti
5
O
12
和
LiFePO
4
都是锂离子电池的电极材料
,
可利用钛铁矿
(
主要成分为
FeTiO
3
,
还含有少量
MgO
、
SiO
2
等杂质
)
来制备。工艺流程如下
:
“
酸浸
”
后
,
钛主要
以
形式存在
,
写出相应反应的离子方程式
。
-
24
-
命题热点一
命题热点二
命题热点三
命题热点四
分析推理
(1)“
酸浸
”
前
,
钛铁矿主要成分是什么
?
钛铁矿的主要成分为
FeTiO
3
。
(2)“
酸浸
”
后
,
钛主要以
的形式存在
,
元素化合价有变化吗
?
元素化合价无变化。
(3)
书写离子方程式的过程中
,
应考虑哪些守恒
?
原子守恒、电荷守恒等。
由以上分析
,
再结合酸性环境
,
配平方程式可得
:
-
25
-
命题热点一
命题热点二
命题热点三
命题热点四
题后反思
工艺流程中的离子方程式书写方法
1
.
细读题干寻找提纯对象
,
结合工艺流程示意图分析被提纯元素的存在形式及杂质的去除情况。
2
.
确定未知反应的反应物离子和生成物离子
,
根据题意分析溶液环境
,
配平离子方程式。
-
26
-
命题热点一
命题热点二
命题热点三
命题热点四
对点训练
1
(1)
已知
ClO
2
在碱性溶液中生成亚氯酸盐和氯酸盐的混合物
,
其离子方程式为
。
(2)
铈是一种重要的稀土金属元素
,
以下是其重要化合物
Ce(OH)
4
的一种制备方法
:
(
注
:
高铈是指溶液中铈元素的化合价为
+4
价
)
①
写出加入氨水时发生反应的离子方程式
:
。
②
“
氧化
”
过程若用
NaClO
代替
O
2
,
写出该反应的离子方程式
:
。
-
27
-
命题热点一
命题热点二
命题热点三
命题热点四
(3)
金属
Mg
与
CH
3
Cl
在一定条件下反应可生成
CH
3
MgCl
, CH
3
MgCl
是一种重要的有机合成试剂
,
易与水发生水解反应并有无色无味气体和沉淀生成。写出
CH
3
MgCl
水解的离子方程式
:
。
解析
(2)
①
加入氨水
,Ce
3+
转化成
Ce(OH)
3
沉淀。
②
ClO
-
把
Ce(OH)
3
氧化为
Ce(OH)
4
,
离子方程式为
2Ce(OH)
3
+ClO
-
+H
2
O 2Ce(OH)
4
+2Cl
-
。
(3)CH
3
MgCl
水解生成甲烷气体、氢氧化镁沉淀和氯化镁。
-
28
-
命题热点一
命题热点二
命题热点三
命题热点四
离子共存
以离子共存为中心的解题思维路径
-
29
-
命题热点一
命题热点二
命题热点三
命题热点四
-
30
-
命题热点一
命题热点二
命题热点三
命题热点四
-
31
-
命题热点一
命题热点二
命题热点三
命题热点四
2
.
判断离子能否大量共存时有哪几种隐含陷阱
?
(1)
离子颜色。
若限定溶液无色
,
则
Cu
2+
、
Fe
2+
、
Fe
3+
、
等有色离子不能大量存在
。
-
32
-
命题热点一
命题热点二
命题热点三
命题热点四
(
2)
溶液酸、碱性。
-
33
-
命题热点一
命题热点二
命题热点三
命题热点四
(3)
溶液中隐含情况。
-
34
-
命题热点一
命题热点二
命题热点三
命题热点四
例
2
下列离子组在指定的反应体系中能大量存在的是
(
)
-
35
-
命题热点一
命题热点二
命题热点三
命题热点四
答案
C
-
36
-
命题热点一
命题热点二
命题热点三
命题热点四
题后反思
(1)
发生相互促进水解反应的各种离子均不能大量共存。
(2)
注意与量有关的反应体系中
,
离子类型的判断。
(3)
注意隐含的有氧化性的物质。
-
37
-
命题热点一
命题热点二
命题热点三
命题热点四
B
解析
A
项
,
溶液中可能是酸性或碱性
,
铵根离子在碱性条件下不能大量存在
,
碳酸氢根离子与氢离子或氢氧根离子都能反应而不能大量存在
;B
项
,
溶液为碱性
,
四种离子不反应
,
能大量共存
;C
项
,
铁离子和碘离子发生氧化还原反应而不能大量共存
,Fe
3+
与
SCN
-
不能大量共存
;D
项
,
高锰酸根离子为紫色。
-
38
-
命题热点一
命题热点二
命题热点三
命题热点四
氧化还原反应的概念与规律
应用有关氧化还原反应概念解题的思维路径
-
39
-
命题热点一
命题热点二
命题热点三
命题热点四
问题探究
1
.
如何比较氧化性、还原性的强弱
?
物质氧化性、还原性的强弱取决于元素原子得失电子的难易程度
,
与得失电子的数目无关。判断氧化性、还原性的强弱常用的方法有
:
(1)
根据金属活动性顺序进行判断。金属单质的还原性越强
,
其对应阳离子的氧化性越弱。
-
40
-
命题热点一
命题热点二
命题热点三
命题热点四
(2)
根据元素周期律判断。非金属单质的氧化性越强
,
其对应阴离子的还原性越弱。
(3)
根据氧化还原反应方程式判断。
氧化性为氧化剂
>
氧化产物
;
还原性为还原剂
>
还原产物。
-
41
-
命题热点一
命题热点二
命题热点三
命题热点四
2
.
氧化还原反应的规律有哪些
?
(1)
守恒律。
化合价升高总数与降低总数相等
,
实质是反应中失电子总数与得电子总数相等。该规律可应用于氧化还原反应方程式的配平及相关计算等。
(2)
强弱律。
氧化性
:
氧化剂
>
氧化产物。
还原性
:
还原剂
>
还原产物。
强弱律的应用
:
在适宜条件下
,
用氧化性
(
或还原性
)
较强的物质可制备氧化性
(
或还原性
)
较弱的物质
;
用于比较物质的氧化性或还原性的强弱。
-
42
-
命题热点一
命题热点二
命题热点三
命题热点四
-
43
-
命题热点一
命题热点二
命题热点三
命题热点四
例
3
根据表中信息判断
,
下列选项正确的是
(
)
A.
第
①
组反应的其余产物只有
O
2
B.
第
②
组反应中
Cl
2
与
FeBr
2
的物质的量之比为
1
∶
2
C.
第
③
组反应中生成
1 mol Cl
2
,
转移电子
10 mol
D.
氧化性由强到弱的顺序为
Mn
>Cl
2
>Fe
3+
>Br
2
-
44
-
命题热点一
命题热点二
命题热点三
命题热点四
分析推理
(1)
①
组反应中
,
根据氢原子守恒
,
判断还应生成何种产物
?
还应有
H
2
O
生成。
(2)
③
组反应中
,Mn
元素化合价降低
,
而
Cl
元素的化合价应如何变化
?Cl
2
是由
Cl
-
被氧化得到的吗
?
③
组中的反应是
Mn
氧化了
Cl
-
,Cl
的化合价由
-1
价升高到
0
价
,
则生成
1molCl
2
,
转移电子为
2mol
。
(3)
由
②
组反应判断
,Fe
3+
能氧化
Br
-
吗
?
由
②
组反应可知
,Fe
3+
不能氧化
Br
-
,
所以氧化性
:Br
2
>Fe
3+
。
答案
B
-
45
-
命题热点一
命题热点二
命题热点三
命题热点四
题后反思
(1)
应在具体的反应中来比较氧化性和还原性强弱
,
因为即使相同的物质其氧化性和还原性也会因浓度、反应条件的改变而改变。
(2)
可以通过氧化性
(
或还原性
)
强弱来判断反应发生的可能性
,
即
:
氧化性
(
或还原性
)
强的物质通过反应能得到氧化性
(
或还原性
)
弱的物质
,
其反应规律类似于我们平时所说的强酸制弱酸。
-
46
-
命题热点一
命题热点二
命题热点三
命题热点四
答案
解析
解析
关闭
三个反应中元素化合价升高所得到的产物分别是
I
2
、
Fe
3+
、
Cl
2
,
它们是氧化产物
,A
项错误
;
氧化还原反应中
,
氧化性
:
氧化剂
>
氧化产物。在反应①中
,
氧化性
:Cl
2
>Fe
3+
>I
2
。在反应②中
,
氧化性
:Br
2
>Fe
3+
。在反应③中
,
氧化性
:Co
2
O
3
>Cl
2
。所以氧化性顺序是
Co
2
O
3
>Cl
2
>Br
2
>Fe
3+
,B
项正确
;
根据氧化性顺序
:Cl
2
>Br
2
>Fe
3+
。
Cl
2
和
FeBr
2
反应时
,
氯气既能氧化
Br
-
又能氧化
Fe
2+
,
所以还可能生成
Fe
3+
和
Br
2
,C
项错误
;
在反应③中生成
1 mol Cl
2
时
,
有
6 mol
的
HCl
参加反应
,
其中
2 mol HCl
被氧化
,
故
D
项错误。
答案
解析
关闭
B
-
47
-
命题热点一
命题热点二
命题热点三
命题热点四
陌生氧化还原反应方程式的书写
有关氧化还原反应方程式书写的思维路径
-
48
-
命题热点一
命题热点二
命题热点三
命题热点四
问题探究
1
.
如何配平缺项氧化还原反应方程式
?
(1)
方法
:
先用
“
化合价升降法
”
配平含有变价元素的物质的化学计量数
,
然后由原子守恒确定未知物
,
再根据原子守恒进行配平。
(2)
补项原则
:
-
49
-
命题热点一
命题热点二
命题热点三
命题热点四
2
.
氧化还原反应方程式的配平有哪些步骤
?
第
1
步
:
根据氧化还原顺序规律确定氧化性最强的为氧化剂
,
还原性最强的为还原剂
;
根据化合价规律及题给信息和已知元素化合物性质确定相应的还原产物、氧化产物
;
根据氧化还原反应的守恒规律确定氧化剂、还原剂、还原产物、氧化产物的相应化学计量数。
第
2
步
:
根据溶液的酸碱性
,
通过在方程式的两端添加
H
+
或
OH
-
的形式使方程式两端的电荷守恒。
第
3
步
:
根据原子守恒
,
通过在方程式两端添加
H
2
O(
或其他小分子
)
使方程式两端的原子守恒。
-
50
-
命题热点一
命题热点二
命题热点三
命题热点四
例
4
已知工业盐中含有
NaNO
2
,
外观和食盐相似
,
有咸味
,
人若误食会引起中毒
,
致死量为
0.3~0.5 g
。已知
NaNO
2
能发生如下反应
(
方程式已配平
):
,
请回答下列问题
:
(1)
上述反应中
,
x
=
,
y
=
,
z
=
,
氧化剂是
。
(3)
若反应过程中转移
0.5 mol
电子
,
则生成标准状况下的
N
2
体积为
。
-
51
-
命题热点一
命题热点二
命题热点三
命题热点四
答案
(1)2
4
2
(2)10
6
4
10
NaAlO
2
3
2
(3)1.12 L
-
52
-
命题热点一
命题热点二
命题热点三
命题热点四
对点训练
4
(1)PbO
2
与浓盐酸共热生成黄绿色气体
,
反应的化学方程式为
。
(2)KClO
3
可以与草酸
(H
2
C
2
O
4
)
、硫酸反应生成高效的消毒杀菌剂
ClO
2
,
还生成
CO
2
和
KHSO
4
等物质。写出该反应的化学方程式
:
。
(3)
请配平下列化学方程式
:
-
53
-
命题热点一
命题热点二
命题热点三
命题热点四
-
54
-
命题热点一
命题热点二
命题热点三
命题热点四
(4)
根据题意
,
氯酸钠氧化酸性的氯化亚铁
,
则反应物中有氢离子参加
,
则生成物中有水生成
,Cl
元素的化合价从
+5
价降低到
-1
价
,
得到
6
个电子
,
而
Fe
元素的化合价从
+2
价升高到
+3
价
,
失去
1
个电子
,
根据得失电子守恒
,
则氯酸根离子的化学计量数为
1,Fe
2+
的化学计量数为
6,
则铁离子的化学计量数也是
6,
氯离子的化学计量数是
1,
根据电荷守恒
,
则氢离子的化学计量数是
6,
水的化学计量数是
3
。
-
55
-
A
D
-
56
-
C
解析
Al
3+
、
发生
相互促进的水解反应
,
不能大量共存
,A
错误
; Fe
3
+
、
I
-
因发生氧化还原反应而不能大量共存
,B
错误
;H
+
、
Ca
2+
能与
F
-
反应生成难电离的
HF
和难溶于水的
CaF
2
,
不能大量共存
,D
错误。
-
57
-
B
解析
Fe
3+
是氧化产物
,A
项错
;
还原剂还原性强于还原产物
,B
项对
; Fe(SCN)
3
溶于水
,C
项错
;
根据元素守恒和转移电子个数守恒配平方程式
:2KMnO
4
+10FeSO
4
+8H
2
SO
4
K
2
SO
4
+2MnSO
4
+5Fe
2
(SO
4
)
3
+8H
2
O
,
生成
8
mol
水时
,
转移
10
mol
电子
,
故生成
1
mol
水时
,
转移
1.25
mol
电子
,D
项错。
-
58
-
5
.
实验小组制备高铁酸钾
(K
2
FeO
4
)
并探究其性质。
资料
:K
2
FeO
4
为紫色固体
,
微溶于
KOH
溶液
;
具有强氧化性
,
在酸性或中性溶液中快速产生
O
2
,
在碱性溶液中较稳定。
(1)
制备
K
2
FeO
4
(
夹持装置略
)
。
-
59
-
①
A
为氯气发生装置。
A
中反应的方程式是
(
锰被还原为
Mn
2+
)
。
②
将除杂装置
B
补充完整并标明所用试剂。
③
C
中得到紫色固体和溶液
,C
中
Cl
2
发生的反应有
3Cl
2
+2Fe(OH)
3
+10KOH
2K
2
FeO
4
+6KCl+8H
2
O,
另外还有
。
-
60
-
(2)
探究
K
2
FeO
4
的性质。
①
取
C
中紫色溶液
,
加入稀硫酸
,
产生黄绿色气体
,
得溶液
a,
经检验气体中含有
Cl
2
。为证明是否为
K
2
FeO
4
氧化了
Cl
-
而产生
Cl
2
,
设计以下方案
:
ⅰ
.
由方案
Ⅰ
中溶液变红可知
a
中含有
(
离子
),
但该离子的产生不能判断一定是
K
2
FeO
4
将
Cl
-
氧化
,
还可能由
(
用离子方程式表示
)
产生。
ⅱ
.
方案
Ⅱ
可证明
K
2
FeO
4
氧化了
Cl
-
。用
KOH
溶液洗涤的目的是
。
-
61
-
-
62
-
-
63
-
相关文档
- 2020届一轮复习鲁科版第2章第4讲电2021-07-0811页
- 高考化学第一轮复习课件第2讲 离2021-07-087页
- 2021版浙江高考选考化学一轮复习教2021-07-0829页
- 2021版江苏新高考选考化学(苏教版)一2021-07-0812页
- 2021版新高考地区选考化学(人教版)一2021-07-0812页
- 2021版新高考化学一轮复习专题8水2021-07-0751页
- 离子反应教案(1)2021-07-073页
- 2018届一轮复习苏教版离子反应离子2021-07-0715页
- 2021新高考化学鲁科版一轮复习同步2021-07-0713页
- 2020届高考化学二轮复习离子反应的2021-07-077页