- 2.05 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第六单元 化学反应与能量变化
考纲参照
(1)了解化学反应中能量转化的原因及常见的能量转化形式
(2)了解化学能与热能的相互转化;了解吸热反应、放热反应、反应热等概念
(3)了解热化学方程式的含义,能正确书写热化学方程式
(4)了解能源是人类生存和社会发展的重要基础;了解化学在解决能源危机中的重要作用
(5)了解焓变(ΔH)与反应热的含义
(6)理解盖斯定律,并能运用盖斯定律进行有关反应焓变的计算
(7)理解原电池和电解池的构成、工作原理及应用,能书写电极反应式和总反应方程式;了解常见化学电源的种类及其工作原理
(8)了解金属发生电化学腐蚀的原因、金属腐蚀的危害以及防止金属腐蚀的措施
考情回顾
近两年全国卷命题涉及的知识点主要有:热化学方程式的书写和正误判断、利用盖斯定律进行简单的计算、电极反应式的书写和判断、金属腐蚀的原因及防护措施、电解原理的应用和进行简单的有关计算等。题型有选择题、实验题、化学反应原理综合题等
课时安排
本单元内容共3讲,课堂讲解可安排4~5课时的时间
第1讲 化学能与热能
见《自学听讲》P101
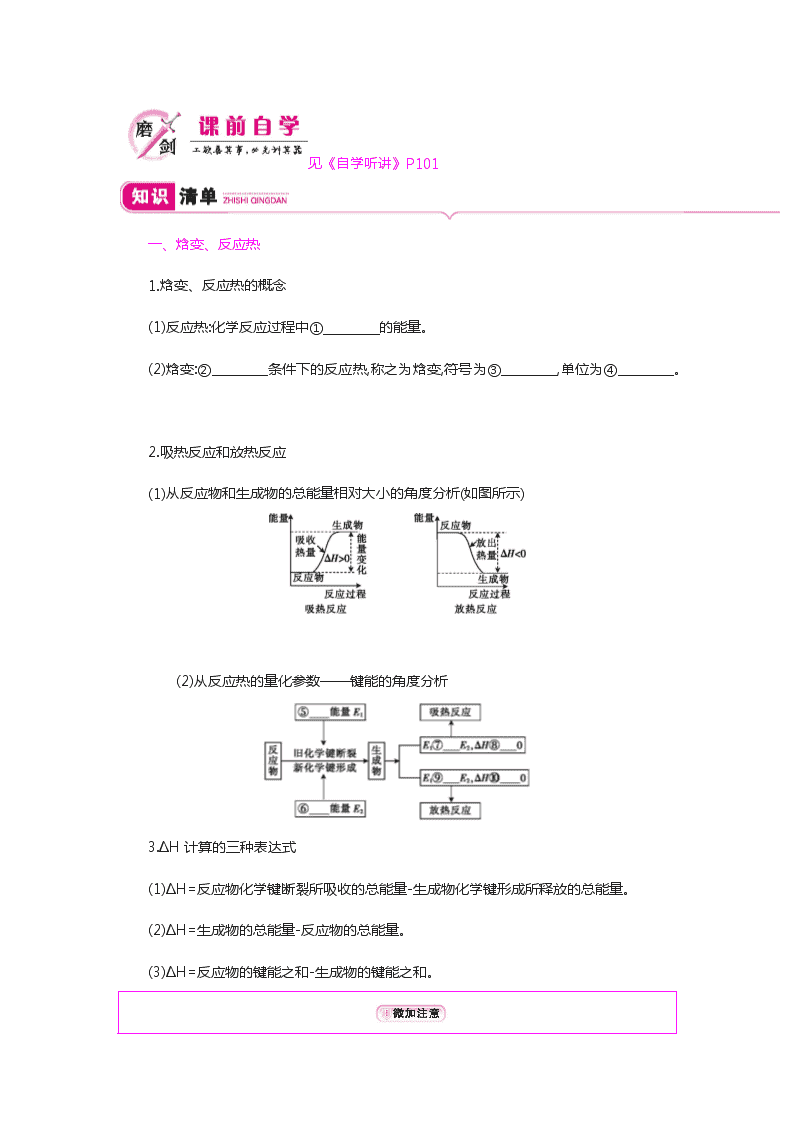
一、焓变、反应热
1.焓变、反应热的概念
(1)反应热:化学反应过程中① 的能量。
(2)焓变:② 条件下的反应热,称之为焓变,符号为③ ,单位为④ 。
2.吸热反应和放热反应
(1)从反应物和生成物的总能量相对大小的角度分析(如图所示)
(2)从反应热的量化参数——键能的角度分析
3.ΔH计算的三种表达式
(1)ΔH=反应物化学键断裂所吸收的总能量-生成物化学键形成所释放的总能量。
(2)ΔH=生成物的总能量-反应物的总能量。
(3)ΔH=反应物的键能之和-生成物的键能之和。
1.物质的物理变化过程中,也会有能量的变化,不属于吸热反应或放热反应。但在进行反应热的有关计算时,必须考虑到物理变化时的热效应,如物质的三态间变化。
2.吸热反应和放热反应与反应所发生的外界条件无必然联系。有的吸热反应[如NH4Cl与Ba(OH)2·8H2O的反应]在常温下即可进行,而很多放热反应需要在加热的条件下才能进行。
3.同一反应的ΔH不因反应条件的改变而改变。
4.比较ΔH的大小时须考虑正负号,对于放热反应,放热越多,ΔH 越小;对于吸热反应,吸热越多,ΔH越大。
二、热化学方程式
1.概念:能表示参加反应 和 的关系的化学方程式。
2.意义:不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。例如:H2(g)+12O2(g)H2O(l) ΔH=-285.8 kJ·mol-1,表示在25 ℃、1.01×105 Pa下,1 mol H2(g)与0.5 mol O2(g)完全反应生成 1 mol H2O(l)时 热量 。
3.书写热化学方程式的步骤和注意事项
(1)书写步骤
一写:写出配平的化学方程式;
二注:注明物质的聚集状态;
三写:写出ΔH的数值、单位及符号。
(2)注意事项
a.注明测定ΔH的条件
反应热(ΔH)与测定条件(温度、压强等)有关,但大多数ΔH是在25 ℃、101 kPa下测定的,此时可不注明温度和压强。
b.注明物质的聚集状态
物质有三态变化——固态→液态→气态,转化过程需吸收热量;反之,需放出热量。所以同一物质处于不同状态时能量是不同的。化学反应中物质的状态不同,能量变化不同,则反应热ΔH也不同。因此,要在物质的化学式后面用括号注明各物质的聚集状态,一般用英文字母g、l和s分别表示气态、液态和固态,水溶液中的溶质则用aq表示。
c.注明ΔH的数值、单位及正负号
ΔH为“-”是放热反应,ΔH为“+”是吸热反应,正、负号不可丢掉,单位是kJ·mol-1。
d.注意化学计量数
热化学方程式中的化学计量数只代表物质的量,不表示微粒数,因此,可为整数,也可为分数。
e.区别于普通化学方程式:一般不标注“↑”“↓”以及“点燃”“加热”等反应条件。
三、燃烧热和中和热
1.燃烧热
2.中和热
3.中和反应反应热的测定
(1)装置
(2)50 mL 0.55 mol·L-1 NaOH溶液和50 mL 0.50 mol·L-1稀盐酸混合反应。
(3)计算公式:ΔH=-0.418(t2-t1)0.025 kJ·mol-1
t1——起始温度,t2——终止温度(反应过程中最高温度)
(4)注意事项
a.泡沫塑料板和碎泡沫塑料(或纸条)的作用是 。
b.为保证酸完全被NaOH中和,可采取的措施是 。
1.燃烧热是指1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。如C生成的为CO2,而不是CO;H2燃烧生成的是H2O(l)而不是H2O(g)。
2.中和热不包括离子在水溶液中的生成热、物质的溶解热、电解质电离时的热效应。中和热是强酸、强碱的稀溶液反应生成1 mol H2O时放出的热量,其值为57.3 kJ·mol-1。弱酸、弱碱电离时吸热,与碱中和时放出的热量小于57.3 kJ,浓硫酸稀释时放热,故放出的热量大于57.3 kJ。 3.对于中和热、燃烧热,由于它们的反应放热是确定的,所以描述中不带“-”,但焓变为负值。
4.中和热测定时,使用两个量筒分别量取酸和碱。用同一支温度计,先后测量酸、碱及混合液的最高温度时,应在测完一种溶液温度后,用水冲洗干净并用滤纸擦干,再测下一种溶液的温度。
5.取多次实验t1、t2的平均值代入公式计算,而不是多次结果的平均值,计算时应注意单位的统一。
四、盖斯定律
1.内容
对于一个化学反应,无论是一步完成还是分几步完成,其反应热都是一样的。即化学反应的反应热只与反应体系的 有关,而与 无关。
2.意义:间接计算某些反应的反应热。
3.应用
化学方程式
反应热间的关系
aAB ΔH1
A1aB ΔH2
ΔH2=1aΔH1或ΔH1=aΔH2
aAB ΔH1
BaA ΔH2
ΔH1=-ΔH2
ΔH=ΔH1+ΔH2
五、能源
1.可再生能源:在自然界中可以不断再生的能源,具有取之不尽、用之不竭的特点。如太阳能、风能、水能、生物质能、地热能和海洋能等。
2.不可再生能源:人类开发利用后,在现阶段不可能再生的能源。如煤、石油、天然气等。
3.一次能源:从自然界取得未经改变或转变而直接利用的能源。如煤、原油、天然气、水能、风能、太阳能、海洋能、潮汐能、地热能、天然铀矿等。
4.二次能源:由一次能源经过加工转换以后得到的能源。如电力、蒸汽、煤气、汽油、柴油、重油、液化石油气、酒精、沼气、氢气和焦炭等。
①吸收或放出 ②恒压 ③ΔH ④kJ·mol-1 ⑤吸收
⑥放出 ⑦> ⑧> ⑨< ⑩< 物质的量
反应热 放出 285.8 kJ 1 mol 稳定的氧化物 kJ·mol-1 1 mol C CO2 C(s)+O2(g)CO2(g) ΔH=-393.5 kJ·mol-1
负 1 mol H2O kJ·mol-1 H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ·mol-1
小 环形玻璃搅拌棒 温度计 隔热、保温,减少实验过程中的热量损失 碱稍过量 始态和终态
反应途径 煤 石油 天然气 可再生
1.物质能量与反应吸、放热之间的两个关系
(1)E(反应物)>E(生成物),放热反应,ΔH<0。
(2)E(反应物)0。
2.明确热化学方程式书写与判断的四点注意事项
(1)标明物质的聚集状态。
(2)ΔH的符号与单位。
(3)ΔH的数值与化学计量数是否对应。
(4)燃烧热、中和热等条件的限制。
3.运用盖斯定律求反应热的计算技巧——“三调一加”
一调:根据目标热化学方程式,调整已知热化学方程式反应物和生成物的左右位置,改写已知的热化学方程式。
二调:根据改写的热化学方程式调整相应ΔH的符号。
三调:调整中间物质的化学计量数。
一加:将调整好的热化学方程式及其ΔH加起来。
4.计算反应热的注意事项
(1)热化学方程式乘以某一个数时,反应热的数值必须乘上该数。
(2)热化学方程式相加减时,物质之间相加减,反应热也必须相加减。
(3)将一个热化学方程式颠倒时,ΔH的“+”“-”随之改变,但数值不变。
见《自学听讲》P104
焓变 反应热
1.判断正误(正确的打“√”,错误的打“×”)。
(1)放热反应不加热就能反应,吸热反应不加热就不能反应。( )
(2)物质发生化学变化的同时都伴有能量的变化。( )
(3)活化能越大,表示反应物旧化学键断裂吸收的能量越高。( )
(4)吸热反应中,反应物化学键断裂吸收的总能量高于生成物形成化学键放出的总能量。( )
(5)同温同压下,反应H2(g)+Cl2(g)2HCl(g)在光照和点燃条件下的ΔH不同。( )
(6)S(s)+32O2(g)SO3(g) ΔH=-315 kJ·mol-1(燃烧热) (ΔH的数值正确)。( )
(7)葡萄糖的燃烧热是2800 kJ·mol-1,则12C6H12O6(s)+3O2(g)3CO2(g)+3H2O(l) ΔH=-1400 kJ·mol-1。( )
(8)NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1(中和热) (ΔH的数值正确)。( )。
(9)已知稀溶液中,H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ·mol-1,则稀醋酸与稀氢氧化钠溶液反应生成1 mol 水时放出57.3 kJ的热量。( )。
(10)已知H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(-57.3) kJ·mol-1。( )。
答案 (1)× (2)√ (3)√ (4)√ (5)× (6)× (7)√ (8)√ (9)× (10)×
2.如图表示某反应的能量变化,按要求回答下列问题:
(1)该反应是 (填“放热”或“吸热”)反应。
(2)该反应的ΔH= 。
(3)使用催化剂 (填“能”或“不能”)影响该反应的反应热。
(4)逆反应的活化能可表示为 。
答案 (1)放热
(2)E2-E1
(3)不能
(4)E3-E2
3.已知氯气、溴蒸气分别与氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)2HCl(g) ΔH=-Q1 kJ·mol-1
H2(g)+Br2(g)2HBr(g) ΔH=-Q2 kJ·mol-1
根据上述反应,下列判断正确的是( )。
A.Q1>Q2
B.生成物的总能量均高于反应物的总能量
C.生成1 mol HCl(g)放出Q1 kJ热量
D.等物质的量时,Br2(g)具有的能量低于Br2(l)
解析 生成的气态氢化物越稳定,放出的热量越多,A项正确;两个反应均为放热反应,所以生成物的总能量均低于反应物的总能量,B项错误;生成2 mol HCl(g)放出Q1 kJ热量,C项错误;等物质的量时,Br2(g)具有的能量高于Br2(l),D项错误。
答案 A
4.反应A+BC(ΔH<0)分两步进行:①A+BX(ΔH>0);②XC(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )。
解析 由A+BX ΔH>0可知,X的能量比A和B的能量之和大;由XC ΔH<0可知,C的能量比X的能量小,又由A+BC ΔH<0可知,C的能量比A和B的能量之和小,分析图像可知,D项正确。
答案 D
一、正确理解活化能与反应热的关系
1.催化剂能降低反应所需活化能,但不影响焓变的大小。
2.在无催化剂的情况下,E1为正反应的活化能,E2为逆反应的活化能,即E1=E2+|ΔH|。
二、反应热答题规范指导
1.描述反应热时,无论是用“反应热”“焓变”表示还是用ΔH表示,其后所跟数值都需要带“+”“-”号。如:某反应的反应热(或焓变)为ΔH=-Q kJ·mol-1或ΔH=+Q kJ·mol-1。
2.由于中和反应和燃烧均是放热反应,因此表示中和热和燃烧热时可不带“-”号。如:某物质的燃烧热为Q kJ·mol-1或ΔH=-Q kJ·mol-1。
1.(2018年山东济南模拟)下列说法中正确的是( )。
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,该反应为吸热反应
C.生成物的总焓大于反应物的总焓时,反应吸热,ΔH>0
D.使用高效催化剂能改变反应的活化能和反应热
解析 物质变化与能量变化是化学反应的两大特征,A项错误;破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,该反应为放热反应,B项错误;催化剂只能改变反应的路径,降低活化能,不能改变反应热,D项错误。
答案 C
2.某反应由两步反应ABC构成,反应过程中能量变化曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是( )。
A.两步反应均为吸热反应
B.加入催化剂会改变反应的焓变
C.三种物质中C最稳定
D.反应AC中ΔH=E1-E2
解析 A项,反应AB为吸热反应,反应BC为放热反应,错误;B项,加入催化剂,只改变反应的活化能,不改变反应的焓变,错误;C项,物质的总能量越低,越稳定,正确;D项,AB:ΔH=E1-E2,BC:ΔH=E3-E4,所以反应AC的ΔH=E1-E2+E3-E4=(E1+E3)-(E2+E4),错误。
答案 C
3.下列依据热化学方程式得出的结论正确的是( )。
A.已知NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ
B.已知2H2(g)+O2(g)2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
C.已知2C(s)+2O2(g)2CO2(g) ΔH=a kJ·mol-1
2C(s)+O2(g)2CO(g) ΔH=b kJ·mol-1,则a>b
D.已知C(石墨,s)C(金刚石,s) ΔH>0,则石墨的稳定性不如金刚石的
解析 醋酸是弱酸,其电离过程吸热,含40.0 g(1 mol)NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ,A项正确;氢气的燃烧热必须是生成液态水的过程所放出的热量,液态水变为气态水是吸热过程,故氢气的燃烧热大于241.8 kJ·mol-1,B项错误;焦炭完全燃烧放出的热量高于不完全燃烧放出的热量,因反应放热,焓变是负值,则aΔH2
解析 表示燃烧热的热化学方程式中水的状态是液态,A项错误;物质能量越低越稳定,此反应是放热反应,红磷的能量低于白磷,红磷比白磷稳定,B项正确;NaOH固体遇水放热,因此20.0 g NaOH固体与稀盐酸完全中和放出的热量大于28.65 kJ,C项错误;所有的燃烧都是放热反应,即ΔH<0,CO燃烧生成CO2,因此ΔH1<ΔH2,D项错误。
答案 B
3.写出下列反应的热化学方程式
(1)一定量N2(g)与一定量H2(g)在一定条件下反应生成2 mol NH3(g),放出热量92.2 kJ。 。
(2)14 g N2(g)与适量的O2(g)在一定条件下反应生成NO(g),吸收热量34 kJ。 。
(3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2 g SiH4自燃放出热量89.2 kJ。SiH4自燃的热化学方程式为 。
(4)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为 。
(5)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是 。
答案 (1)N2(g)+3H2(g)2NH3(g) ΔH=-92.2 kJ·mol-1
(2)N2(g)+O2(g)2NO(g) ΔH=+68 kJ·mol-1
(3)SiH4(g)+2O2(g)SiO2(s)+2H2O(l) ΔH=-1427.2 kJ·mol-1
(4)C2H5OH(l)+3O2(g)2CO2(g)+3H2O(l) ΔH=-2Q kJ·mol-1
(5)4CuCl(s)+O2(g)2CuCl2(s)+2CuO(s) ΔH=-177.6 kJ·mol-1
有关反应热的比较、计算
1.判断正误(正确的打“√”,错误的打“×”)
(1)一个反应一步完成或几步完成,二者相比,经过的步骤越多,放出的热量越多。( )
(2)由H2(g)+12O2(g)H2O(g) ΔH=-a kJ·mol-1可知,1 g H2燃烧生成H2O(g)放出的热量为a kJ。( )
(3)H—H、OO和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则反应H2(g)+12O2(g)H2O(g)的ΔH=-916 kJ·mol-1。( )
(4)已知C(s)+O2(g)CO2(g) ΔH1;C(s)+H2O(g)H2(g)+CO(g) ΔH2;H2(g)+12O2(g)H2O(g) ΔH3;CO(g)+12O2(g)CO2(g) ΔH4;则ΔH1=ΔH2+ΔH3+ΔH4。( )
(5)已知S(g)+O2(g)SO2(g) ΔH1<0,S(s)+O2(g)SO2(g) ΔH2<0,则ΔH1<ΔH2。( )
(6)已知C(s)+O2(g)CO2(g) ΔH1<0,C(s)+12O2(g)CO(g) ΔH2<0,则ΔH1>ΔH2。( )
答案 (1)× (2)× (3)× (4)√ (5)√ (6)×
2.已知:2H2(g)+O2(g)2H2O(g) ΔH1
3H2(g)+Fe2O3(s)2Fe(s)+3H2O(g) ΔH2
2Fe(s)+32O2(g)Fe2O3(s) ΔH3
2Al(s)+32O2(g)Al2O3(s) ΔH4
2Al(s)+Fe2O3(s)Al2O3(s)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是( )。
A.ΔH1<0,ΔH3>0 B.ΔH5<0,ΔH4<ΔH3
C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5
解析 A项,燃烧的过程是放热的,故ΔH1<0,铁被氧气氧化也是放热的,故ΔH3<0,错误;B项,铝热反应是放热的,故ΔH5<0,ΔH5=ΔH4-ΔH3<0,故ΔH4<ΔH3,正确;C项,ΔH1=(ΔH2+ΔH3)×23,错误;D项,ΔH3=ΔH4-ΔH5,错误。
答案 B
3.甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)CH3OH(g)。
已知:Ⅰ.常压下反应的能量变化如图所示。
Ⅱ.部分化学键的键能如下:
化学键
键能/(kJ·mol-1)
436
x
496
Ⅲ.CO(g)+12O2(g)CO2(g) ΔH=-280 kJ·mol-1
H2(g)+12O2(g)H2O(l) ΔH=-284 kJ·mol-1
H2O(l)H2O(g) ΔH=+44 kJ·mol-1
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式: 。
(2)H—O键的键能x为 kJ·mol-1。
(3)甲醇气体分解为CO和H2两种气体的反应的活化能为 kJ·mol-1。
(4)在 (填“高温”或“低温”)情况下有利于CO和H2制备甲醇的反应自发进行。
解析 (1)燃烧热的热化学方程式中,可燃物为1 mol,反应生成稳定的氧化物。由图可得热化学方程式①CO(g)+2H2(g)CH3OH(g) ΔH=-91 kJ·mol-1,又已知②CO(g)+12O2(g)CO2(g) ΔH=-280 kJ·mol-1,③H2(g)+12O2(g)H2O(l) ΔH=-284 kJ·mol-1,根据盖斯定律,③×2+②-①可得CH3OH(g)+32O2(g)CO2(g)+2H2O(l) ΔH=-757 kJ·mol-1。
(2)已知H2(g)+12O2(g)H2O(l) ΔH=-284 kJ·mol-1,H2O(l)H2O(g) ΔH=+44 kJ·mol-1,二者相加可得H2(g)+12O2(g)H2O(g)ΔH=-240 kJ·mol-1,反应热=反应物总键能-生成物总键能,则436 kJ·mol-1+12×496 kJ·mol-1-2×x kJ·mol-1=-240 kJ·mol-1,解得x=462。
(3)根据图像,甲醇气体分解为CO和H2两种气体的反应的活化能=91 kJ·mol-1+419 kJ·mol-1=510 kJ·mol-1。
(4)CO(g)+2H2(g)CH3OH(g) ΔH=-91 kJ·mol-1,ΔH<0,ΔS<0,ΔH-TΔS<0时反应自发进行,故在低温下该反应具有自发性。
答案 (1)CH3OH(g)+32O2(g)CO2(g)+2H2O(l) ΔH=-757 kJ·mol-1
(2)462
(3)510
(4)低温
一、反应热的计算
1.根据热化学方程式计算:反应热与化学方程式中各物质的化学计量数成正比。
2.根据反应物和生成物的总能量计算。
3.依据键能计算ΔH
(1)计算公式:ΔH=反应物的键能总和-生成物的键能总和。
(2)根据键能计算反应热的关键是正确找出反应物和生成物所含共价键的数目。如:1 mol NH3中含有3 mol N—H 键。
(3)常见物质中的化学键数目
物质
CO2
(CO)
CH4
(C—H)
P4
(P—P)
SiO2
(Si—O)
石墨
金刚石
S8
(S—S)
Si
(Si—Si)
键数
2
4
6
4
1.5
2
8
2
4.根据盖斯定律进行计算——利用盖斯定律计算反应热(ΔH)的解题流程
5.根据物质燃烧热数值计算:Q(放)=n(可燃物)×|ΔH|。
二、比较反应热大小的四个注意要点
1.物质的气、液、固三态的变化与反应热的关系:
2.ΔH的符号
比较反应热大小时不要只比较ΔH数值的大小,还要考虑其符号。
3.化学计量数
当反应物和生成物的状态相同时,化学计量数越大,放热反应的ΔH越小,吸热反应的ΔH越大。
4.可逆反应与反应热(ΔH)
正确理解可逆反应的反应热(ΔH),如:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1中的92.4 kJ是1 mol N2(g)与3 mol H2(g)完全反应生成2 mol NH3(g)时放出的热量。
1.在1200 ℃时,天然气脱硫工艺中会发生下列反应:
H2S(g)+32O2(g)SO2(g)+H2O(g) ΔH1
2H2S(g)+SO2(g)32S2(g)+2H2O(g) ΔH2
H2S(g)+12O2(g)S(g)+H2O(g) ΔH3
2S(g)S2(g) ΔH4
则ΔH4的正确表达式为( )。
A.ΔH4=23(ΔH1+ΔH2-3ΔH3)
B.ΔH4=23(3ΔH3-ΔH1-ΔH2)
C.ΔH4=32(ΔH1+ΔH2-3ΔH3)
D.ΔH4=32(ΔH1-ΔH2-3ΔH3)
解析 给题中热化学方程式依次编号为①②③④,①+②-③×3得3S(g)32S2(g) (ΔH1+ΔH2-3ΔH3),故2S(g)S2(g) ΔH4=23(ΔH1+ΔH2-3ΔH3)。
答案 A
2.已知:
HCN(aq)+NaOH(aq)NaCN(aq)+H2O(l)
ΔH=-12.1 kJ·mol-1;
HCl(aq)+NaOH(aq)NaCl(aq)+H2O(l)
ΔH=-57.3 kJ·mol-1。
则HCN在水溶液中电离的ΔH等于( )。
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+45.2 kJ·mol-1 D.+69.4 kJ·mol-1
解析 HCN(aq)+OH-(aq)CN-(aq)+H2O(l) ΔH=-12.1 kJ·mol-1,H2O(l)OH-(aq)+H+(aq) ΔH=+57.3 kJ·mol-1,两式相加得:HCN(aq)H+(aq)+CN-(aq) ΔH=+45.2 kJ·mol-1。
答案 C
3.已知:C(s)+O2(g)CO2(g) ΔH1
CO2(g)+C(s)2CO(g) ΔH2
2CO(g)+O2(g)2CO2(g) ΔH3
2Cu(s)+O2(g)2CuO(s) ΔH4
CO(g)+CuO(s)CO2(g)+Cu(s) ΔH5
下列关于上述反应焓变的判断正确的是( )。
A.ΔH1>0,ΔH3<0 B.ΔH2<0,ΔH4>0
C.ΔH2=ΔH1-ΔH3 D.ΔH3=ΔH4+ΔH5
解析 A项,所有的燃烧反应都属于放热反应,因此ΔH1<0,ΔH3<0,错误;B项,碳还原二氧化碳的反应属于吸热反应,ΔH2>0,铜与氧气的反应属于放热反应,ΔH4<0,错误;C项,由盖斯定律可知,ΔH1=ΔH2+ΔH3,则ΔH2=ΔH1-ΔH3,正确;D项,由盖斯定律可知,ΔH3=ΔH4+2ΔH5,错误。
答案 C
4.(1)甲醇既是重要的化工原料,又可作燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇。发生的主要反应如下:
①CO(g)+2H2(g)CH3OH(g) ΔH1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)CO(g)+H2O(g) ΔH3
已知反应①中相关的化学键键能数据如下:
化学键
H—H
C—O
C←O
H—O
C—H
键能/kJ·mol-1
436
343
1076
465
413
由此计算ΔH1= kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3= kJ·mol-1。
(2)乙苯催化脱氢制苯乙烯反应:
已知:
化学键
C—H
C—C
CC
H—H
键能/kJ·mol-1
412
348
612
436
计算上述反应的ΔH= kJ·mol-1。
解析 (1)根据键能与反应热的关系可知,ΔH1=反应物的键能之和-生成物的键能之和=(1076 kJ·mol-1+2×436 kJ·mol-1)-(413 kJ·mol-1×3+343 kJ·mol-1+465 kJ·mol-1)=-99 kJ·mol-1。根据盖斯定律,由②-①可得CO2(g)+H2(g)CO(g)+H2O(g) ΔH3=ΔH2-ΔH1=(-58 kJ·mol-1)-(-99 kJ·mol-1)=+41 kJ·mol-1。
(2)制备苯乙烯需断开2 mol C—H键,生成1 mol H—H键,同时在C—C键的基础上生成CC键,因此生成1 mol苯乙烯吸收的热量为2×412 kJ=824 kJ,放出的热量为436 kJ+(612-348) kJ=700 kJ,根据反应热的定义可知,ΔH=824 kJ·mol-1-700 kJ·mol-1=+124 kJ·mol-1。
答案 (1)-99 +41 (2)+124
1.(2017年江苏,8)通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是( )。
①C(s)+H2O(g)CO(g)+H2(g) ΔH1=a kJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g) ΔH2=b kJ·mol-1
③CO2(g)+3H2(g)CH3OH(g)+H2O(g)
ΔH3=c kJ·mol-1
④2CH3OH(g)CH3OCH3(g)+H2O(g)
ΔH4=d kJ·mol-1
A.反应①②为反应③提供原料气
B.反应③也是CO2资源化利用的方法之一
C.反应CH3OH(g)12CH3OCH3(g)+12H2O(l)的ΔH=d2 kJ·mol-1
D.反应2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)的ΔH=(2b+2c+d) kJ·mol-1
解析 反应①和②的最终产物中含有H2和CO2,A项正确;CO2与H2化合生成能源物质CH3OH,B项正确;该反应生成的H2O为液态,液态水转化为气态水需要吸热,则ΔH
相关文档
- 2020届高考化学一轮复习化学反应中2021-07-089页
- 2020届高考化学一轮复习化学实验常2021-07-0828页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-088页
- 2020届高考化学一轮复习化学反应与2021-07-0821页
- 2021届高考化学一轮复习化学实验方2021-07-0813页
- 2020届高考化学一轮复习化学反应速2021-07-0815页
- 2020届高考化学一轮复习化学反应与2021-07-0810页
- 2021届高考化学一轮复习化学工艺流2021-07-0812页
- 2019届高考化学一轮复习化学反应与2021-07-088页
- 2019届高考化学一轮复习化学反应与2021-07-0810页