- 659.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第一章 化学反应与能量
第一节 化学反应与能量的变化
[阅读提纲]
1.什么是反应热(焓变)?什么是放热反应和吸热反应?
2.什么是热化学方程式?在热化学方程式中如何表示放热和吸热?
3.为什么在热化学方程式中必须标明物质的集聚状态?
4.热化学方程式中的系数表示什么?能否用分数表示?
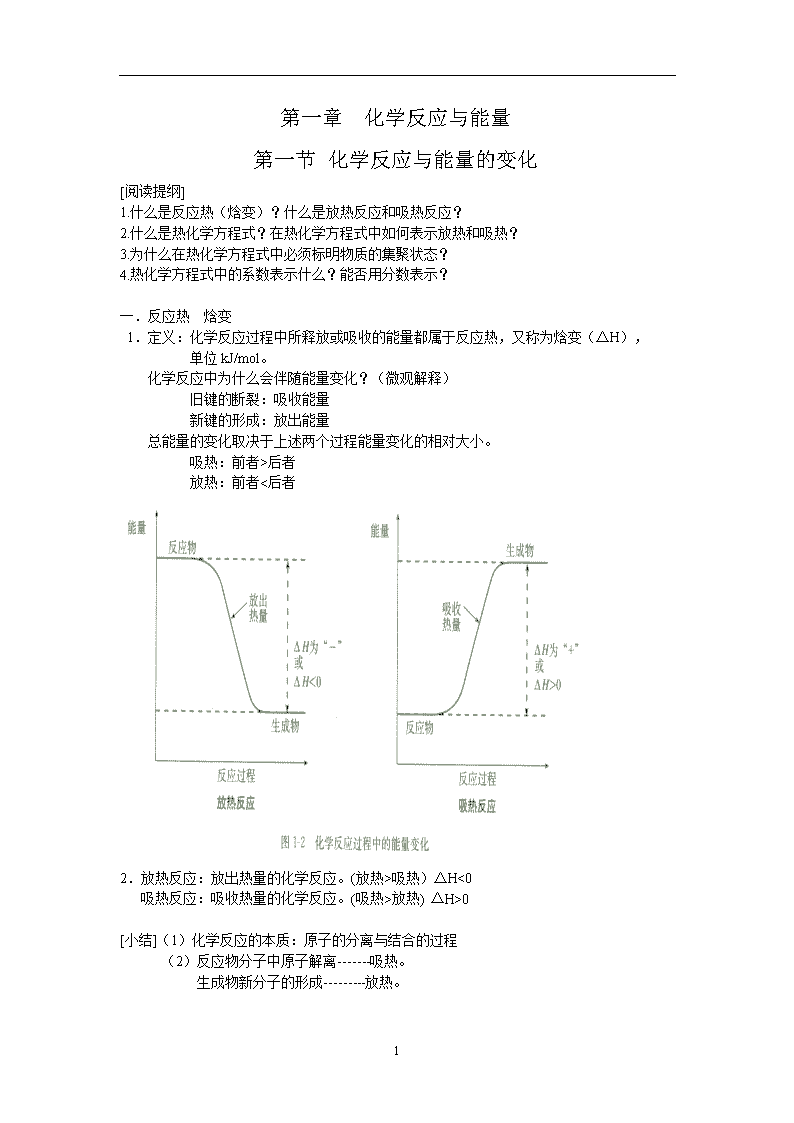
一.反应热 焓变
1.定义:化学反应过程中所释放或吸收的能量都属于反应热,又称为焓变(ΔH),
单位kJ/mol。
化学反应中为什么会伴随能量变化?(微观解释)
旧键的断裂:吸收能量
新键的形成:放出能量
总能量的变化取决于上述两个过程能量变化的相对大小。
吸热:前者>后者
放热:前者<后者
2.放热反应:放出热量的化学反应。(放热>吸热)ΔH<0
吸热反应:吸收热量的化学反应。(吸热>放热) ΔH>0
[小结](1)化学反应的本质:原子的分离与结合的过程
(2)反应物分子中原子解离-------吸热。
生成物新分子的形成---------放热。
3
二.热化学方程式
1. 定义:能表示参加反应物质的量和反应热的关系的化学方程式
例如:H2 (气) + 1/2 O2 (气) = H2O (气) ΔH= -241.8kJ/mol
H2(气) + 1/2 O2(气) = H2O (液) ΔH= -285.8 kJ/mol
[讨论] 1.为什么集聚状态不同,热量值不同?
答:液态水变成水蒸气要吸收热量
2.若反应物状态不同,而生成物状态相同,那么热量值相同吗?
答:不同
[思考与交流]
2.书写要点: C(固) + H2O(气) = CO(气) + H2(气) ΔH= +131.3 kJ/mol
①标集聚状态(固、液、气)
②右端标热量数值和符号: 吸热用“+”,放热用:“-”。
③系数单位是“摩”,而不是“个”;也不能表示物质的量之比。
④系数可用分数,但热量值要相应变化。
如:2H2(气) + O2(气) = 2H2O(液) ΔH= -571.6 kJ/mol
H2(气) + 1/2 O2(气) = H2O(液) ΔH= -285.8 kJ/mol
⑤不注明条件,即指250C 、1.01×105Pa
例: 1克甲烷在空气中燃烧,恢复常温下测得放出热量55.625KJ,试写出热化学方程式。
CH4(气) + 2O2(气) = CO2(气) + 2H2O(液) ΔH= -890 kJ/mol
[练习1]同温、同压下,比较Q1与Q2的大小:
S(气) + O2(气) == SO2(气) + Q1
S(固) + O2(气) == SO2(气) + Q2
Q1 < Q2 , |Q1 | > |Q2|
[练习2] 已知:C(固) + O2(气) == CO2(气) ΔH= -393.5 kJ/mol,要获得1000千焦热量,需燃烧多少克碳?
30.5克
[练习3] 已知:S(固) + O2(气) = SO2(气) ΔH= -290.6 kJ/mol,求1.6克硫燃烧成为SO2气体放出多少热量?
14.53kJ
3
[自我检测]
1. 3mol CH4燃烧时,生成液态水和CO2 同时放出2670.9KJ的热。请写出热化学方程式。
2. 常温下14克CO在足量氧气中充分燃烧,放出141.3KJ热量,写出该热化学方程式。
3. 1836年,俄国化学家盖斯指出:化学反应的热效应仅与反应物的最初状态和生成物的最终状态有关,而与中间步骤无关。按此规律,结合下列热化学方程式:
C(固、金刚石) + O2(气) == CO2(气) ΔH= -395.41 kJ/mol
C(固、石墨) + O2(气) == CO2(气) ΔH= -393.51 kJ/mol
回答有关问题:
(1)石墨转化为金刚石的热化学方程式是:
(2)石墨和金刚石相比较,__________的稳定性更大。
自我检测题答案:
1. CH4(气) + 2O2(气) = CO2(气) + 2H2O(液) ΔH= -890.3 kJ/mol
2. 2CO(气) + O2(气) = 2CO2(气) ΔH= -565.2 kJ/mol
3.(1) C(固、石墨) == C(固、金刚石) ΔH= +1.90 kJ/mol
(2)石墨
3
相关文档
- 高中化学人教版选修5课后训练:2_1_32021-07-088页
- 2020版新教材高中化学第3章简单的2021-07-0842页
- 北京2019-2020高中化学选修五:《认2021-07-0819页
- 2020版高中化学课时作业19海水资源2021-07-087页
- 2020_2021学年新教材高中化学第二2021-07-088页
- 高中化学人教版选修三(学业分层测评2021-07-086页
- 2019-2020学年新教材高中化学课时2021-07-087页
- 2020高中化学专题4烃的衍生物第一2021-07-0811页
- 人教版高中化学选修五 第四章 生命2021-07-0823页
- 人教版化学必修二2-1-1课件第二章 2021-07-0849页