- 474.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学反应与能量变化
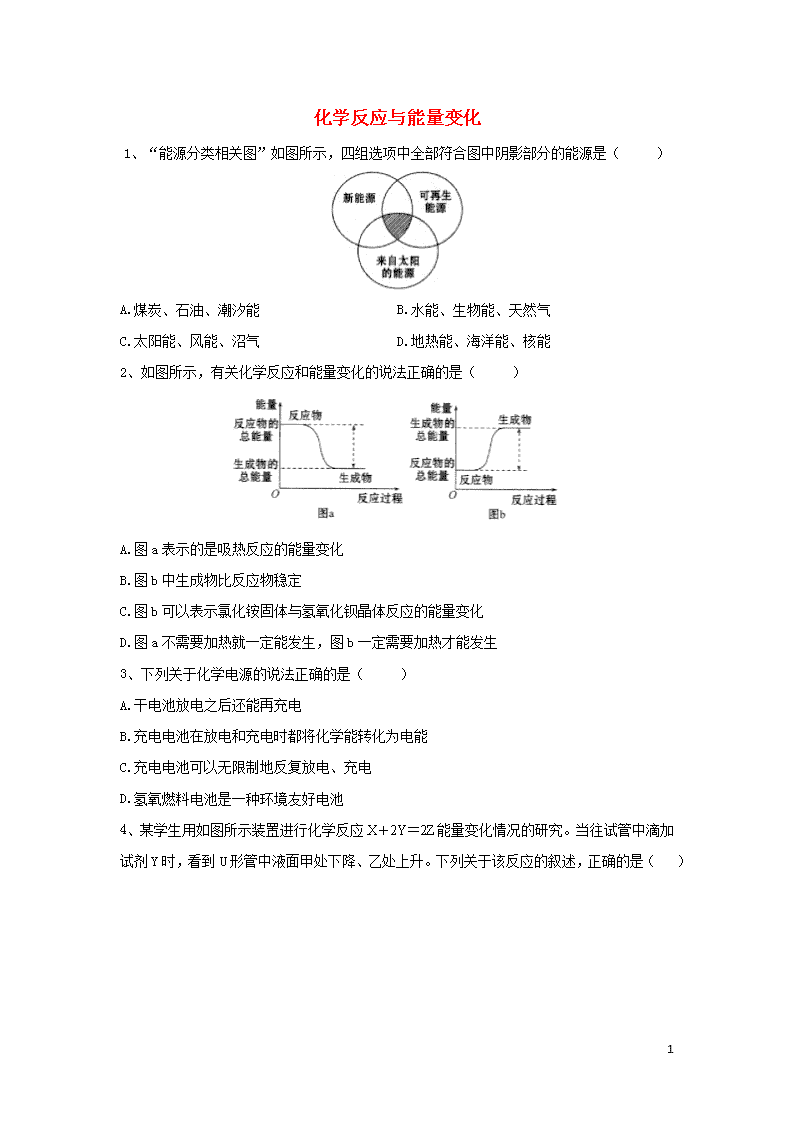
1、“能源分类相关图”如图所示,四组选项中全部符合图中阴影部分的能源是( )
A.煤炭、石油、潮汐能 B.水能、生物能、天然气
C.太阳能、风能、沼气 D.地热能、海洋能、核能
2、如图所示,有关化学反应和能量变化的说法正确的是( )
A.图a表示的是吸热反应的能量变化
B.图b中生成物比反应物稳定
C.图b可以表示氯化铵固体与氢氧化钡晶体反应的能量变化
D.图a不需要加热就一定能发生,图b一定需要加热才能发生
3、下列关于化学电源的说法正确的是( )
A.干电池放电之后还能再充电
B.充电电池在放电和充电时都将化学能转化为电能
C.充电电池可以无限制地反复放电、充电
D.氢氧燃料电池是一种环境友好电池
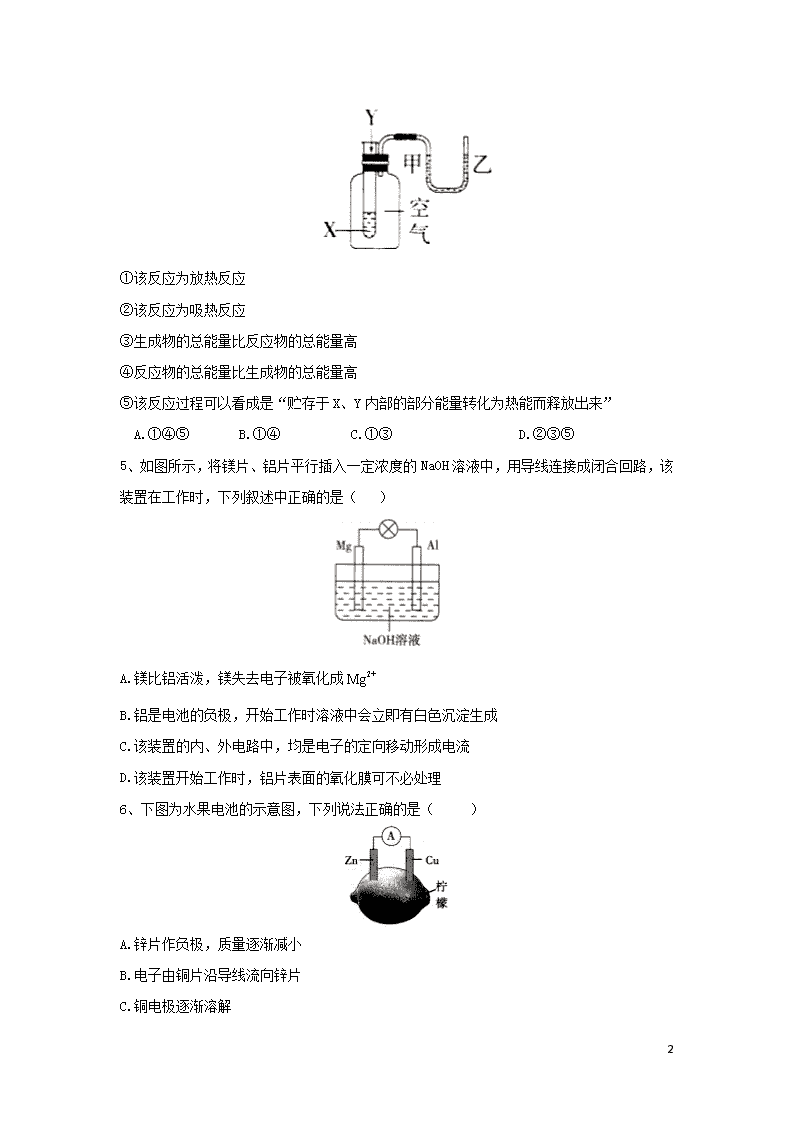
4、某学生用如图所示装置进行化学反应能量变化情况的研究。当往试管中滴加试剂Y时,看到U形管中液面甲处下降、乙处上升。下列关于该反应的叙述,正确的是( )
12
①该反应为放热反应
②该反应为吸热反应
③生成物的总能量比反应物的总能量高
④反应物的总能量比生成物的总能量高
⑤该反应过程可以看成是“贮存于X、Y内部的部分能量转化为热能而释放出来”
A.①④⑤ B.①④ C.①③ D.②③⑤
5、如图所示,将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述中正确的是( )
A.镁比铝活泼,镁失去电子被氧化成
B.铝是电池的负极,开始工作时溶液中会立即有白色沉淀生成
C.该装置的内、外电路中,均是电子的定向移动形成电流
D.该装置开始工作时,铝片表面的氧化膜可不必处理
6、下图为水果电池的示意图,下列说法正确的是( )
A.锌片作负极,质量逐渐减小
B.电子由铜片沿导线流向锌片
C.铜电极逐渐溶解
12
D.该装置能将电能转化为化学能
7、某位科学家说:“甲烷是21世纪的新燃料。”甲烷作为燃料的用途之一就是制作燃料电池。有科技工作者制造了一种甲烷燃料电池,一个电极通入空气,另一个电极通入甲烷,电解质是掺杂了的晶体,它在高温下能传导。以下判断错误的是( )
A.电池正极发生的反应:
B.电池负极发生的反应:
C.固体电解质里的的移动方向:由正极流向负极
D.向外电路释放电子的电极:正极(即电子由正极流向负极)
8、如图为一种微生物燃料电池结构示意图,下列叙述正确的是( )
A.放电过程中,电子从正极转移到负极
B.放电过程中,从正极区移向负极区
C.正极反应式为
D.若是葡萄糖,当电路中转移了电子时,消耗的葡萄糖是1 mol
9、化学反应可视为 旧键断裂和新键形成的过程。已知白磷和的分子结构如图所示,现提供以下化学键的键能:键:198键:360 O=O键:498,则依据反应(白磷)=, 生成时的能量变化为( )
A.吸收1 638 的能量 B.放出1 638 的能量
C.吸收126 的能量 D.放出126 的能量
12
10、将盐酸和未知浓度的溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持)。下列叙述正确的是( )
A.做该实验时的环境温度为22℃
B.该实验表明化学能可转化为热能
C. 溶液的浓度约为
D.该实验表明有水生成的反应都是放热反应
11、如图所示,把试管放入盛有25℃ 的饱和石灰水的烧杯中,试管中开始放入一小块镁片,再用滴管滴入5mL稀盐酸于试管中。试回答下列问题。
(1)实验中观察到的现象是( )(填代号)
A.试管中镁片逐渐溶解
B.试管中产生无色气泡
C.烧杯外壁变冷
D.烧杯底部析出少量白色固体
(2)试管中发生的反应属于____ ___(选填“氧化还原反应”或“非氧化还原反应”)。
(3)写出有关反应的离子方程式_____ ______________。
(4)由实验推知,MgCl2溶液和H2的总能量__ ___(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
12
12、由A、B、C、D四种金属按下表中装置进行实验。
装置
现象
金属A不断溶解
C的质量增加
A上有气体产生
根据实验现象回答下列问题。
(1)装置甲中作正极的是 。(填“A”或“B”)
(2)装置乙溶液中C电极的电极反应式为 。
装置乙中反应一段时间后,测得C电极的质量增加12.8g则该电池反应转移电子的物质的量为 mol。
(3)装置丙中金属A电极上的反应属于 (填“氧化反应”或“还原反应”)
(4)四种金属活动性由强到弱的顺序是 。
13、回答下列问题。
(1)普通锌锰干电池的结构如图所示。
①电池中电解质溶液为 。
②正极反应式为 。
③放电时,向 。(填“正极”或“负极”)移动。
12
(2)废电池中的锌皮常用于实验室制氢气,废锌皮和纯锌粒分别与同浓度的稀硫酸反应,产生氢气速率较大的是 ,原因是 。若用过量的纯锌粒与一定量的稀硫酸反应,为了加快反应速率又不影响产生氢气的量,下列措施可行的是 (填序号)
A.微热
B.加入适量氧化铜
C.加入少量硫酸铜溶液
D.加水
E.加入少量氢氧化钡溶液
14、氢气是未来最理想的能源之一,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
(1)海水分解生成的氢气用于燃料电池时,实现__ ___能转变为___ __能。水分解时,断裂的化学键为__ ___键,分解海水的反应属于__ ___反应(填“放热”或“吸热”)。
(2)氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2+4OH--4e-=4H2O,O2+2H2O+4e-=4OH-,据此作出判断,下列说法中错误的是( )
A.供电时的总反应是2H2+O2=2H2O B.产物为无污染的水,属于环境友好型电池
C.燃料电池的能量转化率可达100% D.H2在负极发生氧化反应
(3)有人以化学反应:2Zn+O2+4H+=2Zn2++2H2O为基础设汁出一种原电池,移入人体内作为心脏起搏器的能源,它靠人体内血液中溶有一定浓度的O2、H+进行工作。则原电池的负极材料是__ ____,负极上发生反应的电极反应式为_________ _________。
15、为了探究化学能与热能的转化,某实验小组设计了如图所示三套实验装置:
12
1.上述3个装置中,不能用于探究“铜与浓硝酸反应是吸热反应还是放热反应”的是______。
2.某同学选用装置I进行实验(实验前U形管里液 面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是____ ___,说明该反应属于_______(填“吸热”或“放热”)反应。
3.为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(在甲试管中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是__ _____;
②若观察到烧杯里产生气泡,则说明M溶于水___ _____(填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”);
③若实验过程中观察到烧杯里的导管内形成一段水柱,则M可能是___ ______。
4.至少有两种实验方法能证明超氧化钾与水的反应(==)是放热反应还 是吸热反应。
方法①:选择上述装置_________进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在 石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是_________(填“吸热”或“放热”)反应。
答案以及解析
1答案及解析:
答案:C
解析:A.煤炭、石油是化石能源,不是新能源;潮汐能不是来自太阳能,故A错误;B.天然气是化石能源,不是新能源,故B错误;C.太阳能、风能、沼气都是来自太阳能的可再生能源,故C正确;D.地热能、核能不是来自太阳能,故D错误。故选C。
12
2答案及解析:
答案:C
3答案及解析:
答案:D
解析:A.干电池是一次性电池,放电之后不能再充电,A错误;B.充电电池在放电时化学能转化为电能,充电时都将电能转化为化学能,B错误;C.充电电池也不能无限制地反复放电、充电,C错误;D.氢氧燃料电池的生成物是水,是一种环境友好电池,D正确。故选:D。
4答案及解析:
答案:A
解析:当往试管中滴加试剂Y时,看到U形管中液面甲处下降、乙处上升,说明该反应为放热反应,放出的热使集气瓶中的气压升高而出现该现象,故①正确;在放热反应中,反应物的总能量高于生成物的总能量,故④正确;该反应过程可以看成是“贮存”于X、Y内部的部分能量转化为热能而释放出来,故⑤正确。故选A。
5答案及解析:
答案:D
解析:A项,在Mg、Al与一定浓度的NaOH溶液形成的原电池中,由于Al能够与NaOH溶液发生反应,所以A1作负极,发生氧化反应失去电子被氧化成,A项错误;B项,铝是电池的负极,开始工作时溶液中产生的会与溶液中过量的发生反应产生容易溶解的,因此溶液中不会立即有白色沉淀生成,B项错误;C项,该装置的外电路中,电子的定向移动形成电流,而在内电路中则是离子定向移动形成电流,C项错误;D项,由于能够与NaOH发生反应而溶解,所以该装置开始工作时,铝片表面的氧化膜可不必处理,D项正确。
6答案及解析:
答案:A
解析:锌比铜活泼,所以Zn作负极,发生氧化反应,失去电子,进入溶液,所以质量减小,正确;Zn为负极,则Cu为正极,所以电子从锌片沿导线流向铜片,错误;铜极发生还原反应,水果中的氢离子发生还原反应生成氢气,所以Cu不溶解,错误;该装置是原电池,把化学能转化为电能,错误。
12
7答案及解析:
答案:D
解析:该燃料电池中,正极上氧气得电子生成氧离子,电极反应式为,故A正确;负极上甲烷失电子和氧离子反应生成二氧化碳和水,电极反应式为,故B正确;放电时,电解质中阴离子向负极移动、阳离子向正极移动,所以氧离子向负极移动,故C正确;向外电路释放电子的电极是负极,电子从负极流向正极,故D错误。
8答案及解析:
答案:C
解析:放电过程中,电子从负极转移到正极,故A错误;原电池工作时,阳离子向正极移动,阴离子向负极移动,所以从负极区移向正极区,故B错误;被还原生成,为原电池的正极,电极反应式为,故C正确;若是葡萄糖,C元素化合价可认定为0价,当电路中转移了电子时,反应的葡萄糖的物质的量为0.25 mol,故D错误。
9答案及解析:
答案:B
解析:由題意可知,生成时,断裂 (白磷)中键和中O=O键共吸收能量,形成中键 放出能量,故生成时 总共放出能量,B正确:
10答案及解析:
答案:B
解析:由图像可知,22℃不是环境温度,因为温度为22℃的状态下已发生和的反应,故A错误;实验结果表明此反应是放热反应,表明化学能转化为热能,故B正确;当加 入盐酸体积为时,温度最高,说明此时反应完全,设
12
溶液浓度为,则,解得,故 C错误;晶体和晶体反应生成水,但此反应是吸热反应,故D错误。
11答案及解析:
答案:(1)ABD;(2)氧化还原反应;(3)Mg+2H+=Mg2++H2↑(4)小于
解析:(1)当向试管中不断滴加稀盐酸时,发生反应:Mg+2H+=Mg2++H2↑,因此会看到试管中镁片逐渐溶解,同时有无色气泡产生,由于上述反应是放热反应,所以试管的外壁会变热。而Ca(OH)2在水中的溶解度会随着温度的升高而降低,所以温度升高,Ca(OH)2的溶解度减小,烧杯中会析出Ca(OH)2固体。
(2)试管中发生的反应从基本反应类型看属于置换反应,由于在反应前后元素的化合价发生了变化,所以从反应实质看属于氧化还原反应。
(3)有关反应的离子方程式是Mg+2H+=Mg2++H2↑。
(4)由于该反应是放热反应,所以MgCl2溶液和H2的总能量小于反应物镁片和盐酸的总能量。
12答案及解析:
答案:(1)B
(2); 0.4
(3)还原反应
(4)D>A>B>C
解析:(1)甲装置中,金属A不断溶解,说明A是负极,B是正极。
(2)乙装置 中,C的质量增加,说明C电极是正极,溶液中的铜离子放电生成铜,电极反应式是,反应一段时间后,测得C电极的质量增加12.8g,即生成铜的物质的量为12.8g÷64gmol=0.2mol,根据电极反应式可知转移电子的物质的量为0.2mol×2=0.4mol。
(3)丙装置中A电极上有气体生成,所以A电极是正极,溶液中的氢离子得电子发生还原反应生成氢气。
(4)甲中A是负极,B是正极;乙中C是正极,B是负极;丙中A是正极,D是负极,所以四种金属活动性由强到弱的顺序是D>A>B>C。
13答案及解析:
12
答案:(1)①(或氯化铵)溶液
②
③正极
(2)废锌皮;废锌皮在稀硫酸中可构成原电池,加快负极失电子速率,相应产生氢气速率较大;AC
解析:(1)该电池的工作原理:负极失去电子被氧化,正极上得到电子,阳离子向正极移动。(2)从影响化学反应速率的角度考虑,构成原电池能加快负极失电子。
14答案及解析:
答案:(1)化学;电;共价;吸热(2)C(3)Zn;Zn-2e-=Zn2+
解析:(1)海水分解生成的氢气用于燃料电池时,实现了化学能转变为电能。水分解时.断裂的化学键为共价键,分解海水的反应属于吸热反应。
(2)A、两个电极反应式相加,总电极反应式为2H2+O2=2H2O,故说法正确;B、根据A选项分析,产物是H2O,对环境无污染,属于环境友好型电池,故说法正确;C、能量转化率不可能达到100%,故说法错误;D、氢气在负极被氧化,故说法正确。
(3)负极发生氧化反应,所以该原电池的负极材料是Zn,电极反应式为Zn-2e-=Zn2+。
15答案及解析:
答案:1.Ⅲ
2.左端液面降低,右端液面升高;放热
3.①产生气泡,反应完毕后,冷却至室温,烧杯里的导管内形成一段水柱②可能是放热反应③
4.Ⅰ或Ⅱ放热
解析:1.装置I可通过U形管中左右两侧红墨水液面的高度差 变化判断铜与浓硝酸的反应是放热反应还是吸热反应;装置Ⅱ可通 过烧杯中是否产生气泡判断铜与浓硝酸的反应是放热反应还是吸 热反应;装置Ⅱ是一个铜与浓硝酸反应并将生成的气体用水吸收的 装置,不能证明铜与浓硝酸的反应是放热反应还是吸热反应。
2.氢氧化钡与硫酸的反应属于中和反应,中和反应都是放热反应,所以锥形瓶中气体受热膨胀,导致U形管左端液面降低,右端液面升高。
12
3.①若M为钠.钠与水反应生成氢氧化钠和氢气,该反应为放热 反应,放出的热量使大试管中温度升高,气体压强增大,所以右边烧 杯中有气泡产生,反应完毕后,冷却至室温,烧杯里的导管内形成一 段水柱:②若观察到烧杯里产生气泡,说明M溶于水放出热该,是 放热过程,但不一定发生化学反应,如氢氧化钠溶于水放热,无新物 质生成。③若实验过程中观察到烧杯里的导管内形成一段水柱,说 明装置中气体的压强减小.则M可能是硝酸铵.硝酸铵溶于水,吸 收热量,温度降低,大试管内气体压强减小。
4.至少有两种实验方法能证明超氧化钾与水的反应(==)是放热反应还是吸热反应。方法①:选 择装置I (或Ⅱ)进行实验,装置I右边U形管中左端液面降低,右 端液面升高(或装置Ⅱ烧杯中导管口有气泡冒出),证明该反应为 放热反应。方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉 网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则 说明该反应放出大量热,达到棉花着火点,使棉花燃烧。
12
相关文档
- 2021版高考化学一轮复习专题6化学2021-07-08100页
- 全国通用2021高考化学一轮复习第六2021-07-089页
- 选修4第一章 第一节 化学反应与能2021-07-083页
- 2021版新高考化学一轮复习专题6化2021-07-0818页
- 全国通用2021高考化学一轮复习第六2021-07-088页
- 2020届高考化学一轮复习化学反应与2021-07-0810页
- 2020届二轮复习化学反应与能量变化2021-07-088页
- 2018届二轮复习化学反应与能量变化2021-07-08155页
- 2019届高考化学一轮复习化学反应与2021-07-088页
- 2020-2021学年化学苏教版选修4专题2021-07-0716页