- 609.81 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
专题突破练6B 电化学
一、选择题(本题包括9小题,每小题6分,共54分)
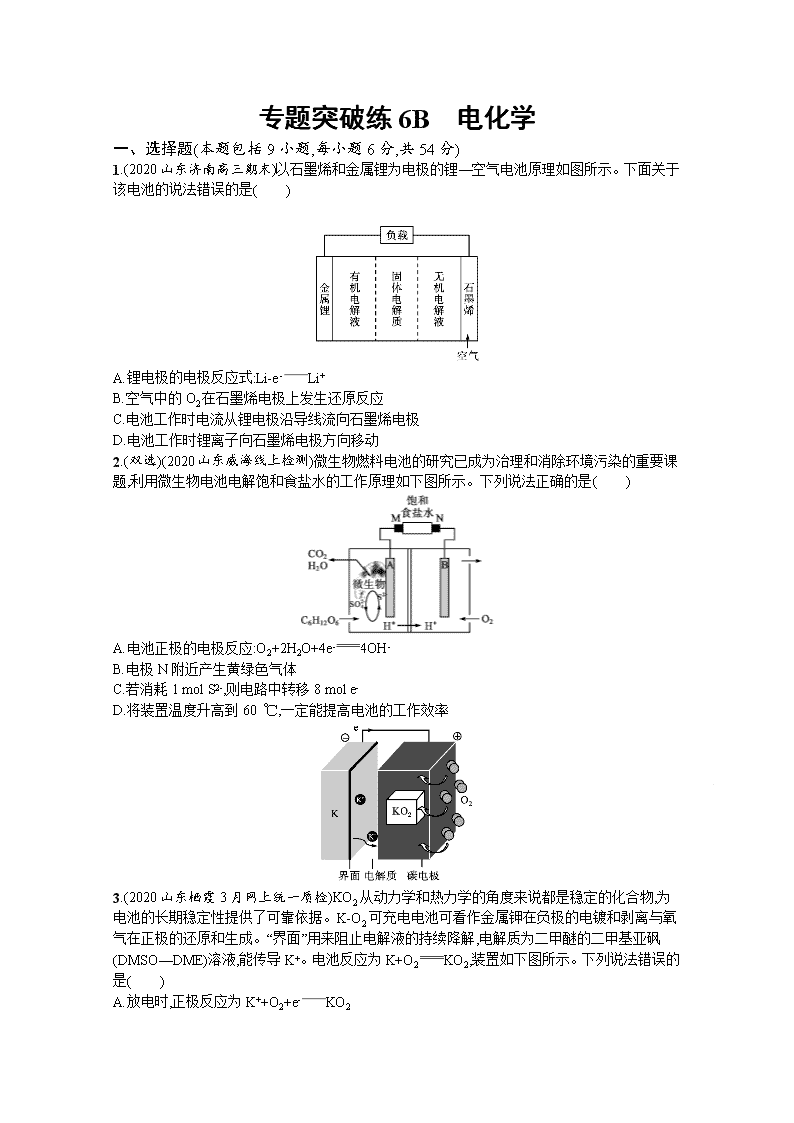
1.(2020山东济南高三期末)以石墨烯和金属锂为电极的锂—空气电池原理如图所示。下面关于该电池的说法错误的是( )
A.锂电极的电极反应式:Li-e-Li+
B.空气中的O2在石墨烯电极上发生还原反应
C.电池工作时电流从锂电极沿导线流向石墨烯电极
D.电池工作时锂离子向石墨烯电极方向移动
2.(双选)(2020山东威海线上检测)微生物燃料电池的研究已成为治理和消除环境污染的重要课题,利用微生物电池电解饱和食盐水的工作原理如下图所示。下列说法正确的是( )
A.电池正极的电极反应:O2+2H2O+4e-4OH-
B.电极N附近产生黄绿色气体
C.若消耗1 mol S2-,则电路中转移8 mol e-
D.将装置温度升高到60 ℃,一定能提高电池的工作效率
3.(2020山东栖霞3月网上统一质检)KO2从动力学和热力学的角度来说都是稳定的化合物,为电池的长期稳定性提供了可靠依据。K-O2可充电电池可看作金属钾在负极的电镀和剥离与氧气在正极的还原和生成。“界面”用来阻止电解液的持续降解,电解质为二甲醚的二甲基亚砜(DMSO—DME)溶液,能传导K+。电池反应为K+O2KO2,装置如下图所示。下列说法错误的是( )
A.放电时,正极反应为K++O2+e-KO2
B.有效抑制氧气扩散可极大延长K-O2电池的循环性能
C.充电时,每转移1 mol e-,阳极质量减少39 g
D.在理想状态下使用空气来替代纯氧可以降低电池的造价
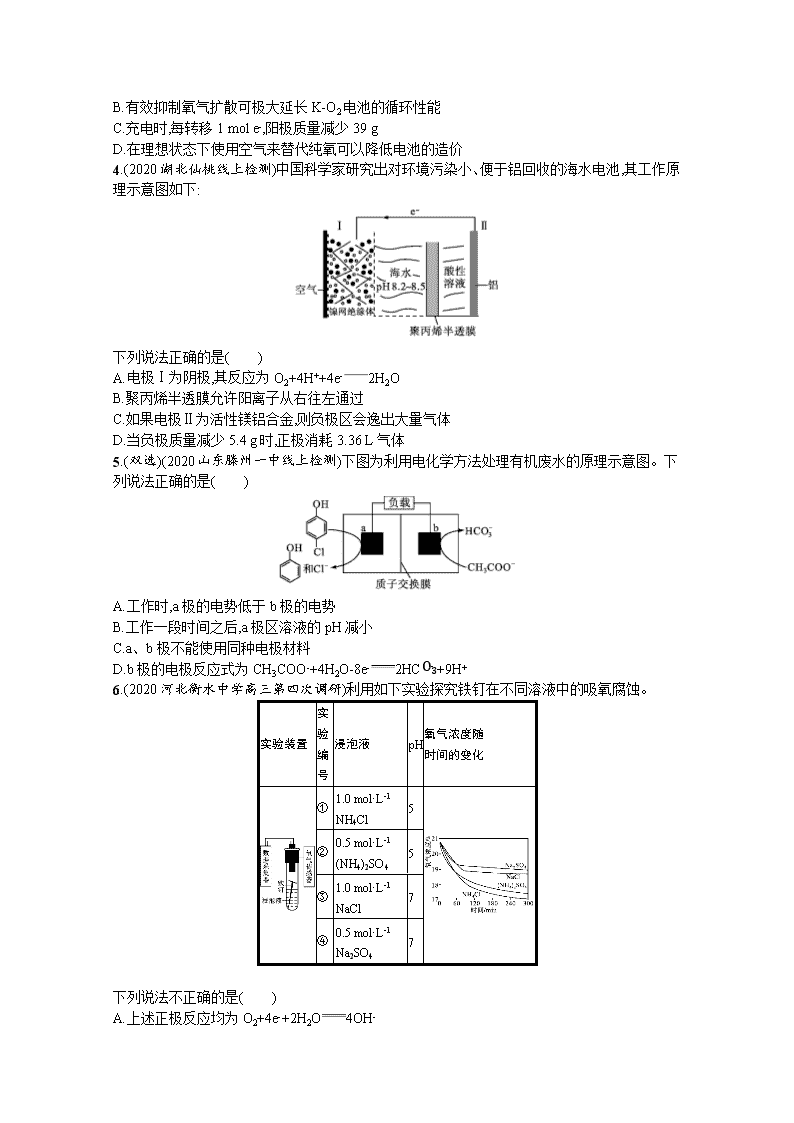
4.(2020湖北仙桃线上检测)中国科学家研究出对环境污染小、便于铝回收的海水电池,其工作原理示意图如下:
下列说法正确的是( )
A.电极Ⅰ为阴极,其反应为O2+4H++4e-2H2O
B.聚丙烯半透膜允许阳离子从右往左通过
C.如果电极Ⅱ为活性镁铝合金,则负极区会逸出大量气体
D.当负极质量减少5.4 g时,正极消耗3.36 L气体
5.(双选)(2020山东滕州一中线上检测)下图为利用电化学方法处理有机废水的原理示意图。下列说法正确的是( )
A.工作时,a极的电势低于b极的电势
B.工作一段时间之后,a极区溶液的pH减小
C.a、b极不能使用同种电极材料
D.b极的电极反应式为CH3COO-+4H2O-8e-2HCO3-+9H+
6.(2020河北衡水中学高三第四次调研)利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
实验装置
实验
编号
浸泡液
pH
氧气浓度随
时间的变化
①
1.0 mol·L-1 NH4Cl
5
②
0.5 mol·L-1 (NH4)2SO4
5
③
1.0 mol·L-1 NaCl
7
④
0.5 mol·L-1 Na2SO4
7
下列说法不正确的是( )
A.上述正极反应均为O2+4e-+2H2O4OH-
B.在不同溶液中,Cl-是影响吸氧腐蚀速率的主要因素
C.向实验④中加入少量(NH4)2SO4固体,吸氧腐蚀速率加快
D.在300 min内,铁钉的平均吸氧腐蚀速率酸性溶液大于中性溶液
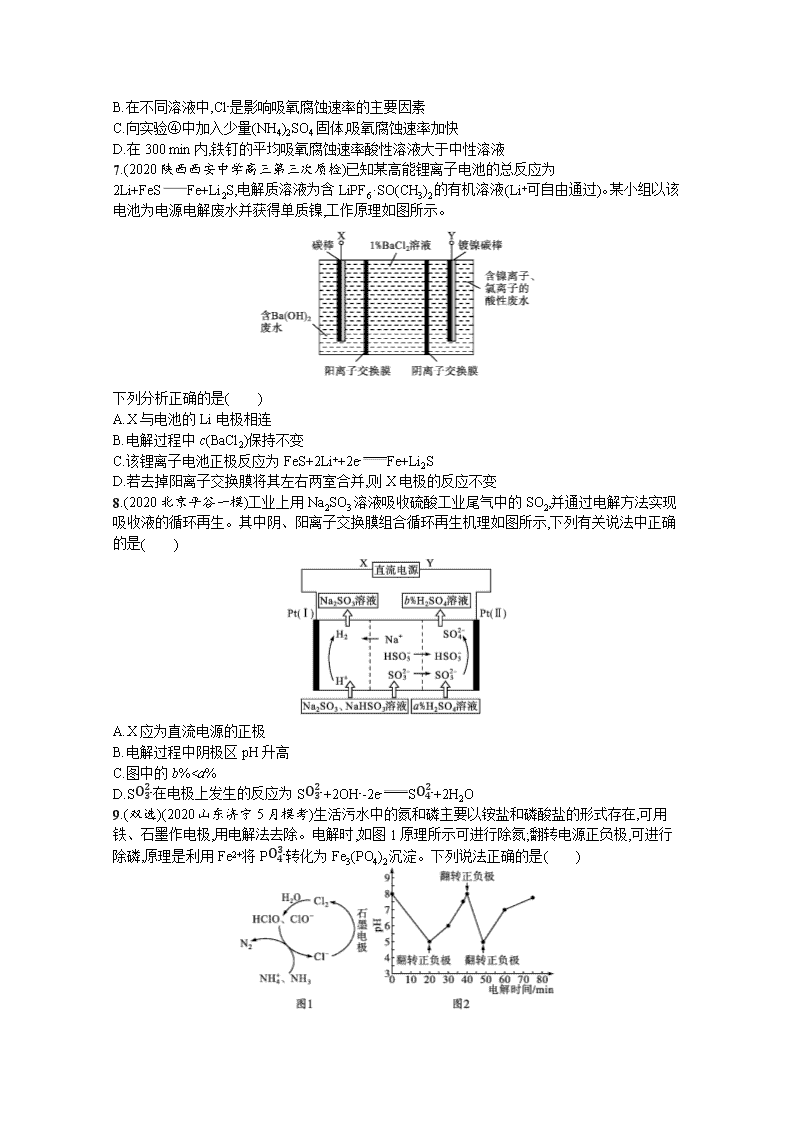
7.(2020陕西西安中学高三第三次质检)已知某高能锂离子电池的总反应为2Li+FeSFe+Li2S,电解质溶液为含LiPF6·SO(CH3)2的有机溶液(Li+可自由通过)。某小组以该电池为电源电解废水并获得单质镍,工作原理如图所示。
下列分析正确的是( )
A.X与电池的Li电极相连
B.电解过程中c(BaCl2)保持不变
C.该锂离子电池正极反应为FeS+2Li++2e-Fe+Li2S
D.若去掉阳离子交换膜将其左右两室合并,则X电极的反应不变
8.(2020北京平谷一模)工业上用Na2SO3溶液吸收硫酸工业尾气中的SO2,并通过电解方法实现吸收液的循环再生。其中阴、阳离子交换膜组合循环再生机理如图所示,下列有关说法中正确的是( )
A.X应为直流电源的正极
B.电解过程中阴极区pH升高
C.图中的b%OH-,则Cl-移向阳极放电:2Cl--2e-Cl2↑,即X电极反应发生变化,故D错误。
8.B 解析根据题意分析可知,电解池左室H+→H2,Pt(Ⅰ)是阴极,X为直流电源的负极,A项错误;阴极区消耗H+生成氢气,氢离子浓度减小,溶液的pH增大,B项正确;电解池右室阳极区发生的反应为HSO3--2e-+H2OSO42-+3H+和SO32--2e-+H2OSO42-+2H+,图中的b%>a%,C项错误,D项错误。
9.CD 解析因0~20min脱除的元素是氮元素,所以需要将铵根、氨气氧化成氮气,若铁为阳极,则被氧化的是铁,所以此时石墨为阳极,故A错误;随溶液pH降低,c(H+)增大,Cl2+H2OH++Cl-+HClO,平衡逆向移动,溶液中c(HClO)减小,使NH4+的氧化率下降,则氮的去除率随pH的降低而下降,故B错误;除磷时,Fe作阳极失电子生成亚铁离子,亚铁离子和PO43-转化为Fe3(PO4)2沉淀,所以石墨作阴极,水电离出的氢离子放电生成氢气,电极反应式为2H++2e-H2↑,故C正确;ClO-氧化NH3的反应生成氮气,次氯酸根被还原为氯离子,该反应的离子反应方程式为3ClO-+2NH33Cl-+N2↑+3H2O,故D正确。
10.答案(1)MV+-e-MV2+
(2)22.4 不变 (3)高温下氢化酶会失去催化活性
解析(1)根据题意分析可知,生物燃料电池负极区发生氧化反应,电极上的反应式为MV+-e-MV2+。
(2)负极区氢气在氢化酶的作用下发生氧化反应,反应的方程式为H2+2MV2+2H++2MV+,正极区得电子发生还原反应,生成NH3,反应的方程式为N2+6H++6MV+6MV2++2NH3,根据反应可知转移6mol电子时生成2mol氨气,负极区产生6mol氢离子进入正极区,同时正极区消耗6mol氢离子,故氢离子总量不变,当电路中通过3mol电子时,可产生氨气的体积(标准状况下)为22.4L,正极区中n(H+)不变。
(3)高温条件下会导致氢化酶失活,因此不能在高温下正常工作。
11.答案(1)Cr3+ Fe3+ H2O (2)2H++2e-H2↑
(3)铁作阳极可产生还原剂亚铁离子,而石墨作阳极不能提供还原剂 (4)D
解析(1)因为Cr2O72-具有强氧化性,要将Cr2O72-转化成Cr(OH)3沉淀需要还原剂,所以Fe作阳极,该电极上Fe失电子生成Fe2+,Fe2+具有还原性,能将Cr2O72-转化成Cr3+,同时自身被氧化生成Fe3+,根据原子守恒可知铁电极附近溶液中所发生反应的离子方程式为Cr2O72-+6Fe2++14H+2Cr3++6Fe3++7H2O。
(2)根据上述分析可知,Fe作阳极,石墨电极作阴极,H+在阴极得电子发生还原反应,其电极反应式为2H++2e-H2↑。
(3)金属Fe作阳极产生的Fe2+具有还原性,可使重铬酸根离子被还原,而石墨作阳极不能提供还原剂。
(4)因为K3[Fe(CN)6]遇到Fe2+会出现蓝色沉淀,所以可以用K3[Fe(CN)6]溶液检验电解结束后电解液中是否还有Fe2+存在,故选D。
12.答案(1)负 CH4+4CO32--8e-5CO2+2H2O O2+4e-+2CO22CO32-
(2)①Fe+Cu2+Fe2++Cu 0.2 ②2H++2e-H2↑
③溶液变红 O2+2H2O+4e-4OH- 阴 2Cl--2e-Cl2↑ 湿润的淀粉碘化钾试纸
解析(1)原电池中阴离子向负极移动,则装置中CO32-向负极移动;CH4在负极上发生氧化反应,电极反应式为CH4+4CO32--8e-5CO2+2H2O,正极上氧气得电子生成碳酸根离子,电极反应式为O2+4e-+2CO22CO32-。
(2)①图中为原电池反应,Fe为负极,电极反应式为Fe-2e-Fe2+,石墨为正极,电极反应式为Cu2++2e-Cu,总反应式为Fe+Cu2+Fe2++Cu,一段时间后,两电极质量相差12g,则:
Fe+Cu2+Fe2++Cu 两极质量差Δm 转移电子
56g 64g 56g+64g=120g 2mol
12g n
根据上述关系可得120g12g=2moln,解得n=0.2mol;
②氯化铵溶液中,铵根离子水解导致溶液显示酸性,实质是NH4++H2ONH3·H2O+H+,石墨为正极,石墨电极上发生反应2H++2e-H2↑;③若将盐桥换成弯铜导线与石墨b相连成n形,甲装置为原电池,发生铁的吸氧腐蚀,铁为负极,铜为正极,正极上发生反应O2+2H2O+4e-4OH-,铜丝附近溶液呈碱性,滴加酚酞时溶液变红;乙为电解池装置,乙装置中石墨b为阳极,石墨a为阴极,阳极上发生反应2Cl--2e-Cl2↑,生成的氯气可用湿润的淀粉碘化钾试纸检验。
相关文档
- 化学第四章电化学基础第3节电解池2021-07-086页
- 2018届二轮复习电解池金属的电化学2021-07-0814页
- 2019届一轮复习人教版电解池金属的2021-07-0830页
- 全国版2021高考化学一轮复习第19讲2021-07-0872页
- 2018届二轮复习电化学基础课件(44张2021-07-0844页
- 2018届二轮复习电化学原理课件(72张2021-07-0873页
- 2020届高考化学一轮复习金属的电化2021-07-0816页
- 2020届高考化学二轮复习电化学课件2021-07-0898页
- 2019届二轮复习电化学基础作业(全国2021-07-0813页
- 2020届高考化学二轮复习电化学基础2021-07-086页