- 444.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第9章 电化学基础
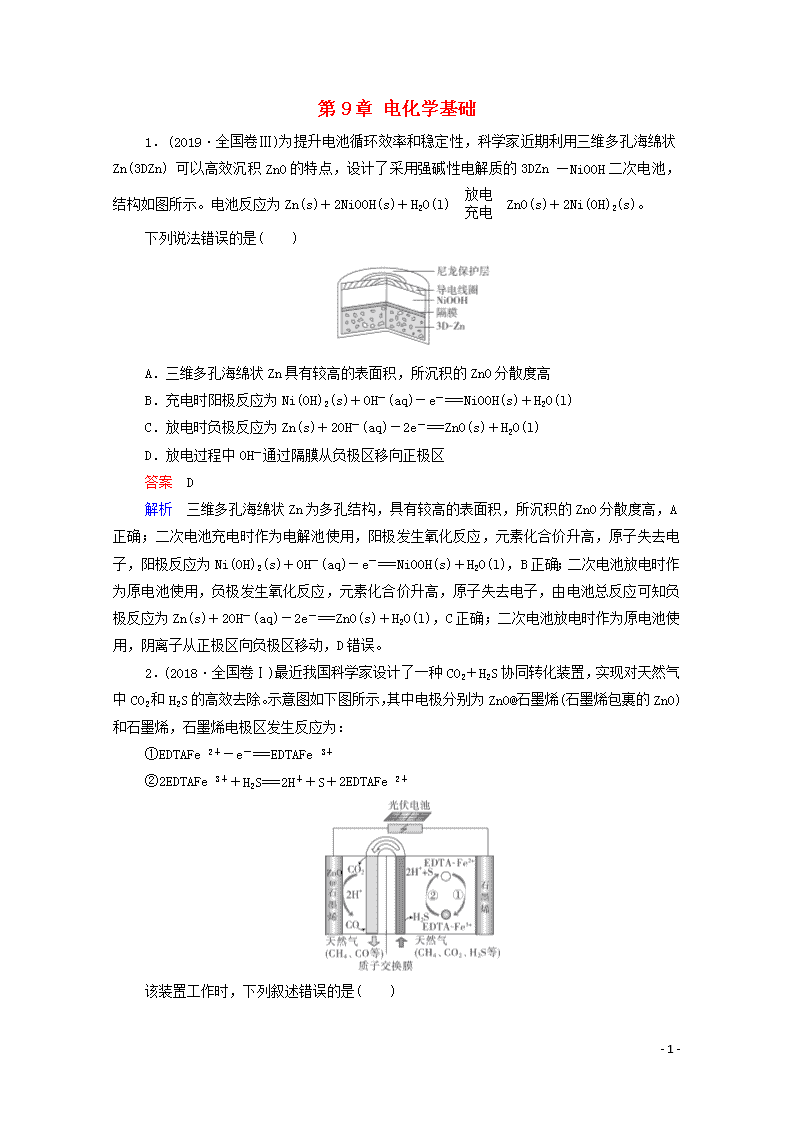
1.(2019·全国卷Ⅲ)为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)ZnO(s)+2Ni(OH)2(s)。
下列说法错误的是( )
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.充电时阳极反应为Ni(OH)2(s)+OH-(aq)-e-===NiOOH(s)+H2O(l)
C.放电时负极反应为Zn(s)+2OH-(aq)-2e-===ZnO(s)+H2O(l)
D.放电过程中OH-通过隔膜从负极区移向正极区
答案 D
解析 三维多孔海绵状Zn为多孔结构,具有较高的表面积,所沉积的ZnO分散度高,A正确;二次电池充电时作为电解池使用,阳极发生氧化反应,元素化合价升高,原子失去电子,阳极反应为Ni(OH)2(s)+OH-(aq)-e-===NiOOH(s)+H2O(l),B正确;二次电池放电时作为原电池使用,负极发生氧化反应,元素化合价升高,原子失去电子,由电池总反应可知负极反应为Zn(s)+2OH-(aq)-2e-===ZnO(s)+H2O(l),C正确;二次电池放电时作为原电池使用,阴离子从正极区向负极区移动,D错误。
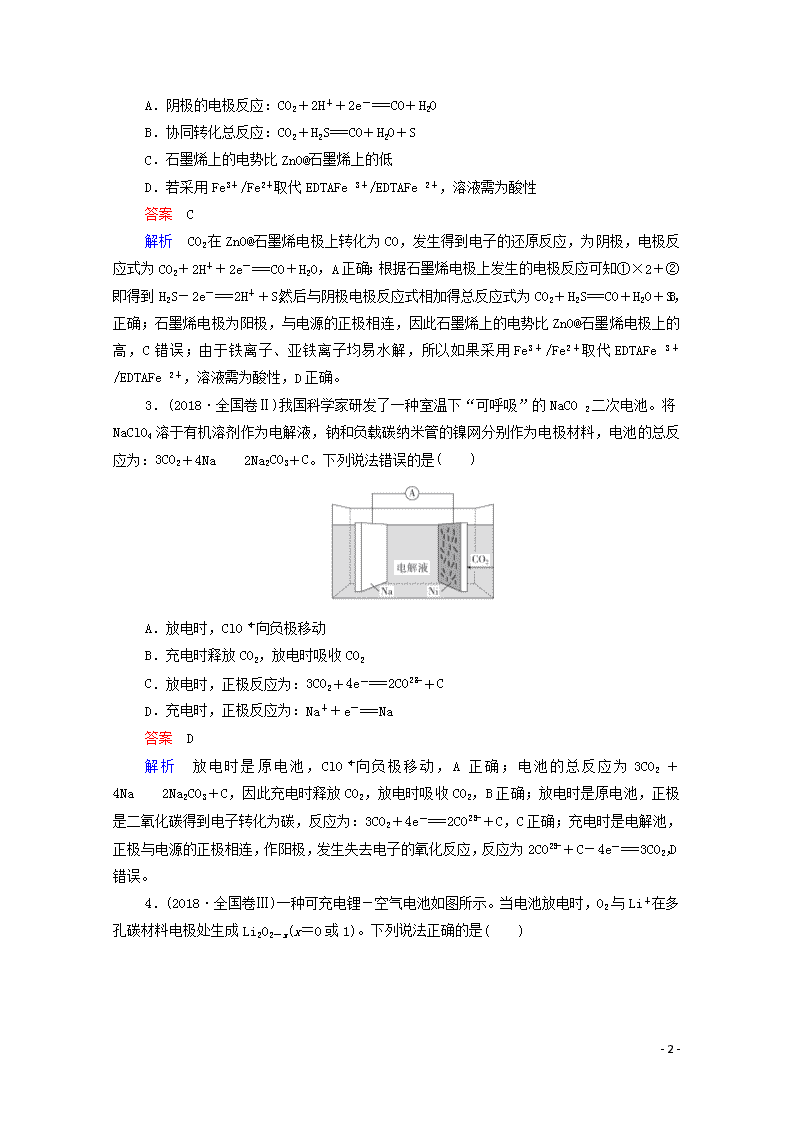
2.(2018·全国卷Ⅰ)最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如下图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
①EDTAFe2+-e-===EDTAFe3+
②2EDTAFe3++H2S===2H++S+2EDTAFe2+
该装置工作时,下列叙述错误的是( )
- 8 -
A.阴极的电极反应:CO2+2H++2e-===CO+H2O
B.协同转化总反应:CO2+H2S===CO+H2O+S
C.石墨烯上的电势比ZnO@石墨烯上的低
D.若采用Fe3+/Fe2+取代EDTAFe3+/EDTAFe2+,溶液需为酸性
答案 C
解析 CO2在ZnO@石墨烯电极上转化为CO,发生得到电子的还原反应,为阴极,电极反应式为CO2+2H++2e-===CO+H2O,A正确;根据石墨烯电极上发生的电极反应可知①×2+②即得到H2S-2e-===2H++S,然后与阴极电极反应式相加得总反应式为CO2+H2S===CO+H2O+S,B正确;石墨烯电极为阳极,与电源的正极相连,因此石墨烯上的电势比ZnO@石墨烯电极上的高,C错误;由于铁离子、亚铁离子均易水解,所以如果采用Fe3+/Fe2+取代EDTAFe3+/EDTAFe2+,溶液需为酸性,D正确。
3.(2018·全国卷Ⅱ)我国科学家研发了一种室温下“可呼吸”的NaCO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na2Na2CO3+C。下列说法错误的是( )
A.放电时,ClO向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为:3CO2+4e-===2CO+C
D.充电时,正极反应为:Na++e-===Na
答案 D
解析 放电时是原电池,ClO向负极移动,A正确;电池的总反应为3CO2+4Na2Na2CO3+C,因此充电时释放CO2,放电时吸收CO2,B正确;放电时是原电池,正极是二氧化碳得到电子转化为碳,反应为:3CO2+4e-===2CO+C,C正确;充电时是电解池,正极与电源的正极相连,作阳极,发生失去电子的氧化反应,反应为2CO+C-4e-===3CO2,D错误。
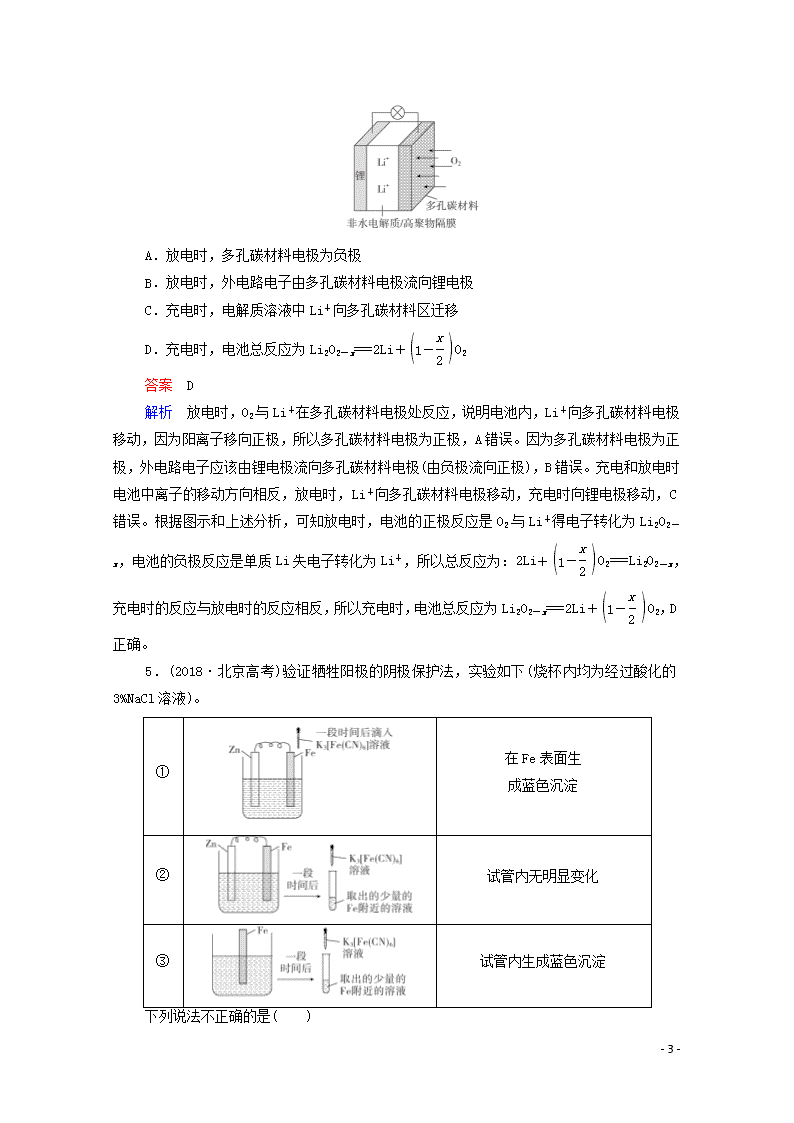
4.(2018·全国卷Ⅲ)一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是( )
- 8 -
A.放电时,多孔碳材料电极为负极
B.放电时,外电路电子由多孔碳材料电极流向锂电极
C.充电时,电解质溶液中Li+向多孔碳材料区迁移
D.充电时,电池总反应为Li2O2-x===2Li+O2
答案 D
解析 放电时,O2与Li+在多孔碳材料电极处反应,说明电池内,Li+向多孔碳材料电极移动,因为阳离子移向正极,所以多孔碳材料电极为正极,A错误。因为多孔碳材料电极为正极,外电路电子应该由锂电极流向多孔碳材料电极(由负极流向正极),B错误。充电和放电时电池中离子的移动方向相反,放电时,Li+向多孔碳材料电极移动,充电时向锂电极移动,C错误。根据图示和上述分析,可知放电时,电池的正极反应是O2与Li+得电子转化为Li2O2-x,电池的负极反应是单质Li失电子转化为Li+,所以总反应为:2Li+O2===Li2O2-x,充电时的反应与放电时的反应相反,所以充电时,电池总反应为Li2O2-x===2Li+O2,D正确。
5.(2018·北京高考)验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
①
在Fe表面生
成蓝色沉淀
②
试管内无明显变化
③
试管内生成蓝色沉淀
下列说法不正确的是( )
- 8 -
A.对比②③,可以判定Zn保护了Fe
B.对比①②,K3[Fe(CN)6]可能将Fe氧化
C.验证Zn保护Fe时不能用①的方法
D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼
答案 D
解析 对比②③,②Fe附近的溶液中加入K3[Fe(CN)6]无明显变化,说明②Fe附近的溶液中不含Fe2+,③Fe附近的溶液中加入K3[Fe(CN)6]产生蓝色沉淀,说明③Fe附近的溶液中含Fe2+,②中Fe被保护,A正确;①加入K3[Fe(CN)6]在Fe表面产生蓝色沉淀,Fe表面产生了Fe2+,对比①②的异同,①可能是K3[Fe(CN)6]将Fe氧化成Fe2+,B正确;对比①②,①加入K3[Fe(CN)6]在Fe表面产生蓝色沉淀,①也能检验出Fe2+,不能用①的方法验证Zn保护Fe,C正确;由实验可知K3[Fe(CN)6]可能将Fe氧化成Fe2+,将Zn换成Cu不能用①的方法证明Fe比Cu活泼,D错误。
6.(2017·全国卷Ⅱ)用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4H2C2O4混合溶液。下列叙述错误的是( )
A.待加工铝质工件为阳极
B.可选用不锈钢网作为阴极
C.阴极的电极反应式为Al3++3e-===Al
D.硫酸根离子在电解过程中向阳极移动
答案 C
解析 C错:阴极发生的电极反应为2H++2e-===H2↑。
7.(2017·全国卷Ⅲ)全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为16Li+xS8===8Li2Sx(2≤x≤8)。下列说法错误的是( )
A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-===3Li2S4
B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中Li2S2的量越多
答案 D
解析 A对:原电池工作时,Li+
- 8 -
向正极移动,则a为正极,正极上发生还原反应,a极发生的电极反应有S8+2Li++2e-===Li2S8、3Li2S8+2Li++2e-===4Li2S6、2Li2S6+2Li++2e-===3Li2S4、Li2S4+2Li++2e-===2Li2S2等。B对:电池工作时,外电路中流过0.02 mol电子时,氧化Li的物质的量为0.02 mol,质量为0.14 g。C对:石墨烯能导电,利用石墨烯作电极,可提高电极a的导电性。D错:电池充电时电极a发生反应:2Li2S2-2e-=== Li2S4+2Li+,充电时间越长,电池中Li2S2的量越少。
8.(2017·海南高考)一种电化学制备NH3的装置如图所示,图中陶瓷在高温时可以传输H+。下列叙述错误的是( )
A.Pd电极b为阴极
B.阴极的反应式为N2+6H++6e-===2NH3
C.H+由阳极向阴极迁移
D.陶瓷可以隔离N2和H2
答案 A
解析 此装置为电解池,总反应式是N2+3H2===2NH3,Pd电极b上是氢气发生氧化反应,即氢气失去电子化合价升高,Pd电极b为阳极,故A说法错误;根据A项分析,Pd电极a为阴极,反应式为N2+6H++6e-===2NH3,故B说法正确;根据电解池的原理,阳离子在阴极上放电,即H+由阳极移向阴极,故C说法正确;根据装置图,陶瓷可以隔离N2和H2,故D说法正确。
9.(2019·高考组合题)
(1)(全国卷Ⅲ)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
负极区发生的反应有____________________________________________(写反应方程式)。电路中转移1 mol电子,需消耗氧气________L(标准状况)。
(2)(北京高考)可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。
- 8 -
①制H2时,连接________。
产生H2的电极反应式是________________________。
②改变开关连接方式,可得O2。
③结合①和②中电极3的电极反应式,说明电极3的作用:
________________________________________________。
答案 (1)Fe3++e-===Fe2+,4Fe2++O2+4H+===4Fe3++2H2O 5.6
(2)①K1 2H2O+2e-===H2↑+2OH- ③制H2时,电极3发生反应:Ni(OH)2+OH--e-===NiOOH+H2O。制O2时,上述电极反应逆向进行,使电极3得以循环使用
解析 (1)由题图中H+的移动方向知,左端的电极反应为Fe3++e-===Fe2+,应为阴极,接电源负极,右端的电极反应为2HCl-2e-===Cl2+2H+,应为阳极,接电源正极,负极产生的Fe2+进一步被O2氧化生成Fe3+,则4Fe2++O2+4H+===4Fe3++2H2O;由此可知,每消耗1 mol O2,需转移4 mol电子,则转移1 mol电子时,应消耗 mol O2,标准状况下, mol O2的体积为 mol×22.4 L/mol=5.6 L。
(2)①电解时,阴极产生H2,即电极1产生H2,此时开关连接K1,阴极H2O得电子生成H2,电极反应式为2H2O+2e-===H2↑+2OH-。
③连接K1时,电极3反应为Ni(OH)2-e-+OH-===NiOOH+H2O;当连接K2制O2时,电极3反应为NiOOH+e-+H2O===Ni(OH)2+OH-。由以上电极反应可看出,不同的连接方式,可使电极3循环使用。
10.(2018·高考组合题)
(1)(全国卷Ⅰ)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为____________________________。电解后,________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。
- 8 -
(2)(全国卷Ⅲ)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式________________________________。
②电解过程中通过阳离子交换膜的离子主要为__________,其迁移方向是________。
(3)(天津高考)O2辅助的Al~CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________________________。
电池的正极反应式:6O2+6e-===6O
6CO2+6O===3C2O+6O2
反应过程中O2的作用是________。
该电池的总反应式:_____________________________。
答案 (1)2H2O-4e-===4H++O2↑ a
(2)①2H2O+2e-===2OH-+H2↑ ②K+ a到b
(3)Al-3e-===Al3+(或2Al-6e-===2Al3+) 催化剂 2Al+6CO2===Al2(C2O4)3
解析 (1)阳极发生失去电子的氧化反应,阳极区是稀硫酸,氢氧根离子放电,则电极反应式为2H2O-4e-===4H++O2↑。阳极区氢离子浓度增大,通过阳离子交换膜进入a室与亚硫酸钠结合生成亚硫酸氢钠。阴极是氢离子放电,氢氧根离子浓度增大,与亚硫酸氢钠反应生成亚硫酸钠,所以电解后a室的亚硫酸氢钠浓度增加。
(2)①由图可知,阴极为氢氧化钾溶液,所以反应为水电离出的氢离子得电子,反应为2H2
- 8 -
O+2e-===2OH-+H2↑。②电解时,溶液中的阳离子应该向阴极迁移,明显是溶液中大量存在的钾离子迁移,方向为由左向右,即由a到b。
(3)明显电池的负极为Al,所以反应一定是Al失电子,该电解质为氯化铝离子液体,所以Al失电子应转化为Al3+。根据电池的正极反应,氧气在第一步被消耗,又在第二步生成,所以氧气为正极反应的催化剂。将正、负极反应式加和得到总反应为:2Al+6CO2===Al2(C2O4)3。
- 8 -
相关文档
- 湖南省衡阳县第四中学2020届高三362021-07-0816页
- 河北省廊坊市高中联合体2020届高三2021-07-0824页
- 高中化学鲁科版选修3课后练习:1-2-22021-07-084页
- 2020届一轮复习人教版化学实验的基2021-07-0813页
- 湖南省长沙市长沙六中2020届高三上2021-07-085页
- 辽宁省锦州市2021届新高考模拟化学2021-07-0820页
- 2020新教材高中化学第2章化学键化2021-07-088页
- 【化学】西藏自治区拉萨市拉萨中学2021-07-0812页
- 2021版高考化学一轮复习章末总结练2021-07-0813页
- 浙江省2021高考化学一轮复习专题二2021-07-0847页