- 1.05 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020-2021 学年度第一学期期中教学质量检测
高三化学试题
本试卷分第 I 卷(选择题)和第 II 卷(非选择题)两部分,满分 100 分,考试用时 90 分钟。
注意事项:
1.答题前,考生务必用 0.5 毫米黑色签字笔将自己的姓名、座号、考生号、县区和科类填写到
答题卡和试卷规定的位置上。
2.第 I 卷每小题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用
橡皮擦干净后,再选涂其它答案标号。
3.第 II 卷必须用 0.5 毫米黑色签字笔作答,答案必须写在答题卡各题目指定区域内相应的位置;
如需改动,先划掉原来的答案,然后再写上新的答案;不能使用涂改液、胶带纸、修正带。
不按以上要求作答的答案无效。
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 Si 28 S 32 K
39 Fe 56 I
第 I 卷 选择题(40 分)
一、选择题(本题共 10 个小题,每小题 2 分,共 20 分,每小题只有一个选项符合题意)
1.化学与生活密切相关。下列叙述错误的是
A.十二水合硫酸铝钾可用作净水剂
B.二氧化硫可用于杀菌消毒,还可用作食品添加剂
C.碳酸钠和碳酸氢钠均能与酸反应,都可用作膨松剂
D.补铁口服液中除含铁化合物外常添加维生素 C 作抗氧化剂
2.古代的很多诗歌、谚语都蕴含着科学知识。下列解释正确的是
A.“忽闻海上有仙山,山在虚无缥缈间”的海市蜃楼是一种自然现象,与胶体知识有关
B.“春蚕到死丝方尽,蜡炬成灰泪始干”,“泪”是指石蜡燃烧生成的水
C.“爆竹声中除旧岁,春风送暖人屠苏”,爆竹爆炸发生的是分解反应
D.“纷纷灿烂如星陨,赫赫喧雁似火攻”中烟花是某些金属元素发生化学变化呈现出的颜色
3.NA 是阿伏加德罗常数的值。下列说法正确的是
A.2 L 0.1 mol·L-1 Na2SiO3 溶液中含 SiO32-的数目为 0.2NA
B.含 0.1 mol Na+的 Na2O 和 Na2O2 的混合物中阴离子总数等于 0.05NA
C.用焦炭将 6.0 g SiO2 完全还原为单质 Si 生成 CO 的分子数为 0.1NA
D.标准状况下,2.24 L Cl2 完全溶于水时所得溶液中含氯微粒总数为 0.2NA
4.短周期主族元素 R、X、Y、Z 的原子序数依次增大,R 元素最高正价和最低负价的代数和为
2,在短周期主族元素中 X 原子半径最大,Y 的单质可与某些金属氧化物反应用于焊接钢轨,
Z 元素形成的单质可使湿润的有色布条褪色。下列说法错误的是
A.最高价氧化物对应水化物的碱性:X>Y
B.R 元素的氢化物可用作制冷剂
C.Z 元素分别与 X、Y 元素形成的化合物一定是离子化合物
D.工业上常用电解法冶炼 X 和 Y 的单质
5.下列对物质的主要用途、原因解释的描述都正确的是
6.下列关于化学用语的表述正确的是
A.BF3 的电子式: B.Fe2+的原子结构示意图:
C.中子数为 143 的 U 原子: 235
92 U D.乙醇的结构简式:C2H6O
7.对于下列实验,能正确描述其反应的离子方程式是
A.向碳酸氢铵溶液中加入足量的澄清石灰水:Ca2++HCO3
-+OH-=CaCO3↓+H2O
B.向水垢中滴加足量醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
C.向 H2O2 溶液中滴加少量 FeCl3:Fe3++H2O2=O2↑+2H++Fe2+
D.用 Na2SO3 溶液吸收少量 Cl2:3SO32-+Cl2+H2O=2HSO3
-+2Cl-+SO42-
8.为完成相应实验,所用仪器、试剂及相关操作合理的是
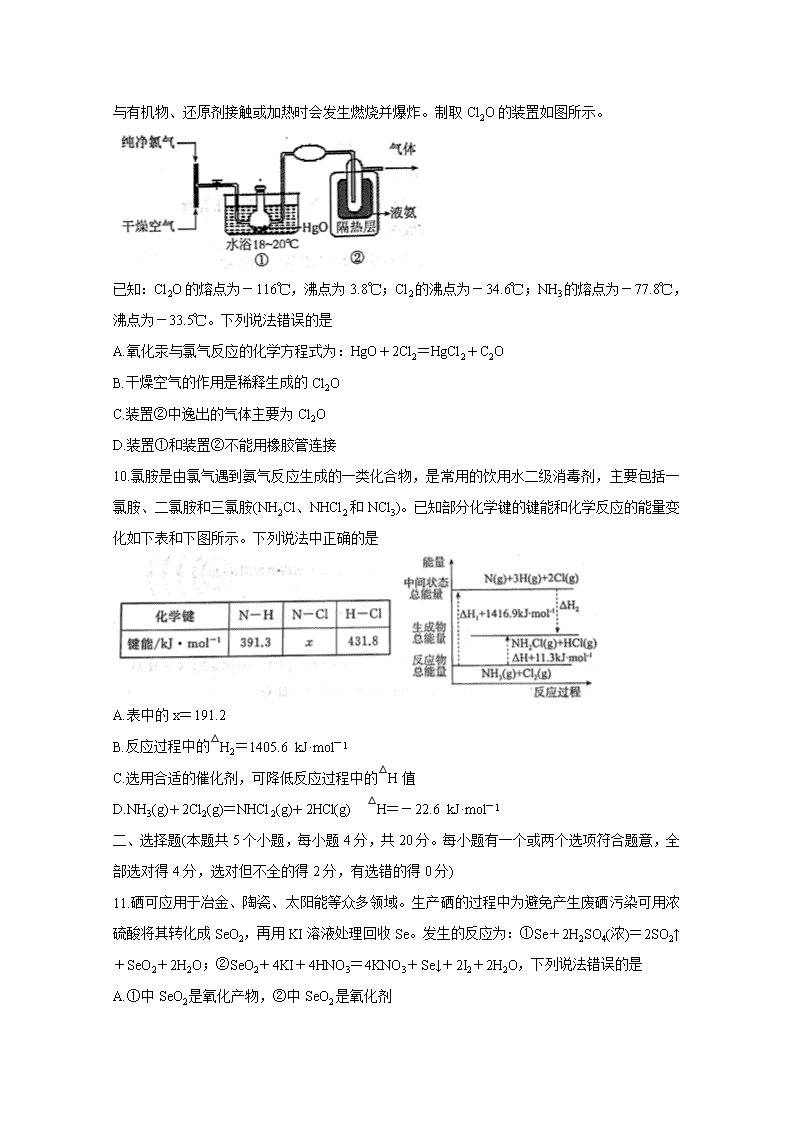
9.氧化汞与氯气反应可制备次氯酸的酸酐 Cl2O,Cl2O 是一种易溶于水的气体,有强氧化性,
与有机物、还原剂接触或加热时会发生燃烧并爆炸。制取 Cl2O 的装置如图所示。
已知:Cl2O 的熔点为-116℃,沸点为 3.8℃;Cl2 的沸点为-34.6℃;NH3 的熔点为-77.8℃,
沸点为-33.5℃。下列说法错误的是
A.氧化汞与氯气反应的化学方程式为:HgO+2Cl2=HgCl2+C2O
B.干燥空气的作用是稀释生成的 Cl2O
C.装置②中逸出的气体主要为 Cl2O
D.装置①和装置②不能用橡胶管连接
10.氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一
氯胺、二氯胺和三氯胺(NH2Cl、NHCl2 和 NCl3)。已知部分化学键的键能和化学反应的能量变
化如下表和下图所示。下列说法中正确的是
A.表中的 x=191.2
B.反应过程中的△H2=1405.6 kJ·mol-1
C.选用合适的催化剂,可降低反应过程中的△H 值
D.NH3(g)+2Cl2(g)=NHCl2(g)+2HCl(g) △H=-22.6 kJ·mol-1
二、选择题(本题共 5 个小题,每小题 4 分,共 20 分。每小题有一个或两个选项符合题意,全
部选对得 4 分,选对但不全的得 2 分,有选错的得 0 分)
11.硒可应用于冶金、陶瓷、太阳能等众多领域。生产硒的过程中为避免产生废硒污染可用浓
硫酸将其转化成 SeO2,再用 KI 溶液处理回收 Se。发生的反应为:①Se+2H2SO4(浓)=2SO2↑
+SeO2+2H2O;②SeO2+4KI+4HNO3=4KNO3+Se↓+2I2+2H2O,下列说法错误的是
A.①中 SeO2 是氧化产物,②中 SeO2 是氧化剂
B.反应②体现了 HNO3 的酸性
C.使用该方法回收 1 mol Se 共转移电子 4 mol
D.氧化性由强到弱的顺序是:H2SO4(浓)>I2>SeO2
12.硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中
探究采用废铁屑来制备硫酸铁铵,具体流程如下:
下列说法中正确的是
A.步骤①中可通过加入氯化铵溶液去除废铁屑表面的油污
B.步骤②中可采取水浴加热方式
C.步骤③中 H2O2 可替换为稀硝酸溶液
D.步骤⑤的具体实验操作为蒸发浓缩、降温结晶、过滤、洗涤,干燥后得到硫酸铁铵晶体
13.甲烷和二氧化碳在催化剂作用下转化为乙酸的反应历程如图所示,下列说法错误的是
A.CH4 在催化剂表面转化为中间体①会释放能量
B.中间体①的能量小于中间体②的能量
C.中间体①转化为中间体②的过程中形成了 C-C 键
D.甲烷转化为乙酸的过程中有两种类型的化学键断裂
14.下列实验操作能达到实验目的且现象描述正确的是
15.以海绵铜(含有少量 CuO 杂质的海绵状的铜)为原料生产 CuCl 的工艺流程如图所示。
已知 CuCl 难溶于水,可溶于氯离子浓度较大的溶液,易水解、氧化。下列说法正确的是
A.“溶解”过程中可用浓盐酸代替硫酸
B.“溶解”过程中反应的离子方程式为 Cu+4H++2NO3
-=Cu2++2NO2↑+2H2O
C.“反应”过程中反应的离子方程式为 2Cu2++2Cl-+SO32-+H2O=2CuCl↓+SO42-+2H+
D.“烘干”过程可用坩埚在空气中进行
第 II 卷 非选择题(60 分)
三、非选择题(共 5 小题,每小题 12 分,共 60 分)
16.(12 分)X、Y、Z、W、R 为原子序数依次增大的前 20 号主族元素,X 是短周期原子半径最
小的元素,Y 的最外层电子数是其内层电子数的 3 倍,乙、W 为同周期相邻元素,W2Y32-在
酸性条件下可发生歧化反应,R 原子核外没有未成对电子。回答下列问题:
(1)X 与 Z 组成的最简单化合物的电子式为 。
(2)W 元素在周期表中的位置是 ,W2Y32-在酸性条件发生歧化反应的离子方程式
为 。
(3)X 与 R 组成的物质为 (填“共价”或“离子”)化合物,该物质可作为野外工作
的应急燃料,其与水反应的化学方程式为 。
(4)科学家于 2000 年合成了元素周期表中与 Y 同主族的第 7 周期的鉝(Lv)元素,该元素的原子
序数为 ;比较 Y 的简单氢化物与 W 的氢化物沸点高低: (用化学式
表示),判断依据是 。
17.(12 分)合理处理碳、氮氧化物,减少在大气中的排放,在生产、生活中有重要意义。回答
下列问题:
(1)利用 H2 还原 CO2 是减少 CO2 排放的一种方法。H2 在 Cu-ZnO 催化下可与 CO2 同时发生反
应 I、II,两反应的反应过程与能量的关系如图所示。
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1
II.CO2(g)+H2(g) CO(g)+H2O(g) △H2
由图可知反应 I 是 反应(填“吸热”或“放热”),△H1 △H2(填“>”、“<”
或“=”)。
(2)H2 还可以将 CO2 还原为 CH4(g)和 H2O(l)。已知 25℃、101 kPa 时 H2 和 CH4 的燃烧热分别为
285.8 kJ·mol-1 和 890.3 kJ·mol-1,则 25℃、101 kPa 时 H2 与 CO2 反应生成 CH4(g)和 H2O(l)的
热化学方程式为 。
(3)利用反应 II 生成的 CO 可将 N2O 转化为 N2,反应的能量变化及反应历程如图所示,依次进
行两步反应的化学方程式分别为①N2O+Fe+=N2+FeO+(慢),②FeO++CO=CO2+Fe+(快)。
反应过程中的中间产物是 ,每转化 22.4 L(标准状况)N2O 转移电子的数目
为 ,反应①和反应②的活化能 Ea① Ea②(填“>”或“<”)。
18.(12 分)K3[Fe(C2O4)3](三草酸合铁酸钾)溶于水,难溶于乙醇,是制备负载型活性铁催化剂的
主要原料。实验室中先利用下图装置制备 FeC2O4·2H2O(夹持装置略去),后续再制取三草酸
合铁酸钾。
回答下列问题:
实验一:FeC2O4·2H2O 晶体的制备
(1)打开 K1、K3 和 K4,关闭 K2,向装置 A 中加入稍过量的稀硫酸。
①A 中溶液由无色逐渐变为浅绿色,该反应的离子方程式为 。
②同时 A 中有气体产生,该气体的作用是 。
(2)收集 H2 并验纯后,打开 K2,关闭 ,让 A 中浅绿色溶液流入 B 中,以生成 FeC2O4,
分离得 FeC2O4·2H2O 晶体。
实验二:K3[Fe(C2O4)3]的制备
(3)将实验一得到的 FeC2O4·2H2O 溶于水,加入 H2O2、H2C2O4 和 K2C2O4,酒精灯微热并不断
搅拌,反应制得 K3[Fe(C2O4)3]。
①写出该反应的化学方程式 。
②“微热、搅拌”的目的是 ;若加热温度太高,对反应造成的主要
影响是 。
③从上述反应后的溶液中分离得到 K3[Fe(C2O4)3]·3H2O 晶体,测定所得产品的纯度:称取 a g
晶体溶于 100 mL 水中配成溶液,取 20 mL 溶液于锥形瓶中,用 c mol·L-1 的酸性 K2Cr2O7 标
准溶液进行滴定(Cr2O72-被还原为 Cr3+),进行了三次平行实验,达到滴定终点时平均消耗标准
溶液 V mL,则所得产品的纯度为 %(用含 V、c、a 的代数式表示)。
19.(12 分)焦亚硫酸钠(Na2S2O5)是葡萄酒中常用的抗氧化剂。以硫黄为原料的传统湿法生产工
艺流程如下:
已知:NaHSO3 的过饱和溶液经结晶脱水可生成 Na2S2O5。
回答下列问题:
(1)为便于焚烧,可对硫黄采取的措施是 。
(2)废水中含有硫单质,其中一种分子组成为 S8,可与 KOH 溶液发生如下反应:
3S8+48KOH 16K2S+8K2SO3+24H2O,该反应中氧化剂与还原剂的物质的量之比
为 。
(3)反应器中发生反应的离子方程式为 。
(4)Na2S2O5 是强还原剂,很容易被 O2 氧化,同时放出一种有刺激性气味的气体,该反应的化
学方程式为 。
(5)Na2S2O5 生产过程中会产生 SO2,SO2 在空气中的含量超过 0.02 mg·L-1 就会危害人类健康。
可用如下装置测定空气中 SO2 的含量。
①取 5 mL 5×10-4 mol·L-1 的碘溶液 E 入试管中,再加入 2~3 滴淀粉溶液,在测定地点慢慢
抽气,每次抽气 100 mL,直到试管中的溶液 (填写现象)。
②记录抽气次数 n。n≥ ,说明气体符合安全标准(假设气体均处于标准状况)。
③抽气时应慢慢抽拉活塞,原因是 。
20.(12 分)铜及亚铜盐在工业生产和科学研究中有着重要的应用,某化学研究小组在实验中对
铜及亚铜盐的制备进行探究。
已知:Cu2SO3 在水溶液中易被氧气氧化,Cu+在强酸性条件下不稳定,能发生歧化反应生成
Cu 和 Cu2+;aCu2SO3·bCuSO3·2H2O 是一种深红色固体。
回答下列问题:
(1)仪器 X 的名称是 。
(2)装入药品后反应开始前进行的操作是 。
(3)打开分液漏斗活塞,X 中产生气体,反应的化学方程式为 。
(4)反应一段时间后,装置 B 中生成一种无色晶体,为分析晶体成分,进行如下探究:
①提出假设
i.该晶体的主要成分为 Cu2SO3·xH2O;
ii.该晶体的主要成分为 。
②甲同学取反应后 B 中溶液,加入足量稀盐酸,再滴加 BaCl2 溶液,有白色沉淀生成;取所得
晶体,加足量稀硫酸,晶体溶解,有红色固体生成,溶液变为蓝色同时有刺激性气味气体生
成。
③综上所述,得出的结论是 。
④装置 B 中发生反应的离子方程式是 。
(5)请指出上述装置的不足之处 。