- 573.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
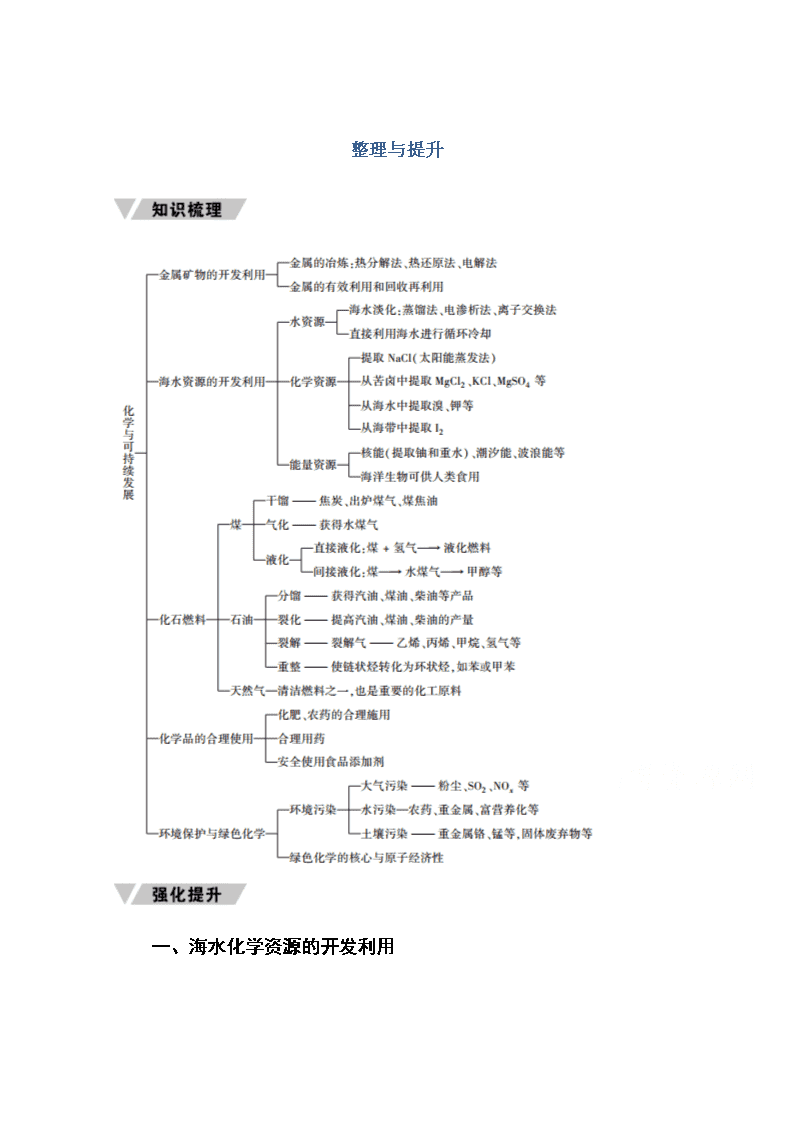
整理与提升
一、海水化学资源的开发利用
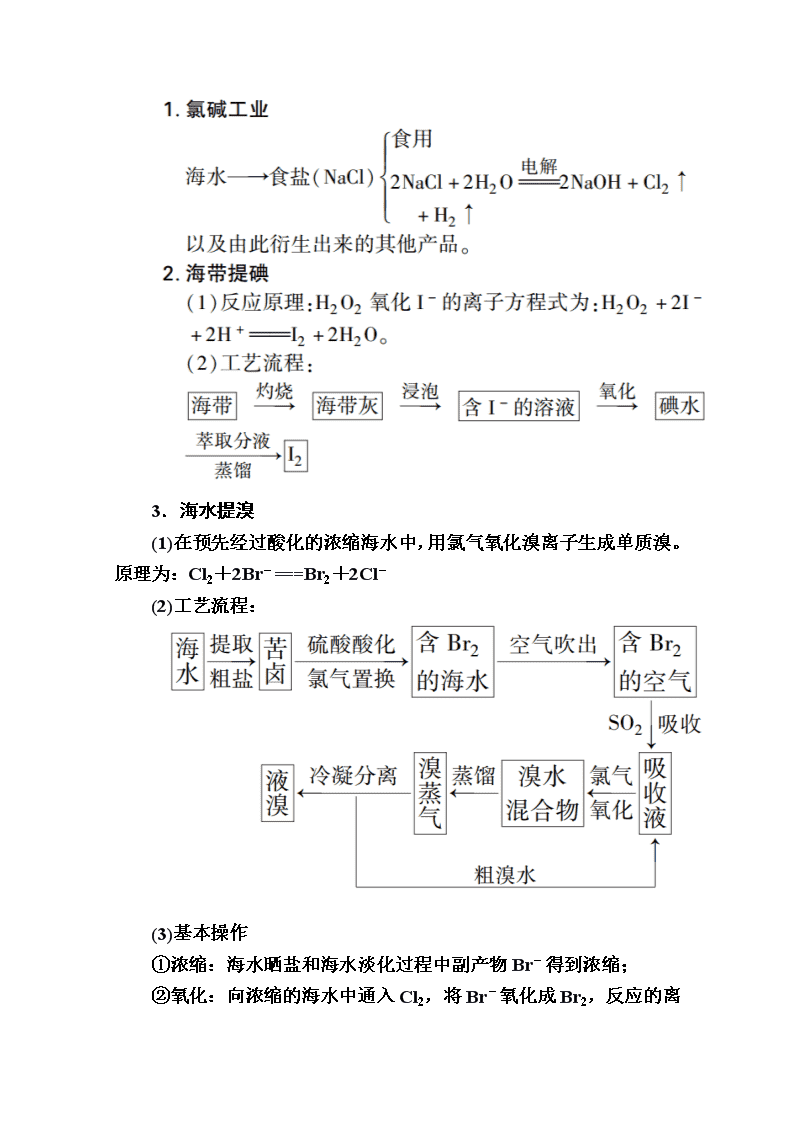
3.海水提溴
(1)在预先经过酸化的浓缩海水中,用氯气氧化溴离子生成单质溴。原理为:Cl2+2Br-===Br2+2Cl-
(2)工艺流程:
(3)基本操作
①浓缩:海水晒盐和海水淡化过程中副产物Br-得到浓缩;
②氧化:向浓缩的海水中通入Cl2,将Br-氧化成Br2
,反应的离子方程式为Cl2+2Br-===Br2+2Cl-;
③富集:利用溴的挥发性,通入热空气和水蒸气,吹出的溴蒸气用SO2吸收,反应方程式为:Br2+SO2+2H2O===2HBr+H2SO4;
④提取:再用Cl2氧化HBr得到产品溴。
4.海水提镁
(1)工艺流程:
(2)有关化学反应方程式
CaCO3CaO+CO2↑
CaO+H2O===Ca(OH)2
MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl===MgCl2+2H2O
MgCl2·6H2OMgCl2+6H2O
MgCl2(熔融)Mg+Cl2↑
1.我国拥有很长的海岸线,具有丰富的海洋资源,以海水为原料的盐化工是我国重要产业。盐卤是海水晒盐后的富含镁盐的溶液,其中除含镁盐外,还含有其他盐类(如图甲所示)。盐卤在食品、化工等方面具有广泛的用途。请解答下列与盐卤有关的题目:
(1)根据图甲所示,写出盐卤中含量最多的两种盐的化学式:
NaCl、MgCl2。
(2)图乙是盐卤中某些物质的溶解度曲线,已知t1 ℃时,MgSO4和KCl的溶解度分别为M、N,则它们溶解度大小的关系为M=N;将盐卤加热到t2 ℃以上,根据溶解度曲线,首先析出的晶体应是
MgSO4。
(3)化工厂利用卤水生产金属镁的工艺流程如图所示:
“操作①”的目的是将氢氧化镁沉淀分离出来,操作①的名称是过滤。氢氧化镁与试剂B反应的化学方程式为Mg(OH)2+2HCl===MgCl2+2H2O。
操作②的名称是蒸发、结晶。该方法的优点为就地取材,节约资源,降低成本。
(4)用电解法制备金属镁,两位同学分别设计了下面的两种方法。
甲:电解氯化镁溶液
乙:电解熔融的氯化镁
其中同学乙(填“甲”或“乙”)能够成功地制备金属镁,假设生产过程中镁元素没有损失,则100 g卤水可制备镁4.8 g。
解析:(1)从甲图中可以看出1 000 g盐卤中含有的NaCl、
MgCl2、MgSO4、KCl分别为163.0 g、142.5 g、60.0 g、22.0 g
。由此可见,含量最多的是NaCl、MgCl2。
(2)在t1 ℃时,KCl和MgSO4的溶解度曲线相交;t2 ℃以后,MgSO4的溶解度随着温度的升高而降低,故升高到一定温度时首先析出的是MgSO4。
(3)分离固体与液体混合物应用过滤方法,而使溶液中的溶质以晶体的形式析出则需要蒸发、结晶。由于就地选用了海边的贝壳为原料来生产CaO,所以节约了资源,降低了生产成本。
(4)制备金属镁应该电解熔融的MgCl2,如果电解氯化镁溶液则得到的不是镁,而是氢气;根据卤水中镁元素守恒,可以得出电解所得到的镁的质量为100 g××+100 g××=3.6 g+1.2 g=4.8 g。
二、环境保护与绿色化学
1.环境问题
环境问题主要是指由于人类不合理地开发利用自然资源而造成的生态环境破坏,以及工农生产中和人类生活中所造的环境污染。
“三废”的污染是指
(1)大气污染
大气污染物主要来自化石燃料燃烧和工业生产过程中产生的废气及其携带的颗粒物。
(2)水污染
工业废水,生活污水,农田过度施肥,喷洒农药都会对水源造成污染。
(3)固体废弃物污染 如白色污染
当今环境污染主要存在以下几个方面的问题
环境问题
主要污染物
主要危害
温室效应
CO2
造成全球气候变暖,水位上升,陆地面积减少。
酸雨
SO2、NOx
土壤酸化、水源污染、建筑物被侵蚀等。
臭氧层
破坏
氟氯代烷、
NOx
到达地球表面的紫外线明显增多,给人类健康及生态环境带来多方面的危害。
光化学
烟雾
碳氢化合
物、NOx
刺激人体器官,特别是人的呼吸系统,使人生病并甚至死亡。
白色污染
废弃塑
料制品
①在土壤中影响农作物吸收水分和养分,导致农作物减产;②混入生活垃圾中难处理、难回收;③易被动物当作食物吞入,导致动物死亡。
赤潮和
水华
废水中含
N、P的
营养物质
使水体富营养化,导致水中藻类疯长,消耗水中溶解的氧,使水体变得浑浊绿色、水质恶化。
2.绿色化学
(1)原子经济
原子经济要求反应物的原子全部转化为期望的最终产物,原子的利用率达到100%,也就是说在化学反应中不产生任何废物。如化合、加成、加聚等反应就可达到。
原子利用率=×100%
(2)绿色化学
绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染。
3.可持续发展
可持续发展是指满足现代人的需求又不损害后代人满足其需求的能力的发展,需要经济、社会、资源和环境保护协调发展。可持续发展的要点是发展援助、环境保护、清洁水源、能源开发、绿色贸易。
2.化学与生活息息相关。根据你的认知和体验,下列说法或做法不正确的是( C )
①绿色食品就是不使用化肥农药,不含任何化学物质的食品
②为使蔬菜保鲜,常在其表面洒少许福尔马林溶液
③为了防止某些富脂食物因被氧化而变质,常在包装袋里放生石灰
④酸雨是pH<7的雨水,主要是由大气中的SO2、NO2等造成的
⑤75%酒精比无水乙醇用作医用消毒剂效果好
⑥为了延长食品的保质期,向其中添加大量苯甲酸钠等防腐剂
A.②④⑤ B.①②③⑤⑥
C.①②③④⑥ D.②③④⑤⑥
解析:绿色食品应具备条件:遵循可持续发展原则,按照标准使用化学物质生产的食品,①错误;福尔马林有毒,不能用于食品保鲜,②错误;在包装袋里放铁粉可防止食品氧化,生石灰只能用于干燥,③错误;pH<5.6的雨水是酸雨,④错误;75%的酒精既具有杀毒作用又具有渗透性,⑤正确;防腐剂不能大量使用,⑥错误。
3.二氧化硫是一种危害严重的大气污染物,烟气脱硫是控制二氧化硫污染的主要技术手段。
利用海水脱硫是一种有效的方法,其工艺流程如图所示:
某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图所示。
(1)根据图示实验结果,为了提高一定浓度含硫烟气中SO2的吸收效率,下列措施正确的是ABD(填字母)。
A.降低通入含硫烟气的温度
B.减小通入含硫烟气的流速
C.减少天然海水的进入量
D.在天然海水中加入生石灰
(2)天然海水吸收了含硫烟气后会溶有H2SO3,使用空气中的氧气将其氧化,写出该反应的离子方程式2H2SO3+O2===4H++2SO。
(3)该小组采用如图装置在实验室测定烟气中SO2的体积分数(假设烟气中其余组分不能与水反应且不溶于水,实验在标准状况下进行):
①上述装置连接的正确顺序是:原料气→c→d→b→a→e。(填a、b、c、d、e)
②下列试剂中(浓度、体积一定),可以用来代替试管中的I2—淀粉溶液的是AC(填字母)。
A.酸性KMnO4溶液 B.NaOH溶液
C.溴水 D.氨水
解析:(1)总体看,SO2
的吸收效率随温度的升高而降低;当温度和SO2的浓度一定时,SO2的吸收效率随烟气流速的增大而降低;当温度和烟气流速一定时,SO2的吸收效率随SO2浓度的增大而降低,所以,要提高一定浓度含硫烟气中SO2的吸收效率,应降低含硫烟气的温度、减小烟气流速。在天然海水中加入生石灰也可以提高SO2的吸收效率。(2)H2SO3具有还原性,能被氧气氧化为H2SO4。(3)该测定实验的原理是烟气通过一定浓度一定体积的I2—淀粉溶液后,其中的SO2与I2发生氧化还原反应,恰好完全反应时,溶液的蓝色消失,根据碘的物质的量可求出SO2的物质的量(体积);余下的气体排入广口瓶,将水压入量筒,由量筒中水的体积可确定剩余气体的体积。能与SO2反应且能明确指示反应终点的是酸性KMnO4溶液和溴水,故它们可以代替试管中的I2—淀粉溶液。
相关文档
- 人教版高中化学选修5课件 第2章 第2021-07-0823页
- 2019-2020学年高中化学作业6元素周2021-07-086页
- 初高中化学衔接26物质构成的奥秘2021-07-0816页
- 2020_2021学年新教材高中化学第1章2021-07-088页
- 2020_2021学年新教材高中化学第2章2021-07-0814页
- 2019-2020学年高中化学人教版必修22021-07-0812页
- 2020_2021学年新教材高中化学第3章2021-07-088页
- 2020高中化学第一章原子结构与元素2021-07-089页
- 2020版新教材高中化学第1章原子结2021-07-0831页
- 高中化学作业11醇含解析 人教版选2021-07-085页