- 841.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题 11.5 探究性化学实验
1、掌握化学探究性实验方案设计的原则和方法
2、掌握探究型实验题的题型的解题思路与技巧。
一、探究性实验设计的原则
(1)科学性的原则。所设计的实验应该符合科学道理,不能凭空捏造。
(2)对照性的原则。要设计一个对照性的实验,要想这个实验更能够说明问题,一定
要有正反两个 方面的实验。
(3)等量性的原则。所设计的实验中的平行反应,试剂的取用应该是等量的。
(4)单因子的变量原则。对某个实验的影响,会有很多的因素,实验正是要人为控制条件
,使众多变量 中,只能有一个因素是变量,其余几个是一样的。
二、探究性实验的设计
1、对未知产物的探究
通过化学反应原理猜测可能生成哪些物质,对这些物质逐一进行检验来确定究竟含有哪些
物质。虽然探究性实验主要考查学生的探究能力,但在问题中常常包含了对实验基础知识
的考查。如:
(1)常见物质分离的提纯方法:结晶法、蒸馏法、过滤法、升华法、萃取法、渗析法等。
(2)常见气体的制备、净化、干燥、收集等方法。
(3)熟悉重点的操作:气密性检查、测量气体体积、防倒吸、防污染等。
正确解答此类试题的关键:①猜测要全面;②熟记常见物质的检验方法。
2、物质性质的探究
(1)在探究过程中往往可以利用对比实验,即设置几组平行实验来进行对照和比较,从而
研究和揭示某种规律,解释某种现象形成的原因或证明某种反应机理。
(2)无机物、有机物性质的探究,必须在牢牢掌握元素化合物知识的基础上,大胆猜想,
细心论证。脱离元素化合物知识,独立看待实验问题是不科学的,只有灵活运用已有
的元素化合物知识,才能变探究型实验为验证型实验,使复杂问题简单化。
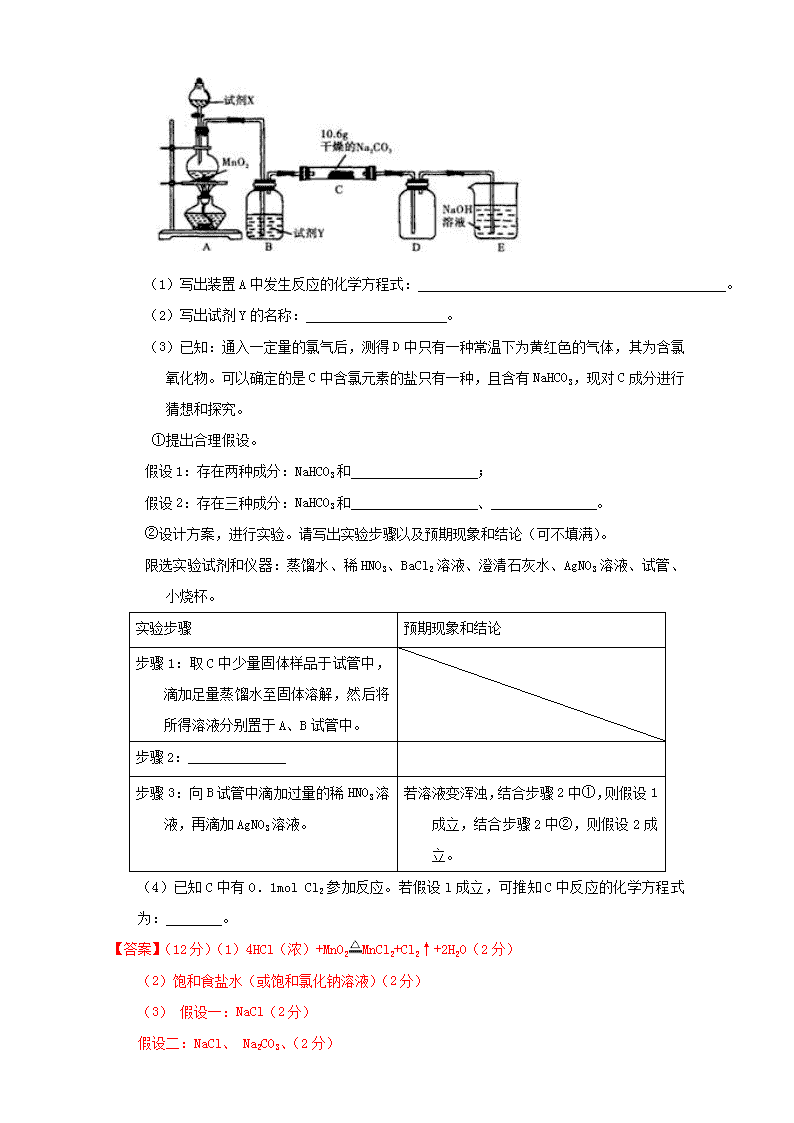
【典型例题 1】【江苏省清江 2016 届第三次月考】某化学活动小组设计如下图所示(部分夹持
装置已略去)实验装置,以探究潮湿的 Cl2 与 Na2CO3 反应得到的固体物质。
( 1 ) 写 出 装 置 A 中 发 生 反 应 的 化 学 方 程
式: 。
(2)写出试剂 Y 的名称: 。
(3)已知:通入一定量的氯气后,测得 D 中只有一种常温下为黄红色的气体,其为含氯
氧化物。可以确定的是 C 中含氯元素的盐只有一种,且含有 NaHCO3,现对 C 成分进行
猜想和探究。
①提出合理假设。
假设 1:存在两种成分:NaHCO3 和 ;
假设 2:存在三种成分:NaHCO3 和 、 。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀 HNO3、BaCl2 溶液、澄清石灰水、AgNO3 溶液、试管、小
烧杯。
实验步骤 预期现象和结论
步骤 1:取 C 中少量固体样品于试管中,
滴加足量蒸馏水至固体溶解,然后将
所得溶液分别置于 A、B 试管中。
步骤 2:______________
步骤 3:向 B 试管中滴加过量的稀 HNO3 溶
液,再滴加 AgNO3 溶液。
若溶液变浑浊,结合步骤 2 中①,则假设
1 成立,结合步骤 2 中②,则假设 2
成立。
(4)已知 C 中有 0.1mol Cl2 参加反应。若假设 l 成立,可推知 C 中反应的化学方程式
为: 。
【答案】(12 分)(1)4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O(2 分)
(2)饱和食盐水(或饱和氯化钠溶液)(2 分)
(3) 假设一:NaCl(2 分)
假设二:NaCl、 Na2CO3、(2 分)
实验步骤 预期现象和结论
步骤 2:向 A 试管中滴加 BaCl2 溶液,
(2 分)
若先无明显现象,证明固体中不含碳酸
钠。(1 分)
若溶液变浑浊,证明固体中含碳酸钠。(1
分)
(4)2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O↑
考点:考查了探究性化学实验的实验设计
【点评】探究性化学实验题在近几年的高考中频频出现,这类题具有综合性强,开放性强等特
点,能很好地考查学生分析问题、解决问题和创新思维的能力,这种题的区分度高,高考
中具有很好的选拔功能。解探究性实验题的基本程序可用下列流程图表示:
提出
问题
→提出猜想→设计验证方案→观察实验发现特殊现象,提出新猜想现象→
得出
结论
。
【迁移训练 1】【百强校·2016 届临川二中、九江一中下学期联考】 镁是最轻的结构金属材料
之一,又具有比强度和比刚度高、阻尼性和切削性好、易于回收等优点。国内外将镁合金
应用于汽车行业,以减重、节能、降低污染,改善环境。但金属镁性质活泼,能与空气中
的 O2、N2、CO2 等反应,也能与沸水反应。其中,Mg 与 N2 反应的产物 Mg3N2 与水反应:Mg3N2
+6H2O=3Mg(OH)2+2NH3↑。请回答下列问题:
(1)甲组学生研究 Mg 能在 CO2 气体中燃烧,并研究其产物。将镁条在空气中加热点燃后
迅速插入盛放 CO2 气体的集气瓶中,观察到的现象是_________________________;化学反
应方程式是________________
(2)乙组学生根据上述甲组实验,认为 Mg 能在 NO2 中燃烧,可能产物为 MgO、N2 和 Mg3N2。
通过如下实验装置来验证反应产物(夹持装置省略,部分仪器可重复使用)。
已知:NO2 气体能被 NaOH 吸收。NH3·H2O 的电离常数与 CH3COOH 电离常数相等,均为
1.75×10-5。
①乙组同学的装置中,依次连接的顺序为 A__________(填字母序号);装置 B 中的作
用是_________
②确定产物中有 N2 生成的实验现象为____________________________________
(3)设计实验证明:
①产物中存在 Mg3N2:
②MgO 和 Mg(OH)2 溶于铵盐溶液是与 NH4
+直接反应,不是与 NH4
+水解出来的 H+反应:
【答案】(1)剧烈燃烧,发出耀眼白光,反应后在集气瓶内部附着白色粉末和黑色颗粒;
2Mg+CO2 2MgO+C (2)①BCBED;在 C 的两侧防止水蒸气进入 C 中与产物 Mg3N2 反
应
②D 中试剂瓶中的水被气体压入烧杯中 (3)①取 C 中少量反应产物,加入到水中产生
刺激性气味的气体,该气体可使湿润的红色石蕊试纸变蓝 ②将①中加水后的溶液加热,
赶走 NH3 后,再加入过量的 CH3COONH4 溶液,固体溶解,说明 MgO 和 Mg(OH)2 溶于铵盐溶
液是与 NH4
+直接反应,不是与 NH4
+水解出来的 H+反应
考点:考查了物质性质的探究实验的相关知识。
【典型例题 2】【江西省上高二中 2016 届第三次月考】过氧化钠(Na2O2)是常见物质,常见的过
氧化物还包括过氧化钙(CaO2)。已知:过氧化钠与 CO2 反应有气体生成,而将 SO2 通入过氧化
钠粉末中也有气体生成。有人提出 CO2、SO2 与过氧化钠的反应原理相同,但也有人提出 SO2
具有较强的还原性,CO2 无强还原性,反应原理不相同。据此设计如下实验操作进行判断。
实验一:向一定量的过氧化钠固体中通入足量的 SO2,取反应后的固体进行实验探究,以证
明过氧化物与 SO2 反应的特点。
(1)提出假设:
假设 1:反应后固体中只有 Na2SO3,证明 SO2 未被氧化;
假设 2:反应后固体中只有 Na2SO4,证明 SO2 完全被氧化;
假设 3: ,证明 。
实验探究:
实验二:通过测量气体的体积判断发生的化学反应,实验装置如下:
(2)试剂 A 可以选用________,试剂 B 的作用是________。
(3)实验测得装置 C 中过氧化钠质量增加了 m1g,装置 D 质量增加了 m2g,装置 E 中收集到
的气体为 VL(已换算成标准状况下),用上述有关测量数据判断,SO2 未被氧化、完全
被氧化的 V-m1 关系式。未被氧化:_______,完全被氧化:__________。
(4)若 SO2 完全被氧化,写出反应的化学方程式: __________________________。
【答案】(1)Na2SO3 和 Na2SO4 的混合物(2 分) SO2 被部分氧化(2 分)
(2)浓 H2SO4 (2 分) 吸收未反应的 SO2 (2 分) (3)V=7m1/30 (2 分) V=0 (2 分)
(4)SO2+Na2O2=Na2SO4(2 分)
【考点定位】本题主要是考查二氧化硫性质以及 SO2 和过氧化钠反应的实验探究
【点评】这类实验常用的探究点如下,我们可以根据其进行假设猜想。
(1)与反应物性质有关的探究点;(2)与生成物性质有关的探究点;(3)与实验装置有
关的探究点;(4)与实际问题有关的探究点;(5)与绿色实验有关的探究点。
【迁移训练 2】【广东仲元 2016 届 11 月月考】某研究性学习小组将一定浓度的 Na2CO3 溶液滴入
CuSO4 溶液中得到蓝色沉淀。
甲同学认为沉淀可能是 CuCO3;乙同学认为沉淀可能是 Cu(OH)2;
丙同学认为沉淀可能是 CuCO3 和 Cu(OH)2 的混合物。(查阅资料知:CuCO3 和 Cu(OH)2 均不带
结晶水)
Ⅰ、(1)按照甲同学的观点,发生反应的离子反应方程式为______________________;
(2)在探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,检验沉淀是否洗涤
干净的方法是 。
Ⅱ、请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
(1)各装置连接顺序为_________→_________→___________。
(2)能证明生成物中有 CuCO3 的实验现象是_____________________________________。
Ⅲ、若 CuCO3 和 Cu(OH)2 两者都有,可利用下列装置通过实验测定其组成。
(1)装置 C 中碱石灰的作用是_________________________________________。
(2)若沉淀样品的质量为 m 克,装置 B 质量增加了 n 克,则沉淀中 CuCO3 的质量分数为
_______。
【答案】Ⅰ、(1)CO3
2-+Cu2+=CuCO3↓
(2)取最后一次洗涤液,滴加 BaCl2 溶液,无沉淀生成,说明已洗净。
Ⅱ、(1)A→C→B (2)装置 B 中澄清石灰水变浑浊
Ⅲ、(1)吸收空气中的水蒸气和 CO2 (2) 1-(49n/9m)
考点:本题主要是化学实验设计与探究
考点一:规律探究与变量控制
控制变量法:物质变化往往受到多个因素的影响,在研究化学反应与外界因素之间的关系时,
对影响物质变化规律的因素或条件加以人为控制,使其他几个因素不变,集中研究其中一
个因素的变化所产生的影响,以利于在研究过程中,迅速寻找到物质变化的规律。常涉及
的题型有:(1)外因(浓度、温度、压强等)对化学反应速率、化学平衡的影响;(2)物质
性质的递变规律。
1、变量探究实验题的解题策略
解答变量探究类试题关键是在其他条件相同的前提下,只改变一个条件对研究对象的影响
规律。注意:选择数据要有效,且变量统一,否则无法作出正确判断。
分析思路为:
2、规律探究实验题的解题策略
物质性质递变规律的探索也是化学实验探索的一个重要内容。研究同周期、同主族元素性
质的递变规律,物质的氧化还原反应(如置换反应)规律,物质的酸(碱)性强弱规律,电解
质溶液的导电规律等,都是开展有关规律探究的重要素材,也是高考命题的经典情境。
解决有关规律探究问题的实验设计,其常用方法示例如下:
(1)同周期、同主族元素性质的递变规律,一般通过设计判断元素金属性、非金属性的强
弱实验来完成,如通过让金属单质与相同浓度的非氧化性酸反应产生 H2 的速率快慢
来判断金属单质的还原性强弱,推断元素金属性强弱,从而找出相应的性质递变规律。
(2)物质的酸(碱)性强弱的判断。
(3)钢铁发生电化学腐蚀的规律探究。可以通过控制所含的杂质是否与空气接触、所接触
的电解质溶液的酸碱度、钢铁在腐蚀过程中体系内的气压变化等角度设计实验,找出
规律。
【典型例题 3】【百强校·2016 届正定上学期第五次月考】(12 分)某红色固体粉末样品可能含
有 Fe2O3 和 Cu2O 中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究,查阅
资料:Cu2O 在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
实验探究一:学生甲利用如图所示装置进行实验,称量反应前后装置 C 中样品的质量,以
确定样品的组成.回答下列问题:
(1)仪器组装完成后,夹好止水夹,__________________,则说明装置 A 的气密性良好。
(2)从下列实验步骤中,选择正确的操作顺序:_____________________(填序号)。
①打开止水夹 ②熄灭 C 处的酒精喷灯 ③C 处冷却至室温后,关闭止水夹
④点燃 C 处的酒精喷灯 ⑤收集氢气并验纯
实验探究二:
(3)学生乙取少量样品于烧杯中,加入过量稀硫酸,并作出如下假设和判断,结论正确的
是________。
A.若固体全部溶解,说明样品中一定含有 Fe2O3,一定不含有 Cu2O
B.若固体部分溶解,说明样品中一定含有 Cu2O,一定不含有 Fe2O3
C.若固体全部溶解,再滴加 KSCN 溶液,溶液不变红色,说明样品一定含有 Fe2O3 和
Cu2O
另取少量样品于试管中,加入适量的浓硝酸,产生红棕色气体证明样品中一定含有
________,写出产生上述气体的化学方程式_______________________。
实验探究三:
(4)学生丙取一定量样品于烧杯中,加入足量的稀硫酸,反应后经过滤得到固体 3.2g,
测得滤液中 Fe2+有 1.0 mol,则样品中 n(Cu2O)=_______________mol。
【答案】(1)向装置 A 中的长颈漏斗内注入液体至形成一段液注,过一段时间若液柱高度保持
不变(2 分)
(2)①⑤④②③(2 分) (3)C(2 分) Cu2O (2 分)
Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O;(2 分) (4)0.55 (2 分)
考点:考查了氧化还原反应、探究物质的组成实验设计的相关知识。
【点评】探究型实验包括发现问题、提出问题、猜想与假设、设计实验、实施实验、观察现象、
对现象进行记录和分析、收集数据、解释与得出结论、反思与评价和表达与交流等要素,
试题可以涉及其中的一个或几个要素进行设问。
【迁移训练 3】【百强校·2016 届静海一中期末】Ⅰ.下图所示的实验,能达到实验目的的
是 。
A B C D
验证化学能
转化为电能
验证温度对化学平衡
的影响
验证铁
发生析氢腐蚀
验证 AgCl
溶解度大于 Ag2S
Ⅱ.某同学为了验证 Fe3+是否能氧化 H2SO3 生成了 SO4
2–,他用 50mL0.1mol/LFeCl3 溶液吸
收制取 SO2 气体的尾气,再进行以下实验:
(1)向 FeCl3 溶液中通入一定量的 SO2,反应的离子方程式: ;
(2)检验吸收液中 SO4
2–的方法: ;
(3)吸收液中除了含有 H+、Cl–、SO4
2–以外,对其它成份(Fe3+、Fe2+、H2SO3)的可能组
合进行探究:
①提出假设。
假设 1:溶液中存在 Fe3+、Fe2+;
假设 2:溶液中存在 ;
假设 3:溶液中存在 Fe2+ 而不存在 H2SO3 (二者恰好完全反应)。
②设计方案、进行实验,验证假设。请在表中写出实验步骤以及预期现象和结论(可以
不填满)。限选..实验试剂和仪器:试管、滴管、0.1moL L-1KMnO4、0.1moL L-1KSCN 溶液、
品红溶液。
实验步骤 预期现象和结论
步骤 1:用试管取样品溶液 2~3mL,
再用滴管取
(2)若出现红色,则假设 1 成立;
(2)若未出现红色,则假设 2 或假设 3 成立。
步骤 2:
【答案】Ⅰ.B Ⅱ.(1)SO2 +2H2O+2Fe3+=2Fe2++SO4
2- +4H+
(2)取少量样品溶液于试管中,先滴入足量的稀盐酸,再滴入氯化钡溶液,有白色沉淀生成
(3) ①假设 2:Fe2+、H2SO3
②.
实验步骤 预期现象和结论
步聚 1:向试管中滴入 1~2 滴 0.1mol/LKSCN 溶液(1
分)
步骤 2:另取 2~3mL 样品溶液于试管中滴入 1~2mL
品红稀溶液(1 分)
1.若品红溶液红色褪色,假设 2 成立(1
分);
2.若品红溶液不褪色,结合步骤 1 中的
(2)则假设 3 成立(1 分)
考点:考查化学实验方案设计、探究与评价
相关文档
- 高考化学大一轮复习专题2从海水中2021-07-0817页
- 2020届高考化学一轮复习烃的含氧衍2021-07-088页
- 江苏省2020高考化学二轮复习题型五2021-07-08124页
- 2020年河北省衡水中学高考化学模拟2021-07-089页
- 全国卷I2020届高考化学模拟试卷精2021-07-0812页
- 2020届高考化学二轮复习化学与STSE2021-07-083页
- 2020届高考化学二轮复习化学与生活2021-07-085页
- 2020届高考化学一轮复习金属的电化2021-07-0813页
- 2021高考化学一轮复习课时达标作业2021-07-089页
- 2020届高考化学一轮复习等效平衡作2021-07-0817页