- 519.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
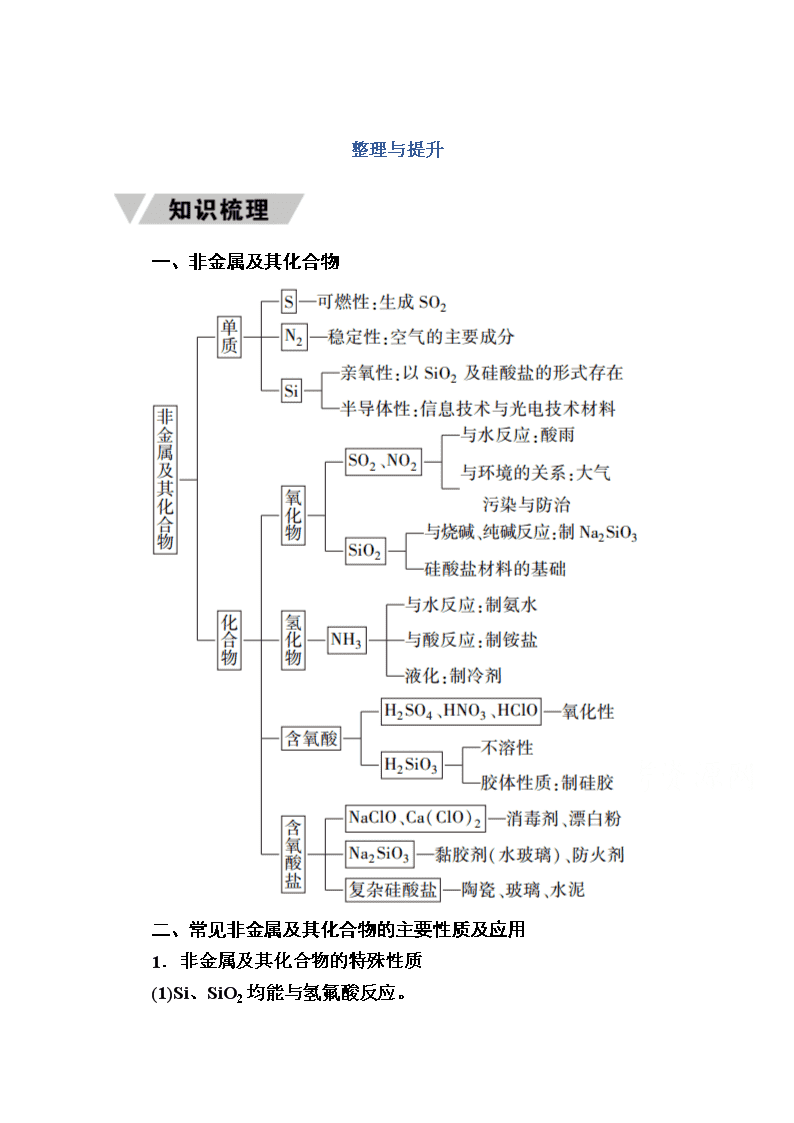
整理与提升
一、非金属及其化合物
二、常见非金属及其化合物的主要性质及应用
1.非金属及其化合物的特殊性质
(1)Si、SiO2均能与氢氟酸反应。
(2)氯水具有多种性质:酸性、漂白性、强氧化性。
(3)SO2具有漂白性、较强的还原性,可被卤水、酸性KMnO4氧化。
(4)浓硫酸具有三大特性:吸水性、脱水性、强氧化性。
(5)NH3的水溶液呈碱性。
(6)稀硝酸、浓硝酸都具有强氧化性,与金属反应均不生成H2。
(7)硅酸的酸性弱于碳酸,但可发生反应
SiO2+Na2CO3Na2SiO3+CO2↑,SiO2+CaCO3
CaSiO3+CO2↑。
2.特征反应
(1)特征反应条件
(2)同一反应,条件不同,产物不同
①浓度不同,产物不同
如稀硝酸与Cu反应生成NO,浓硝酸与Cu反应生成NO2。
②温度不同,产物不同
如氯气与NaOH溶液,常温下生成NaClO,加热时生成NaClO3。
3.特征转化关系
一、实验室中气体的制备、净化收集及尾气处理
1.气体的发生装置
(1)加热固体药品制取气体(图①),如制取氨气。
(2)固体与液体反应不加热制取气体(图②),如制取二氧化碳。
(3)固体与液体或液体与液体反应加热制取气体(图③),如制取氯气。
2.气体的净化干燥装置
结合气体杂质的性质,如果想用液体试剂来除杂就选用图A装置,如果想用固体试剂来除杂就选用图B、C装置。
3.气体的收集装置
气体的收集装置的选择要根据气体的水溶性是否与氧气反应及气体的密度。一般有排空气法、排液(水)法,也可将气体直接装入贮气袋中。
(1)排空气法:
(2)排液(水)法:
4.尾气处理装置
对于有毒或对空气有污染的气体,要进行尾气处理。结合气体的性质可以选择用吸收剂吸收、燃烧或装袋集中处理的方法。
1.如图中a、b、c表示相应仪器中加入的试剂,可用图中装置制取、净化、收集的气体是( B )
编号
气体
a
b
c
A
NH3
浓氨水
生石灰
碱石灰
B
CO2
盐酸
碳酸钙
饱和NaHCO3溶液
C
NO
稀硝酸
铜屑
H2O
D
NO2
浓硝酸
铜屑
NaOH溶液
解析:A项NH3应采用向下排空气法收集,且固体干燥剂一般用干燥管或U形管盛装;B项,CaCO3+2HCl===CaCl2+CO2↑+H2O,CO2中的HCl可用饱和NaHCO3溶液除去,并用向上排空气法收集CO2;C项,NO不能用排空气法收集;D项,NO2能被NaOH溶液吸收。
二、氮的氧化物溶于水的计算方法
NO2和NO有如下反应:
3NO2+H2O===2HNO3+NO①
2NO+O2===2NO2②
4NO2+O2+2H2O===4HNO3③
4NO+3O2+2H2O===4HNO3④
1.NO和NO2的混合气体
NO、NO2的混合气体溶于水时仅涉及反应①:
可利用气体体积变化差值进行计算
V剩=V(NO)原+V(NO2)
2.NO2和O2的混合气体
NO2和O2的混合气体溶于水时涉及反应③:
其计算如下表:
x=
0
反应情况
O2过量,剩
余气体为O2
恰好完
全反应
NO2过量,剩
余气体为NO
3.NO和O2的混合气体
NO、O2的混合气体溶于水时涉及反应④:
其计算如下表:
x=
0
反应情况
O2过量,剩
余气体为O2
恰好完
全反应
NO过量,剩
余气体为NO
2.将充满NO2和O2的混合气体的量筒倒置于水中,充分反应后,保持气体压强不变,水进入至量筒体积的一半处停止了,则原混合气体中NO2和O2的体积比是23。
解析:3NO2+H2O===2HNO3+NO①
2NO+O2===2NO2②
由方程式①×2+②得:
4NO2+O2+2H2O===4HNO3③
由方程式①×2+②×3得:
4NO+3O2+2H2O===4HNO3④
NO2和O2的体积比不等于41,则需讨论NO2和O2分别过量时的两种情况。
设混合气体的体积为1,混合气体中NO2的体积为x,则O2为(1-
x)。
(1)假定原混合气体中V(NO2)V(O2)<41
4NO2+O2+2H2O===4HNO3
4 1
x y
=
解得y=,剩余的O2:(1-x)-=
解得x=
V(NO2)V(O2)=(1-)=23。
(2)假定原混合气体中V(NO2)V(O2)>41
4NO2+O2+2H2O===4HNO3
4 1
y (1-x)
=
解得y=4(1-x)
暂时剩余NO2:1-[4(1-x)+(1-x)]=5x-4
由反应式:3NO2+H2O===2HNO3+NO可知最后剩余NO:
由=得x=(不合题意,舍去)。。
三、硝酸与金属反应的有关计算方法
1.依据守恒规律计算
(1)电子守恒:硝酸与金属反应属于氧化还原反应,N原子得到的电子数等于金属原子失去的电子数,由此可求出氮元素被还原后的价态,根据价态确定反应产物。
(2)原子守恒:硝酸与金属反应时,一部分以NO
的形式存在,一部分转化为还原产物,这两部分中N的物质的量之和与反应消耗的HNO3中N的物质的量相等。
2.利用离子方程式计算
HNO3与H2SO4混合液跟金属的反应,当金属足量时,不能用HNO3与金属反应的化学方程式计算,应用离子方程式计算,因为生成的硝酸盐的NO借助H+仍能继续与金属反应。
3.将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
(1)NO的体积为5.8 L(保留一位有效数字,下同),NO2的体积为5.4 L。
(2)参加反应的HNO3的物质的量是1.52_mol。
(3)待产生的气体全部释放后,向溶液中加入V mL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol·L-1。
解析:(1)n(Cu)==0.51 mol,设混合气体中NO的物质的量为x,NO2的物质的量为y。
根据气体的总体积为11.2 L,有:x+y=0.5 mol ①。
根据“得失电子守恒”,有:3x+y=0.51 mol×2 ②。(重要的隐含条件!)
②式中,左边为N原子得电子数,右边为Cu原子失电子数,得失电子数相同。
解方程组得:x=0.26 mol,y=0.24 mol。
则:V(NO)=0.26 mol×22.4 L·mol-1≈5.8 L,
V(NO2)=11.2 L-5.8 L=5.4 L。
(2)参加反应的HNO3分两部分:一部分没有被还原,显酸性,生成Cu(NO3)2;另一部分被还原成NO2和NO,所以参加反应的HNO3
为0.51 mol×2+0.5 mol=1.52 mol。
(3)HNO3在反应中一部分变成气体,一部分以NO的形式留在溶液中。变成气体的HNO3的物质的量为0.5 mol。加入NaOH溶液至恰好使溶液中Cu2+全部转化为沉淀,则溶液中只有NaNO3,其物质的量为10-3aV mol,也就是以NO形式留在溶液中的HNO3的物质的量为10-3aV mol。所以,
c(HNO3)= mol·L-1。
相关文档
- 2020高中化学第二章烃和卤代烃第三2021-07-089页
- 2020_2021学年新教材高中化学第2章2021-07-088页
- 高中化学第五章化工生产中的重要非2021-07-085页
- 高中化学:1-4-1《研究有机化合物的2021-07-0812页
- 2021年1月重庆市普通高中学业水平2021-07-0810页
- 2020版高中化学课时作业1元素周期2021-07-086页
- 高中物理 第13章 第2节全反射课件 2021-07-0843页
- 2019-2020学年高中化学课时作业3核2021-07-087页
- 2020版高中化学课时作业5元素周期2021-07-085页
- 2020_2021学年新教材高中化学第一2021-07-087页